Coffein
Coffein oder Koffein (auch Tein, Teein oder Thein, früher auch Caffein) ist ein Alkaloid (Purinalkaloid) aus der Stoffgruppe der Xanthine. Es gehört zu den psychoaktiven Substanzen mit stimulierender Wirkung und ist das weltweit am meisten konsumierte Alkaloid.[4]
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
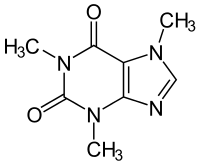 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Coffein | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C8H10N4O2 | |||||||||||||||||||||
| Kurzbeschreibung |
farb- und geruchsloser Feststoff[2] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
N06BC01 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | ||||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte |
1,23 g·cm−3 (18 °C)[2] | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
| |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Coffein ist ein die Aktivität von Nerven anregender Bestandteil von Genussmitteln wie Kaffee, Tee, Cola, Mate, Guaraná, Energy-Drinks und (in geringeren Mengen) von Kakao. In chemisch reiner Form tritt es als weißes, geruchloses, kristallines Pulver mit bitterem Geschmack auf.
Geschichte

Auf Anregung Goethes untersuchte der Apotheker und Chemiker Friedlieb Ferdinand Runge Kaffeebohnen mit dem Ziel, die wirksame Substanz im Kaffee zu finden. 1819 gelang es Runge erstmals, aus den Kaffeebohnen reines Coffein zu isolieren. Er kann somit als Entdecker des Coffeins angesehen werden. Unabhängig von Runge gelang im Jahre 1821 den französischen Apothekern Pierre Joseph Pelletier, Joseph Bienaimé Caventou und Pierre-Jean Robiquet gemeinsam ebenfalls die Isolation des Coffeins. 1832 konnten Christoph Heinrich Pfaff und Justus von Liebig mit Hilfe von Verbrennungsdaten die Summenformel C8H10N4O2 bestimmen. Die chemische Struktur wurde 1875 von Ludwig Medicus als 1,3,7-Trimethylxanthin angenommen. Die vorerst nur angenommene Struktur konnte Emil Fischer 1895 durch die erste Synthese des Coffeins bestätigen. Der Wirkungsmechanismus wurde erst im 20. Jahrhundert erfolgreich erforscht.
Der in Grüntee und Schwarztee enthaltene Wirkstoff, in der Umgangssprache oft als „Tein“, „Thein“ oder „Teein“ bezeichnet, ist ebenfalls Coffein. Diese früher übliche Unterscheidung zwischen Coffein aus Kaffee und Tein aus Tee beruht auf der unterschiedlichen Freisetzung des Alkaloids im menschlichen Organismus: Coffein aus Kaffee ist an einen Chlorogensäure-Kalium-Komplex gebunden, der nach der Röstung und Kontakt mit der Magensäure sofort Coffein freisetzt und damit schnell wirkt. Coffein aus Tee hingegen ist an Polyphenole gebunden, wobei das Alkaloid erst im Darm freigesetzt wird. Die Wirkung tritt dann später ein und hält länger an.[14]
Die ersten medizinischen Anwendungen waren der Einsatz als Aufputschmittel (Stimulans) und Diuretikum sowie (wie schon Kaffee seit dem 18. Jahrhundert) als Medikament zur Behandlung von Atemstörungen bei Asthma bronchiale. Die atemanregende bzw. atemanaleptische und bronchienerweiternde Wirkung wurde 1912 von Jakob Pál beschrieben.[15]
Vorkommen


Coffein ist der Hauptwirkstoff des Kaffees. Außer in den Samen des Kaffeestrauchs kommt es auch in über 60 anderen Pflanzen vor, wie zum Beispiel dem Teestrauch, Guaraná, Guayusa, dem Mate-Strauch und der Kolanuss. Die chemisch mit Coffein eng verwandten Wirkstoffe Theophyllin und Theobromin finden sich ebenso in zahlreichen Pflanzenspezies. Ungeröstete Kaffeebohnen enthalten je nach Sorte etwa 0,9–2,6 % Coffein; nach der Röstung verbleiben 1,3–2,0 %. Dabei enthalten die Coffea-arabica-Sorten weniger Alkaloid als die Coffea-robusta-Typen.[14] Fermentierte und getrocknete Teeblätter, sogenannter Schwarzer Tee, enthalten – ebenso wie unfermentierter Grüner Tee[16] – etwa 3–3,5 % Coffein.[17]
In den Pflanzen (insbesondere in ungeschützten Keimlingen) wirkt es als Insektizid, indem es bestimmte Insekten betäubt oder tötet.[18]
Gewinnung
Coffein kann mittels Extraktion aus Teeblättern oder Kaffeebohnen, zum Beispiel mit einem Soxhlet-Aufsatz, gewonnen werden. Es fällt in großen Mengen bei der industriellen Entkoffeinierung von Kaffee an, wobei als Extraktionsmittel entweder Dichlormethan, Essigsäureethylester oder überkritisches Kohlenstoffdioxid verwendet werden. Daneben wird Coffein hauptsächlich mittels Traube-Synthese industriell hergestellt.
Eigenschaften
Coffein ist ein Trivialname, der der Substanz wegen des Vorkommens in Kaffee gegeben wurde. Nach der systematischen IUPAC-Nomenklatur lautet die vollständige Bezeichnung 1,3,7-Trimethyl-2,6-purindion, eine Kurzform 1,3,7-Trimethylxanthin – nach der chemischen Ableitung des Coffeins vom Xanthin. Es gehört zur Gruppe der natürlich vorkommenden Purine (Purinalkaloide), genauso wie die strukturähnlichen Dimethylxanthine Theophyllin und Theobromin.
Die Struktur des Coffeins besteht aus einem Doppelring, an dem sich außen mehrere Substituenten befinden. Dieser Doppelring im Kern entspricht der Grundstruktur des Purins. Er besteht aus zwei Ringen, einem 6er- und einem 5er-Ring, die jeweils zwei Stickstoff-Atome enthalten. Außen findet man an C-2 und C-6 jeweils ein doppelt gebundenes Sauerstoff-Atom. Beim Coffein befindet sich an N-1, N-3 und N-7 noch jeweils eine Methylgruppe (-CH3). Daneben gibt es noch das Isocoffein, bei dem eine der Methylgruppen nicht am N-7, sondern am N-9 hängt. Dem Theophyllin fehlt von den drei Methylgruppen die an N-7, dem Theobromin fehlt die an N-1.
Reines Coffein ist unter normalen Bedingungen ein weißes, geruchloses, kristallines Pulver mit bitterem Geschmack. Coffein tritt in zwei enantiotrop polymorphen Kristallformen auf. Die bei Raumtemperatur stabile β-Form (Tieftemperaturform) wandelt sich bei 141 °C in die α-Form (Hochtemperaturform) um.[19] Diese schmilzt bei 236 °C.[3] Die Rückumwandlung von α- zur β-Form ist kinetisch gehemmt, so dass die α-Form über Wochen bei Raumtemperatur metastabil sein kann. Die Verbindung ist leicht sublimierbar (ab 178 °C). Die Löslichkeit ist temperaturabhängig:

| Wasser | bei Normaltemperatur | 21,74 g·l−1 |
| bei 80 °C | 181,82 g·l−1 | |
| Ethanol | bei Normaltemperatur | 15,15 g·l−1 |
| bei 60 °C | 45,45 g·l−1 | |
| Aceton | 20,00 g·l−1 | |
| Chloroform | 181,82 g·l−1 | |
Coffein bildet bei Kristallisation aus Wasser ein kristallines Hydrat in Form langer Nadeln. Stöchiometrisch enthält das Hydrat im Kristallgitter 0,8 mol Wasser pro Mol Coffein.[21]
Xanthinderivate wie das Coffein werden als schwache Basen bezeichnet, da sie Protonen über ihre Stickstoffatome aufnehmen können. Dennoch sind Lösungen von Xanthinderivaten nicht alkalisch. Xanthinderivate werden zu den Alkaloiden gezählt. Als Alkaloide werden generell alle physiologisch wirksamen, niedermolekularen stickstoffhaltigen Verbindungen, insbesondere pflanzlicher Natur, bezeichnet.
Das neben der Coffeinbase pharmazeutisch ebenfalls verwendete Coffeincitrat, ein Coffein-Citronensäure-Gemisch (ASK, Nomenklatur nach IUPAC: 1,3,7-Trimethyl-3,7-dihydro-2H-purin-2,6-dion + 2-Hydroxypropan-1,2,3-tricarbonsäure) hat die Summenformel C14H18N4O9, eine molare Masse von 386,31 g·mol−1 und die CAS-Nummer 69-22-7. Es ist ein weißes kristallines Pulver, löslich 1:4 in heißem Wasser (Dissoziation), 1:25 in Ethanol 96 %.[22]
Pharmakologische Wirkungen
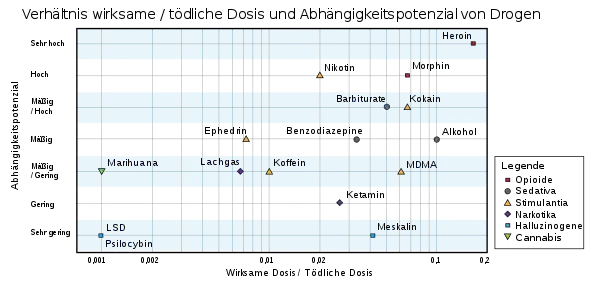
Die wesentlichen Wirkungen des Coffeins sind:[25][26]
- Anregung des Zentralnervensystems
- Erhöhung der Kontraktionskraft des Herzens
- Steigerung der Herzfrequenz (Pulssteigerung)
- Bronchialerweiterung (Bronchodilatation)
- Schwach harntreibende (diuretische) Wirkung durch Hemmung der Rückresorption von Wasser aus dem Primärharn
- Wirkung auf Blutgefäße: Auf Gefäße im Gehirn wirkt Coffein verengend, auf solche in der Peripherie erweiternd
- Geringfügige Erhöhung des Blutdrucks[27][28]
- Anregung der Peristaltik des Darmes
- Hemmung der Muskelkontraktionen in den Wänden der weiblichen Eileiter und somit Behinderung der Passage von befruchteten Eizellen in die Gebärmutter, mit der möglichen Folge einer verzögerten Empfängnis der Frau[29][30]
- Aktivierung der intrazellulären Adenylcyclase und damit Steigerung der intrazellulären Konzentration von cAMP[31] dadurch
- Förderung der Glycogenolyse und Lipolyse[25]
- Steigerung der Magensäureproduktion[31]
Coffein hat zwar ein relativ breites Wirkungsspektrum, doch ist es in geringen Dosen in erster Linie ein Stimulans. Darunter versteht man im Allgemeinen eine Substanz mit anregender Wirkung auf die Psyche, die Antrieb sowie Konzentration steigert und Müdigkeitserscheinungen beseitigt. Es wird eine anregende von einer erregenden Wirkung des Coffeins unterschieden, wobei für letztere eine höhere Dosis erforderlich ist. Bei niedriger Dosierung tritt fast ausschließlich die zentral anregende Wirkung des Coffeins hervor, es werden also vor allem psychische Grundfunktionen wie Antrieb und Stimmung beeinflusst. Durch eine höhere Dosis kommt es auch zu einer Anregung von Atemzentrum und Kreislauf.
Während höhere Coffeinkonzentrationen auch die motorischen Gehirnzentren beeinflussen, wirkt das Coffein in geringeren Konzentrationen hauptsächlich auf die sensorischen Teile der Hirnrinde. Aufmerksamkeit und Konzentrationsvermögen werden dadurch erhöht; die Steigerung von Speicherkapazität und Fixierung (mnestische Funktionen) erleichtert den Lernprozess. Mit der Beseitigung von Ermüdungserscheinungen verringert sich das Schlafbedürfnis. Die Erhöhung des Blutdrucks ist gering und verschwindet bei längerfristiger Einnahme; ein Effekt kann erst wieder beobachtet werden, nachdem die Coffeineinnahme mindestens 24 h abgesetzt wurde.[28] Verursacht wird die milde Blutdruckerhöhung durch die zentralnervöse Stimulierung (Erregung des vasomotorischen Zentrums); dem wirkt eine gleichzeitige Senkung durch die Herabsetzung des peripheren Widerstandes kompensatorisch entgegen.[25] Die Stimmung kann sich bis zu leichter Euphorie steigern. Infolge von Assoziationsbahnung verkürzen sich die Reaktionszeiten, was zu einer Beschleunigung des psychischen Tempos führt. Gleichzeitig kommt es zu einer – nur minimalen – Verschlechterung der Geschicklichkeit, speziell bei Aufgaben, die exaktes Timing oder komplizierte visuomotorische Koordination erfordern. Das breite Wirkungsspektrum verdankt Coffein mehreren Wirkungskomponenten, die auf molekularer Ebene in bestimmte Zellvorgänge eingreifen. Coffein kann die Blut-Hirn-Schranke fast ungehindert passieren und entfaltet seine anregende Wirkung hauptsächlich im Zentralnervensystem.
Einer neuen Studie nach sollte Coffein nicht nur die Konzentrationsfähigkeit steigern, die Vigilanz und Aufmerksamkeit verbessern und die Geschwindigkeit von Denkprozessen erhöhen, sondern auch das Langzeitgedächtnis verbessern.[32]
Coffein in Genussmitteln, wie z. B. in Schwarztee oder Cola, kann insbesondere für Kinder problematisch sein: So können z. B. drei Dosen Cola (je nach Quelle 65–250 mg[33] bzw. 150–350 mg[34] in 990 ml) ungefähr soviel Coffein wie zwei Tassen Kaffee enthalten (je nach Quelle 100–240 mg[35] oder 160–240 mg[34] Coffein in 250 ml Filterkaffee). Ein dreißig Kilogramm schweres Kind kann so auf eine Konzentration von 5–12 Milligramm Coffein pro Kilogramm Körpergewicht kommen; eine Dosis, die ausreicht, Nervosität und Schlafstörungen zu verursachen.
Coffein stand von 1984 bis 2004 auf der Dopingliste des Internationalen Olympischen Komitees, allerdings waren die Grenzwerte so hoch, dass Sportler durchaus Kaffee zum Frühstück trinken konnten. Dennoch wurde am 25. Juli 2000 der spanische Radprofi Óscar Sevilla (Team Kelme) „positiv“ auf Coffein getestet und daraufhin von seinem Verband von der Straßen-Weltmeisterschaft ausgeschlossen. Die World Anti-Doping Agency hat mit Wirkung zum 1. Januar 2004 das Stimulans Coffein von der Liste der verbotenen Substanzen gestrichen. Pasman u. a. (1995) verglichen die Auswirkungen von 0, 5, 9 bzw. 13 Milligramm pro Kilogramm Körpergewicht eine Stunde vor Belastung und stellten fest, dass alle Dosierungen größer als 0 eine signifikante leistungssteigernde Wirkung im Radfahrtest (80 % Wmax) hatten. Die niedrigste Dosierung lag unterhalb der Festsetzungsgrenze als Doping.[36] Im Pferdesport ist Coffein als Dopingmittel verboten.[37]
Die Eliminationshalbwertszeit beträgt beim Erwachsenen ca. 5 Stunden, bei Schwangeren ist sie deutlich verlängert. Verschiedene Medikamente können die Eliminationshalbwertszeit in beide Richtungen beeinflussen. Umgekehrt kann Coffein die Eliminationshalbwertszeit von Medikamenten beeinflussen.[31]
Die orale LD50 für eine Ratte liegt bei 381 Milligramm pro Kilogramm. Bei Menschen liegt die letale Dosis bei ungefähr 10 Gramm Coffein (5–30 g), was etwa 100 Tassen Kaffee entspricht.[38][39]
Wirkungsmechanismus
Die Wirkung des Coffeins begründet sich auf zellulärer Ebene wie folgt: Im Wachzustand tauschen Nervenzellen Botenstoffe aus und verbrauchen Energie. Dabei entsteht Adenosin als Nebenprodukt. Eine der Aufgaben des Adenosins besteht darin, das Gehirn vor „Überanstrengung“ zu schützen. Es setzt sich an bestimmte Rezeptoren auf den Nervenbahnen (die Adenosinrezeptoren vom Subtyp A2a). Ist Adenosin gebunden, ist das ein Signal für die Zelle, etwas weniger zu arbeiten. So entsteht ein negativer Rückkopplungseffekt: Je aktiver die Nervenzellen, desto mehr Adenosin wird gebildet und desto mehr Rezeptoren werden besetzt. Die Nervenzellen arbeiten langsamer. Das Coffein ist dem Adenosin in seiner chemischen Struktur ähnlich und besetzt dieselben Rezeptoren, aktiviert sie jedoch nicht. Adenosin kann nicht mehr andocken, und die Nervenbahnen bekommen kein Signal – deshalb arbeiten sie auch bei steigender Adenosinkonzentration weiter. Die Adenosinrezeptoren werden kompetitiv durch Coffein gehemmt.
Analgetische, also schmerzhemmende Effekte des Coffeins werden diskutiert. Als Mechanismus werden auch hier die antagonistischen Effekte an den Adenosinrezeptoren und die damit verminderte Wirkung des Adenosins auf das zentrale Nervensystem angenommen. Adenosin wirkt an den sensorischen Nervenendungen schmerzerzeugend, indem es direkt auf die spezifischen A2-Rezeptoren einwirkt und eine Schmerzüberempfindlichkeit (Hyperalgesie) verursacht.[40]
In höheren Dosen verhindert Coffein den enzymatischen Abbau von cyclischem Adenosin-3’,5’-monophosphat. Dieses spielt im menschlichen Organismus als second Messenger eine wichtige Rolle in der Regulation zellulärer Vorgänge. Coffein hemmt jene Enzyme, spezifische Phosphodiesterasen, die für den Abbau von cyclischem zu acyclischem AMP verantwortlich sind. So kommt es durch den gehemmten Abbau zu einem Anstieg der cAMP-Konzentration in den Zellen. cAMP führt unter anderem zur Aktivierung der Proteinkinase A, die wiederum (abhängig vom Gewebe) eine Vielzahl an Funktionen vermittelt, darunter die Freisetzung von Glucose in der Leber (über Gluconeogenese und Glycogenspaltung) und die ATP-Produktion zur Muskelkontraktion im Skelettmuskel. Darüber hinaus führt cAMP über die Aktivierung von Lipasen (HSL, ATGL) in Fettzellen zur Verstoffwechselung der dort gespeicherten Fette.[41][42]
Eine Studie am Duke University Medical Center in Durham, North Carolina, aus dem Jahre 2004 zeigte auf, dass die Zufuhr von Coffein in Kombination mit dem Konsum einer kohlenhydrathaltigen Mahlzeit den Blutzuckerwert sowie den Insulinwert bei Personen mit Diabetes Typ 2 erhöht.[43][44]
Toleranzentwicklung
Wenn ein Mensch über längere Zeit hohe Dosen Coffein zu sich nimmt, verändern sich die Nervenzellen. Sie reagieren auf das fehlende Adenosin-Signal und bilden mehr Rezeptoren aus, so dass wieder Adenosin-Moleküle an Rezeptoren binden können. Die Nervenzellen arbeiten langsamer. Die anregende Wirkung des Coffeins ist also stark eingeschränkt.[45] Bereits nach kurzer Zeit entwickelt sich eine derartige Toleranz.[46]
Entzugserscheinungen
Wird der Coffeinkonsum stark verringert, können Entzugserscheinungen auftreten (siehe unten), die aber meistens nur von kurzer Dauer sind. Coffein ist preisgünstig und legal verfügbar und das weltweit am häufigsten konsumierte Stimulans. Aus der wissenschaftlichen Literatur geht nicht klar hervor, ob Coffein als Suchtmittel anzusehen ist, es hat jedenfalls einige Gemeinsamkeiten mit typischen Suchtmitteln. Zu den wichtigsten gehören die Entwicklung von Toleranz sowie psychischer und körperlicher Abhängigkeit mit Entzugserscheinungen. Toleranz tritt bei nicht unbedingt übermäßigem, aber bei regelmäßigem Coffeingenuss auf.
Als Entzugssymptome wurden in einer empirischen Studie beobachtet:[47] Kopfschmerzen, Erschöpfung, Energieverlust, verminderte Wachsamkeit, Schläfrigkeit, herabgesetzte Zufriedenheit, depressive Stimmung, Konzentrationsstörungen, Reizbarkeit und das Gefühl, keine klaren Gedanken fassen zu können. In einigen Fällen kamen auch grippe-ähnliche Symptome hinzu. Die Symptome setzen zwölf bis 24 Stunden nach dem letzten Coffein-Konsum ein, erreichen nach 20 bis 51 Stunden das Symptommaximum und dauern etwa zwei bis neun Tage. Bereits eine geringe Menge Coffein führt zur Rückfälligkeit.
Zu den Symptomen des Entzugs gehören auch Veränderungen der Theta-Wellen im Gehirn.[48]
Überdosierung
Bei Überdosierung (Dosen von über 1 g beim erwachsenen Menschen) treten Angst- sowie Erregungserscheinungen, stark beschleunigter Puls und Extrasystolen auf;[49] zur Therapie können Kohletabletten, Verapamil und Diazepam gegeben werden.
In sehr hoher Konzentration (ab etwa 10 mM im Zellaußenraum) setzt Coffein Calcium2+-Ionen aus dem Endoplasmatischen Retikulum (ER) frei. Das geschieht durch seine spezifische Bindung an Ryanodin-Rezeptoren. Aufgrund dieser Eigenschaft wird Coffein in der physiologischen Forschung verwendet. Die benötigte Dosis übersteigt die letale Dosis von Säugetieren bei weitem, deshalb wird Coffein nur bei in vitro-Experimenten eingesetzt.
Wechselwirkungen
Es gibt u. a. Wechselwirkungen mit Arzneistoffen. Dies ist bei allen Untersuchungen entsprechend zu berücksichtigen. Eine Studie der EFSA (Europäische Behörde für Lebensmittelsicherheit) wies zum Beispiel darauf hin, dass nur der Konsum coffeinhaltiger Getränke untersucht wurde und nicht die Wirkung von Coffeinzusätzen in Lebensmitteln.[50] Mit kohlensäurehaltigen Getränken wird Coffein rascher aufgenommen. Coffein verstärkt die herzfrequenzsteigernde Wirkung von Sympathomimetika. Es wirkt beruhigenden Wirkstoffen wie Antihistaminika und Barbituraten entgegen. Es verstärkt die schmerzstillende Wirkung von Paracetamol und Acetylsalicylsäure. Disulfiram und Cimetidin reduzieren den Coffeinabbau im Körper. Rauchen sowie Barbiturate beschleunigen den Coffeinabbau im Körper. Die Ausscheidung von Theophyllin wird durch Coffein verringert. Bei gleichzeitiger Einnahme von Antibiotika der Gruppe Gyrasehemmer (Chinolon-Antibiotika) ist eine mögliche Verzögerung der Ausscheidung von Coffein und seinem Abbauprodukt Paraxanthin gegeben. Coffein kann eine mögliche Abhängigkeit von Substanzen vom Typ Ephedrin erhöhen.
Vorsichtsmaßnahmen für die Anwendung
Personen mit Leberzirrhose (mögliche Coffein-Anreicherung), Personen mit Herzarrhythmien, wie Sinustachykardien/Extrasystolen (mögliche Verstärkung), Personen mit Hyperthyreose (mögliche Verstärkung der Nebenwirkungen von Coffein) und Personen mit Angstsyndrom (mögliche Verstärkung) sollten Coffein nur in geringen Dosen einnehmen.
Coffein kann die Symptome von Angststörungen intensivieren.[51][52][53] Umgekehrt kann das Vermindern der Coffeineinnahme eine symptomlindernde Wirkung haben.[54]
Von regelmäßiger Einnahme hoher Dosen wird wegen des möglichen Auftretens von Coffeinismus abgeraten. Während einige Forscher aufgrund von Studien an Mäusen dazu raten, in der Schwangerschaft auf Coffein zu verzichten,[55][56] hält das American College of Obstetricians and Gynecologists in einer 2010 herausgegebenen Empfehlung eine Tagesdosis von 200 Milligramm Coffein für unbedenklich.[57] Eine brasilianische Studie ergab, dass moderater Coffeinkonsum in Schwangerschaft und Stillzeit in den ersten drei Lebensmonaten keinen Einfluss auf den Schlaf von Säuglingen zu haben scheint.[58] Eine Studie der EFSA (Europäische Behörde für Lebensmittelsicherheit), die den Konsum coffeinhaltiger Getränke untersuchte und auf Beobachtungen an rund 66.000 Personen beruht, kommt zu dem Schluss, dass eine Coffeinzufuhr von bis zu 400 mg pro Tag (das entspricht ungefähr 5,7 mg/kg Körpergewicht bei einer 70 kg schweren Person) als unbedenklich einzustufen ist.[50] Auch für Schwangere, Stillende und Kinder wurden Richtwerte ermittelt: Für schwangere und stillende Frauen gilt, dass eine über den gesamten Tag verteilte Coffein-Aufnahme aus allen Quellen von bis zu 200 mg pro Tag für den Fötus unbedenklich ist. Für Kinder und Jugendliche pendelt sich der Richtwert bei 3 mg/kg Körpergewicht ein und gilt bei dieser Dosierung als unbedenklich.[50]
Pharmakoepidemiologische Untersuchungen
Zur Pharmakoepidemiologie des Coffeins liegen Untersuchungen zum Einfluss des Coffeins auf den Blut-Lipidstatus aus nationalen Untersuchungen in der Bevölkerung der Bundesrepublik Deutschland vor. Unter anderem konnte eine Erhöhung der Triglyceride im Blutserum bei Probanden mit einem Gebrauch coffeinhaltiger Arzneimittel nachgewiesen werden.[59] Auch zum Coffein-Einfluss auf den Glucose- und Magnesium-Gehalt des Serums wurden Ergebnisse veröffentlicht. Danach wurden höhere Glucosespiegel und erniedrigte Magnesiumspiegel in Seren von Probanden gemessen, die coffeinhaltige Arzneimittel verwendeten.[60]
Mutagene Wirkung bei niederen Organismen
Auf Bakterien, Pilze und Algen kann Coffein mutagen wirken; dies wird vermutlich durch Hemmung von Reparaturmechanismen der DNA bei diesen Lebewesen verursacht. Bei höheren Tieren oder dem Menschen konnte eine solche Wirkung bisher nicht nachgewiesen werden.[28]
Pharmakokinetik
Der Metabolismus von Coffein ist speziesspezifisch. Bei Menschen werden etwa 80 % des aufgenommenen Coffeins durch das Enzym Cytochrom P450 1A2 zu Paraxanthin demethyliert und weitere etwa 16 % werden in der Leber zu Theobromin und Theophyllin umgesetzt. Durch weitere partielle Demethylierung und Oxidation entstehen Urate- und Uracil-Derivate. Aus dem Urin können etwa ein Dutzend unterschiedlicher Coffein-Metaboliten extrahiert werden, aber weniger als 3 % des ursprünglich aufgenommenen Coffeins. Die Hauptausscheidungsprodukte im Urin sind Di- und Monomethylxanthin sowie Mono-, Di- und Trimethylharnsäure.
Die Pharmakokinetik von Coffein hängt von vielen inneren und äußeren Faktoren ab. Die Resorption von Coffein über den Magen-Darm-Trakt in die Blutbahn erfolgt sehr rasch und nahezu vollständig: Etwa 45 Minuten nach der Aufnahme ist praktisch das gesamte Coffein aufgenommen und steht dem Stoffwechsel zur Verfügung (Bioverfügbarkeit: 90–100 %). Die maximale Plasmakonzentration wird 15–20 Minuten nach der Aufnahme des Coffeins erreicht. Die Verabreichung von 5–8 mg Coffein/kg Körpergewicht resultiert in einer Plasma-Coffeinkonzentration von 8–10 mg/l. Die biologische Halbwertszeit von Coffein im Plasma beträgt zwischen 2,5 und 4,5 Stunden (andere Quellen sprechen von 3–5 h) bei gesunden Erwachsenen. Dagegen erhöht sich die Halbwertszeit auf im Mittel 80 Stunden (36–144 h) bei Neugeborenen und auf weit über 100 Stunden bei Frühgeburten. Bei Rauchern reduziert sich die Coffein-Halbwertszeit um 30–50 %, während sie sich bei Frauen, die orale Verhütungsmittel einnehmen, verdoppelt. Bei Frauen, die sich im letzten Trimenon der Schwangerschaft befinden, steigt sie auf 15 Stunden an. Ferner ist bekannt, dass das Trinken von Grapefruitsaft vor der Coffeinzufuhr die Halbwertszeit des Coffeins verlängert, da bestimmte Inhaltsstoffe der Grapefruit die Metabolisierung des Coffeins in der Leber hemmen.
Analytik
Zur Analytik des Coffeins werden chromatographische Verfahren bevorzugt. Insbesondere die Gaschromatographie, die HPLC und Kopplungen dieser Trenntechniken mit der Massenspektrometrie sind in der Lage, die geforderte Spezifität und Sensitivität bei der Analytik komplexer Matrices in der physiologischen Forschung und in der lebensmittelchemischen Analytik zu gewährleisten.[61] In der pharmazeutischen Analytik wird auch die Dünnschichtchromatographie zur qualitativen und quantitativen Bestimmung von Coffein eingesetzt. Auch Enzymimmunoassays (EIA) für die Routineanalytik von Serum- oder Harnproben stehen zur Verfügung.[62] Die damit erzielten Ergebnisse können in Zweifelsfällen durch GC-MS- oder HPLC-MS-Verfahren überprüft werden.
Verwendung
Verwendung in Lebens- und Genussmitteln
Isoliertes natürliches oder synthetisches Coffein wird wegen seiner anregenden Wirkung manchen Erfrischungsgetränken (Cola-Getränke), Energy-Drinks und Süßwaren zugesetzt.
Adjuvante Schmerztherapie
Coffein erhöht die analgetische Wirkstärke von Acetylsalicylsäure oder Paracetamol um den Faktor 1,3 bis 1,7. Dies wird von der Pharmaindustrie gezielt ausgenutzt. Derzeit existieren auf dem deutschen Markt[63] elf Kombinationsanalgetika mit Coffein. Acht davon enthalten gleich zwei verschiedene Analgetika, nämlich Acetylsalicylsäure 250 mg, Paracetamol 200-250 mg plus Coffein 50 mg. „Koffein wirkt stimulierend und kann 'Entzugskopfschmerz' und dadurch Analgetika-Dauergebrauch auslösen bzw. verstärken, wenn die Analgetika zur Linderung des Entzugskopfschmerzes eingenommen werden.“[64] Außerdem steigt das Risiko der Analgetikanephropathie bei zwei verschiedenen Analgetika-Inhaltsstoffen. „Aus Gründen des vorbeugenden Gesundheitsschutzes halten wir ein Verbot […] [dieser] Mischanalgetika für angebracht.“[65]
Behandlung von Atemstillständen des Neugeborenen
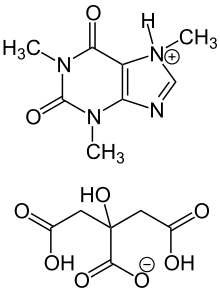
Coffeincitrat wird unter dem Handelsnamen Peyona zur Behandlung der primären Apnoe (Atemstillstand ohne offensichtliche Ursache) bei Frühgeborenen angewendet.[66] Apnoe bei Frühgeborenen bezeichnet ein Aussetzen der Atmung über mehr als 20 Sekunden. Da es nur wenige Patienten mit primärer Apnoe gibt – 32.000 Betroffene in der EU – gilt die Krankheit als selten und Coffeincitrat wurde am 17. Februar 2003 in dieser Indikation als Arzneimittel für seltene Leiden („Orphan-Arzneimittel“) ausgewiesen. Coffeincitrat wird als Infusionslösung (20 mg/ml) verabreicht. Die Lösung kann auch eingenommen werden und ist auf ärztliche Verschreibung erhältlich.[67]
Weitere Anwendungsgebiete
Coffein ist in Dosen von 50 bis 200 mg zur kurzfristigen Beseitigung von Ermüdungserscheinungen angezeigt.
Coffein-Natriumsalicylat, ein Salz des Coffeins, das im menschlichen Körper besser resorbiert wird als Coffein, wurde früher als Kreislauf- und Atemstimulans und Diuretikum verwendet. Heute ist diese Anwendung obsolet.
Seit April 2014 hat Coffeincitrat zur Vorbeugung gegen die bronchopulmonale Dysplasie den Status eines Orphan-Arzneimittels.[68]
Kosmetische Verwendung
Coffein soll den Haarwuchs fördern, wie an der Friedrich-Schiller-Universität Jena entdeckt wurde,[69] was eine Verwendung bei Haarausfall denkbar macht. Die heute auf dem Markt erhältlichen Coffein-Shampoos und Tinkturen stehen allerdings im Ruf, voreilige und wissenschaftlich nicht gerechtfertigte Versprechungen zu ihrer Wirksamkeit abzugeben.[70]
Coffeinhaltige Hautcremes werden zur Hautstraffung und -glättung, z. B. bei Cellulite, beworben.
Gehalte in Lebens- und Genussmitteln sowie Medikamenten

Produkte mit natürlichem Coffeingehalt:
- Eine Tasse Kaffee (150 ml aus 4 g Kaffeebohnen) enthält etwa 40–120 mg.[14]
- Eine Tasse Espresso (30 ml) etwa 40 mg Coffein.
- Eine Tasse Schwarztee und Grüntee kann je nach Zubereitungsart bis zu 50 mg enthalten, im Normalfall enthält eine Tasse Tee aus 1 g Teeblättern 20–40 mg.[14] In 100 g trockenen Teeblättern ist mehr Coffein enthalten als in der gleichen Menge gerösteter Kaffeebohnen.

- Guaraná enthält 40–90 mg Coffein pro 1 g in der Trockenmasse.
- Kakao enthält mit ungefähr 6 mg pro Tasse ein wenig Coffein, aber hauptsächlich Theobromin.
- In Schokolade findet sich Coffein (Vollmilchschokolade etwa 15 mg/100 g, Bitterschokolade mit 70 % Kakaoanteil etwa 70 mg[71] bis zu 90 mg/100 g bei noch höherem Kakaogehalt) neben Theobromin und anderen anregenden Substanzen.
Den folgenden Produkten wird üblicherweise synthetisch erzeugtes Coffein beigemischt. Teilweise wird aber auch natürliches Coffein, gewonnen bei der Kaffee-Entkoffeinierung, verwendet. Besonders sogenannten Wellness-Produkten wird häufig natürliches Coffein als Guaraná-Extrakt zugesetzt.
- Energy-Drinks wie Red Bull (etwa 32 mg/100 ml), Lipovitan (etwa 50 mg/100 ml), Powersirup (etwa 68 mg/100 ml) oder Relentless Energy Shot (160 mg/100 ml)
- Mate-Limonaden (etwa 20–25 mg/100 ml)
- Cola-Getränke (früher mit Coffein aus der Kolanuss) Coca-Cola und Pepsi Cola: 10 mg/100 ml, Afri-Cola, fritz-kola u. ä.: 25 mg/100 ml
- Kaffee-Bonbons (etwa 80–500 mg Coffein pro 100 g, etwa 3,3–8 mg Coffein pro Bonbon)
- Coffeinhaltige Schmerzmittel mit Acetylsalicylsäure oder Paracetamol oder beiden enthalten jeweils 50 mg Coffein pro Einzeldosis
- Coffeintabletten zur kurzfristigen Beseitigung von Ermüdungserscheinungen enthalten 50–200 mg Coffein
- Scho-Ka-Kola enthält 200 mg/100 g Coffein aus Kakao, Kaffee und Kolanuss-Extrakt
Im Jahre 1997 erklärten Wissenschaftler in einem Appell an die Food and Drug Administration, es sei bedeutend, die Deklaration des Coffein-Gehalts in Lebensmitteln zur Pflicht zu machen.[72] Gemäß der Lebensmittel-Informationsverordnung müssen in der EU Getränke, die einen Coffeingehalt von mehr als 150 Milligramm pro Liter aufweisen, mit dem Hinweis „Erhöhter Koffeingehalt. Für Kinder und schwangere oder stillende Frauen nicht empfohlen“ gekennzeichnet werden. Zusätzlich dazu muss der Coffeingehalt in Milligramm pro 100 Milliliter angegeben werden. Davon ausgenommen sind Tee, Kaffee und darauf basierende Getränke, wenn sie „Tee“ oder „Kaffee“ im Namen tragen (zum Beispiel Eistee).[73][74] Erfrischungsgetränke dürfen in Deutschland maximal 320 Milligramm Coffein pro Liter enthalten.[74]
Literatur
- Oskar Eichler: Kaffee und Coffein. Springer Verlag, Berlin / Heidelberg / New York 1976, ISBN 3-540-07281-0.
- P. B. Dews (Hrsg.): Caffeine: Perspectives from Recent Research. Springer Verlag, Berlin / Heidelberg / New York / Tokyo 1984, ISBN 3-540-13532-4.
- Wolfgang Forth, Olaf Adam: Coffein: Umgang mit einem Genussmittel, das auch pharmakologische Wirkungen entfalten kann. In: Deutsches Ärzteblatt. Band 98, Nr. 43. Deutscher Ärzte-Verlag, 26. Oktober 2001, S. A-2816 / B-2412 / C-2242 (aerzteblatt.de).
- Y. O. Taiwo, J. D. Levine: Direct cutaneous hyperalgesia induced by adenosine. In: Neuroscience. Band 38, 1990, S. 757, doi:10.1016/0306-4522(90)90068-F.
- Wolf-Dieter Müller-Jahncke: Koffein. In: Werner E. Gerabek, Bernhard D. Haage, Gundolf Keil, Wolfgang Wegner (Hrsg.): Enzyklopädie Medizingeschichte. de Gruyter, Berlin / New York 2005, ISBN 3-11-015714-4, S. 772.
- Bertil B. Fredholm: Methylxanthines. Springer Science & Business Media, 2010, ISBN 978-3-642-13443-2, S. 151 (eingeschränkte Vorschau in der Google-Buchsuche).
- Bennett Alan Weinberg, Bonnie K. Bealer: The world of caffeine. The science and culture of the world’s most popular drug. Routledge, New York / London 2001, ISBN 0-415-92722-6.
Weblinks
Einzelnachweise
- Eintrag zu CAFFEINE in der CosIng-Datenbank der EU-Kommission, abgerufen am 28. Dezember 2019.
- Eintrag zu Coffein in der GESTIS-Stoffdatenbank des IFA, abgerufen am 22. Februar 2017. (JavaScript erforderlich)
- H. Bothe, H. K. Cammenga: Phase transitions and thermodynamic properties of anhydrous caffeine. In: Journal of Thermal Analysis. 16, 1979, S. 267, doi:10.1007/BF01910688.
- Eintrag zu Coffein. In: Römpp Online. Georg Thieme Verlag, abgerufen am 19. Februar 2012.
- Datenblatt Coffein (PDF) bei Merck, abgerufen am 2. November 2021.
- Eintrag zu Caffeine im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Journal of New Drugs. Vol. 5, 1965, S. 252.
- Eintrag zu Caffeine in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- Toxicology and Applied Pharmacology. Vol. 44, 1978, S. 1.
- A. S. Brem, H. Martin, L. Stern: Toxicity from tea ingestion in an infant: a computer simulation analysis. In: Clinical Biochemistry. Band 10, Nummer 4, August 1977, S. 148–150. PMID 908129.
- Annals of Emergency Medicine. Vol. 18, 1989, S. 94.
- Philip W. Shaul, Michael K. Farrell, Michael J. Maloney: Caffeine toxicity as a cause of acute psychosis in anorexia nervosa. In: The Journal of Pediatrics. 105, 1984, S. 493, doi:10.1016/S0022-3476(84)80037-2.
- S. Shum, C. Seale, D. Hathaway, V. Chucovich, D. Beard: Acute caffeine ingestion fatalities: management issues. In: Veterinary and Human Toxicology. Band 39, Nummer 4, August 1997, S. 228–230. PMID 9251173 (Review).
- Werner Baltes: Lebensmittelchemie. 6. Auflage. Springer, 2007, ISBN 978-3-540-38181-5, S. 400.
- Wolf-Dieter Müller-Jahncke: Koffein. 2005, S. 772.
- Eintrag zu Tee. In: Römpp Online. Georg Thieme Verlag, abgerufen am 1. Dezember 2011.
- Werner Baltes: Lebensmittelchemie. 6. Auflage. Springer, 2007, ISBN 978-3-540-38181-5, S. 402.
- P. M. Frischknecht, Jindra Ulmer-Dufek, Thomas W. Baumann: Purine formation in buds and developing leaflets of Coffea arabica: expression of an optimal defence strategy? In: Phytochemistry. Band 25, Nr. 3. Journal of the Phytochemical Society of Europe and the Phytochemical Society of North America, 1986, S. 613–616, doi:10.1016/0031-9422(86)88009-8.
- M. Epple, H. K. Cammenga, S. M. Sarge, R. Diedrich, V. Balek: The phase transformation of caffeine: Investigation by dynamic X-ray diffraction and emanation thermal analysis. In: Thermochimica Acta. 250, 1995, S. 29, doi:10.1016/0040-6031(94)01958-J.
- Eintrag zu Caffeine. In: The Merck Index Online. Royal Society of Chemistry, 2013, abgerufen am 31. Juli 2020.
- H. Bothe, H. K. Cammenga: Composition, properties, stability and thermal dehydration of crystalline caffeine hydrate. In: Thermochimica Acta. Band 40, 1980, S. 29, doi:10.1016/0040-6031(80)87173-5.
- Sean Sweetman (Hrsg.): Martindale: The Complete Drug Reference. 35. Auflage. Buch und CD-ROM. Deutscher Apotheker Verlag, 2006, ISBN 3-7692-4184-3.
- Robert Gable: Drug Toxicity. Abgerufen am 17. Februar 2011.
- R. S. Gable: Acute toxicity of drugs versus regulatory status. In: J. M. Fish (Hrsg.): Drugs and Society: U.S. Public Policy. Rowman & Littlefield Publishers, Lanham, MD 2006, S. 149–162.
- E. Mutschler, G. Geisslinger, H. K. Kroemer, P. Ruth, M. Schäfer-Korting: Arzneimittelwirkungen. Lehrbuch der Pharmakologie und Toxikologie. 9. Auflage. Wissenschaftliche Verlagsgesellschaft, Stuttgart 2008, ISBN 978-3-8047-1952-1, S. 192.
- Eintrag zu Coffein bei Vetpharm, abgerufen am 23. Juni 2012.
- Robert M. Julien: Drogen und Psychopharmaka. Spektrum, Akad. Verlag, Heidelberg/ Berlin/ Oxford 1997, S. 173.
- Wissenschaft-Online-Lexika: Eintrag zu Coffein im Lexikon der Ernährung. Abgerufen am 17. Oktober 2009.
- R. Dixon, S. Hwang, F. Britton, K. Sanders, S. Ward: Inhibitory effect of caffeine on pacemaker activity in the oviduct is mediated by cAMP-regulated conductances. In: Br J Pharmacol. Band 163, Nr. 4, 2011, S. 745–754, PMID 21615388.
- F. Bolúmar, J. Olsen, M. Rebagliato, L. Bisanti: Caffeine intake and delayed conception: a European multicenter study on infertility and subfecundity. European Study Group on Infertility Subfecundity. In: American Journal of Epidemiology, Band 145, Nummer 4, Februar 1997, S. 324–334. PMID 9054236.
- Coffein: Umgang mit einem Genussmittel, das auch pharmakologische Wirkungen entfalten kann. In: Deutsches Ärzteblatt. 26. Oktober 2001, abgerufen am 11. April 2021.
- Daniel Borota, Elizabeth Murray, Gizem Keceli, Allen Chang, Joseph M Watabe, Maria Ly, John P Toscano, Michael A Yassa: Post-study caffeine administration enhances memory consolidation in humans. In: Nature Neuroscience. Band 17, 2014, S. 201, doi:10.1038/nn.3623.
- Eintrag zu alkoholfreie Erfrischungsgetränke. In: Römpp Online. Georg Thieme Verlag, abgerufen am 20. Juli 2012.
- Stiftung Warentest: Koffeingehalt in Lebensmitteln. test.de, 6. August 2003; abgerufen am 1. Februar 2013.
- Eintrag zu Kaffeegetränk. In: Römpp Online. Georg Thieme Verlag, abgerufen am 20. Juli 2012.
- W. Pasman, M. van Baak, A. Jeukendrup, A. de Haan: The Effect of Different Dosages of Caffeine on Endurance Performance Time. In: International Journal of Sports Medicine. Band 16, 1995, S. 225, doi:10.1055/s-2007-972996.
- Anti-Doping und Medikation im Pferdesport. Deutsche Reiterliche Vereinigung, Stand: 22. Juli 2020, abgerufen am 28. April 2021.
- Robert M. Julien: Drogen und Psychopharmaka. Titel der Originalausgabe A primer of drug action – a concise and nontechnical guide to the actions, uses, and side effects of psychoactive drugs. Urban & Fischer Verlag, 2002, ISBN 3-437-21706-2.
- Mit Angaben zu weiteren Getränken: Neuseeland: Tod nach exzessivem Cola-Konsum. In: Spiegel Online. 13. Februar 2013; abgerufen am 13. Februar 2013.
- Y. O. Taiwo, J. D. Levine: Direct cutaneous hyperalgesia induced by adenosine. In: Neuroscience. Band 38, 1990, S. 757, doi:10.1016/0306-4522(90)90068-F.
- Peter C. Heinrich, Georg Löffler: Biochemie und Pathobiochemie. 9., vollständig überarbeitete Auflage. Springer, Heidelberg 2014, ISBN 978-3-642-17971-6, S. 470–471.
- John L. Tymoczko, Gregory J. Gatto Jr., Lubert Stryer, Andreas Held, Manuela Held: Stryer Biochemie. 8. Auflage. Berlin 2018, ISBN 978-3-662-54619-2, S. 476.
- J. D. Lane, C. E. Barkauskas, R. S. Surwit, M. N. Feinglos: Caffeine Impairs Glucose Metabolism in Type 2 Diabetes. In: Diabetes Care. Band 27, 2004, S. 2047, doi:10.2337/diacare.27.8.2047.
- Cornelia Pfaff: Kaffee schadet Diabetikern. In: welt.de. 29. Januar 2008, abgerufen am 13. April 2015.
- Peter J. Rogers, Christa Hohoff, Susan V. Heatherley, Emma L. Mullings, Peter J. Maxfield, Richard P. Evershed, Jürgen Deckert, David J. Nutt: Association of the anxiogenic and alerting effects of caffeine with ADORA2A and ADORA1 polymorphisms and habitual level of caffeine consumption. In: Neuropsychopharmacology: Official Publication of the American College of Neuropsychopharmacology. Band 35, Nr. 9, 2010, ISSN 1740-634X, S. 1973–1983, doi:10.1038/npp.2010.71, PMID 20520601.
- Suzette M. Evans, Roland R. Griffiths: Caffeine tolerance and choice in humans. In: Psychopharmacology. Band 108, Nr. 1, 1992, ISSN 1432-2072, S. 51–59, doi:10.1007/BF02245285.
- L. M. Juliano, R. R. Griffiths: A critical review of caffeine withdrawal: empirical validation of symptoms and signs, incidence, severity, and associated features. In: Psychopharmacology. (Berlin). Band 176, Nr. 1, Oktober 2004, S. 1–29. PMID 15448977.
- Your brain on – and off – caffeine. Study of withdrawal shows effects of regular caffeine use. (online) über eine Studie von Stacey Sigmon, Roland Griffiths, Ronald Herning, Warren Better and Jean Cadet 2009.
- Brockhaus ABC Chemie. VEB F.A. Brockhausverlag, Leipzig 1971.
- EFSA NDA Panel (EFSA Panel on Dietetic Products, Nutrition and Allergies): Scientific Opinion on the safety of caffeine. In: EFSA Journal. Band 13, Nr. 5, 2015, S. 4102.
- Neuropsychiatric effects of caffeine. In: Advances in Psychiatric Treatment. Band 11, Nr. 6, 2005, S. 432–439, doi:10.1192/apt.11.6.432.
- Caffeine challenge test and panic disorder: a systematic literature review. In: Expert Review of Neurotherapeutics. Band 11, Nr. 8, August 2011, S. 1185–1195, doi:10.1586/ern.11.83, PMID 21797659 (semanticscholar.org).
- Effects of caffeine on human behavior. In: Food and Chemical Toxicology. Band 40, Nr. 9, September 2002, S. 1243–1255, doi:10.1016/S0278-6915(02)00096-0, PMID 12204388.
- Caffeine abstention in the management of anxiety disorders. In: Psychological Medicine. Band 19, Nr. 1, Februar 1989, S. 211–114, doi:10.1017/S003329170001117X, PMID 2727208.
- Christopher C. Wendler, Melissa Busovsky-McNeal, Satish Ghatpande, April Kalinowski, Kerry S. Russell, Scott A. Rivkees: Embryonic caffeine exposure induces adverse effects in adulthood. In: The FASEB Journal. Vol. 23, No. 4, 16. Dezember 2008, S. 1272–1278, doi:10.1096/fj.08-124941.
- Christine Amrhein: Forscher raten: Kein Koffein in der Schwangerschaft In: Bild der Wissenschaft. 18. Dezember 2008.
- Schwangerschaft: Ein bis zwei Tassen Kaffee sind erlaubt. In: Spiegel Online. 6. Juni 2012, abgerufen am 2. Juni 2015.
- Iná S. Santos, Alicia Matijasevich, Marlos R. Domingues: Maternal Caffeine Consumption and Infant Nighttime Waking: Prospective Cohort Study. In: Pediatrics. 2. April 2012, doi:10.1542/peds.2011-1773.
- Y. Du, H. U. Melchert, H. Knopf, M. Braemer-Hauth, B. Gerding, E. Pabel: Association of serum caffeine concentrations with blood lipids in caffeine-drug users and nonusers – results of German National Health Surveys from 1984 to 1999. In: European Journal of Epidemiology. Band 20, Nummer 4, 2005, S. 311–316. PMID 15971502.
- Y. Du, H. U. Melchert, H. Knopf, M. Braemer-Hauth, E. Pabel: Association of serum caffeine concentrations with serum glucose levels in caffeine-drug users and non-users – results of German National Health Surveys. In: Diabetes Obes Metab. Band 9, 2007, S. 756–758. PMID 17697066.
- C. Viana, G. M. Zemolin, T. R. Dal Molin, L. Gobo, S. M. Ribeiro, G. C. Leal, G. Z. Marcon, L. M. de Carvalho: Detection and determination of undeclared synthetic caffeine in weight loss formulations using HPLC-DAD and UHPLC-MS/MS. In: J Pharm Anal. Band 8, Nr. 6, Dez 2018, S. 366–372. PMID 30595942
- Y. Du, H. U. Melchert, H. Knopf, M. Braemer-Hauth: Association of serum caffeine concentrations with blood lipids in caffeine-drug users and nonusers - results of German National Health Surveys from 1984 to 1999. In: Eur J Epidemiol. Band 20, Nr. 4, 2005, S. 311–316. PMID 15971502
- Rote Liste. Fachinfo-Service; abgerufen am 21.10.20; nicht allgemein verfügbar.
- Arzneimittelkursbuch 2007/2008, transparenztelegramm. A.V.I. Arzneimittel-Verlag, Berlin 2007, Abschnitt „Schmerzen“, S. 1638–2.
- Arzneimittelkursbuch 2007/2008, S. 1638–1.
- A. M. Comer, C. M. Perry, D. P. Figgitt: Caffeine citrate: a review of its use in apnoea of prematurity. In: Paediatr Drugs. Band 3, Nr. 1, 2001, S. 61–79. PMID 11220405.
- EU-Kommission: Nymusa-Koffeincitrat: Zusammenfassung der Merkmale des Arzneimittels. (PDF) Stand: 2. Juli 2009 (PDF; 18 kB).
- Public Health – European Commission. In: Union Register of medicinal products. Abgerufen am 5. Oktober 2021.
- T. W. Fischer, U. C. Hipler, P. Elsner: Effect of caffeine and testosterone on the proliferation of human hair follicles in vitro. In: International Journal of Dermatology. Band 46, 2007, S. 27–35. PMID 17214716.
- Test: Mittel gegen Haarausfall. Ökotest-Bericht.
- Stiftung Warentest: Dunkler Genuss, Warentest Bitterschokolade, Heft 12/2007, S. 18. (PDF; 815 kB)
- Schreiben des Centers for Science in the Public Interest. (Memento vom 13. Mai 2016 im Internet Archive) 1997.
- Verordnung (EU) Nr. 1169/2011 des Europäischen Parlaments und des Rates vom 25. Oktober 2011 betreffend die Information der Verbraucher über Lebensmittel und zur Änderung der Verordnungen (EG) Nr. 1924/2006 und (EG) Nr. 1925/2006 des Europäischen Parlaments und des Rates und zur Aufhebung der Richtlinie 87/250/EWG der Kommission, der Richtlinie 90/496/EWG des Rates, der Richtlinie 1999/10/EG der Kommission, der Richtlinie 2000/13/EG des Europäischen Parlaments und des Rates, der Richtlinien 2002/67/EG und 2008/5/EG der Kommission und der Verordnung (EG) Nr. 608/2004 der Kommission, zuletzt geändert durch Verordnung (EU) 2015/2283 des Europäischen Parlaments und des Rates vom 25. November 2015, zuletzt berichtigt durch ABl. L 266 vom 30. September 2016.
- Höchstmenge für Koffein. 20. Juni 2016, abgerufen am 12. Juni 2020.

