Versauerung der Meere
Als Versauerung der Meere wird die Abnahme des pH-Wertes des Meerwassers bezeichnet. Verursacht wird sie durch die Aufnahme von Kohlenstoffdioxid (CO2) aus der Erdatmosphäre.[1][2] Der Vorgang zählt neben der globalen Erwärmung zu den Hauptfolgen der menschlichen Emissionen von Kohlenstoffdioxid. Während Kohlenstoffdioxid in der Erdatmosphäre physikalisch zu steigenden Temperaturen auf der Erde führt, wirkt es im Meerwasser chemisch, indem aus CO2 und Wasser Kohlensäure gebildet wird. Das Meerwasser ist leicht basisch. Durch die „Versauerung“ wird es nicht sauer, sondern weniger basisch.
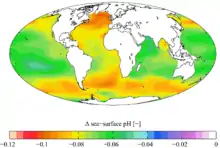
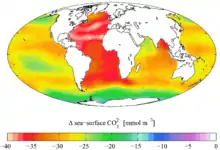
Die Folgen dieser sog. „Versauerung“ betreffen zunächst kalkskelettbildende Lebewesen, deren Fähigkeit, Exo- bzw. Endoskelette zu bilden, bei sinkendem pH-Wert nachlässt. Weil diese Arten oft die Basis der Nahrungsketten in den Ozeanen bilden, können sich daraus weitere schwerwiegende Konsequenzen für die zahlreichen von ihnen abhängigen Meeresbewohner und in der Folge auch für die auf diese Tiere angewiesenen Menschen ergeben.
pH-Wert des Ozeans
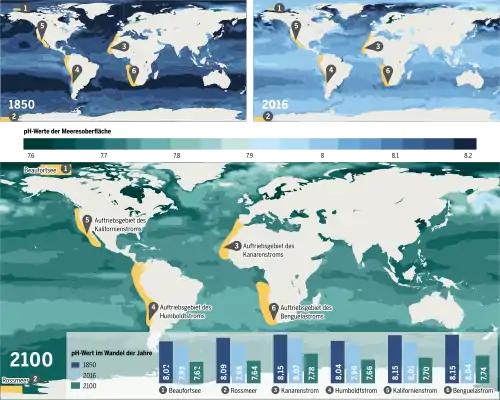
Quelle: Meeresatlas 2017 – Daten und Fakten über unseren Umgang mit dem Ozean[3]
Der pH-Wert ist für ideal verdünnte Lösungen definiert und daher auf das salzhaltige Meereswasser nicht direkt anwendbar. Um Durchschnittswerte für Meereswasser angeben zu können, müssen darüber hinaus Modelle angewendet werden, um ein chemisches Gleichgewicht des Ozeans zu simulieren. Hierzu werden derzeit drei verschiedene Modelle mit daraus folgenden Skalen angewendet, die um bis zu 0,12 Einheiten auseinander liegen. Durchschnittswerte können daher nur im Rahmen des zugrundeliegenden Modells verglichen werden.[4][5]
Das Meerwasser ist mit einem pH-Wert um 8 leicht basisch. Nach einer Zusammenfassung der britischen Royal Society weist das Oberflächenwasser der Meere heute bis in eine Tiefe von 50 m typischerweise pH-Werte zwischen 7,9 und 8,25 auf, mit einem Durchschnittswert von 8,08.[1] Die wichtigsten Ursachen für die Schwankungen innerhalb dieses Bereichs sind die Temperatur des Wassers, der lokale Auftrieb von kohlenstoffdioxidreichem Tiefenwasser, sowie die biologische Produktivität, die dort, wo sie hoch ist, in Form von Meereslebewesen viel Kohlenstoffdioxid bindet und in tiefere Wasserschichten transportiert.
Eine Möglichkeit, frühere pH-Werte zu rekonstruieren, bietet die Analyse von Sedimenten. Aus der isotopischen Zusammensetzung von Borhydroxiden lässt sich bestimmen, dass der pH-Wert an der Meeresoberfläche vor etwa 21 Millionen Jahren etwa 7,4 ± 0,2 betrug, bis er vor ungefähr 7,5 Millionen Jahren auf den Wert von 8,2 ± 0,2 stieg.[6] Da der pH-Wert der Meere über den Henry-Koeffizienten direkt mit der Kohlenstoffdioxidkonzentration der Atmosphäre gekoppelt ist, lassen sich so auch Paläo-CO2-Konzentrationen bestimmen. Bis zum Beginn der ozeanischen Versauerung infolge der einsetzenden Industrialisierung im 18. Jahrhundert und des steigenden Kohlenstoffdioxidausstoßes blieb dieser Wert in etwa konstant.
Infolge des menschlichen Kohlenstoffdioxidausstoßes, der zu etwa einem Viertel von den Weltmeeren aufgenommen wird, stieg der Säuregrad der Ozeane seit Beginn der Industrialisierung um knapp 30 % an (Stand 2016). Ohne Reduzierung der gegenwärtigen CO2-Emissionen würde sich der Säuregehalt der Weltmeere bis 2100 mehr als verdoppeln.[7] Die Versauerung verläuft nach dem Fünften Sachstandsbericht des IPCC schneller als alle ähnlichen Versauerungen der vergangenen 65 Mio. Jahre, eventuell der vergangenen 300 Mio. Jahre.[8] Einer 2005 erschienenen Studie der Stanford University zufolge, die einen vorindustriellen pH-Wert des oberflächennahen Meerwassers von durchschnittlich 8,25 annimmt, verringerte sich der pH-Wert durch die Aufnahme von Kohlenstoffdioxid auf den damaligen Wert von durchschnittlich 8,14.[9] Eine gemeinsame Übersicht aus den USA von der National Science Foundation (NSF), der National Oceanic and Atmospheric Administration (NOAA) und dem United States Geological Survey (USGS) kommt zu dem Schluss, dass vor der Industrialisierung der durchschnittliche pH-Wert bei 8,16 lag, während er heute 8,05 beträgt.[10] In beiden Fällen wird die Versauerung auf die menschlichen Emissionen von Kohlenstoffdioxid zurückgeführt und mit 0,11 pH-Einheiten beziffert.
Eine Versauerung erfolgt auch in Küsten- oder Schiffsnähe durch Säureeinträge verursacht durch Schwefeloxide und Stickoxide (siehe Saurer Regen). Diese stammen vor allem aus der Nutzung fossiler Brennstoffe und aus der Landwirtschaft. Global tragen diese Einträge kaum zur Versauerung der Meere bei.[11]
Ozeane als Kohlenstoffsenke
Die Ozeane spielen im Kohlenstoffkreislauf der Erde als Kohlenstoffsenke eine wichtige Rolle, da 70 Prozent der Erdoberfläche von Wasser bedeckt sind. In der gesamten Hydrosphäre sind schätzungsweise 38.000 Gigatonnen (Gt) Kohlenstoff gespeichert. Das Kohlenstoffdioxid gelangt aufgrund der Differenz im CO2-Partialdruck in den Ozean. Ein Gas strömt immer vom Bereich des höheren Partialdrucks (Atmosphäre) in den Bereich des niedrigeren Drucks (Ozean). Kohlenstoffdioxid wird so lange im Meer gelöst, bis der Partialdruck in der Atmosphäre und im Meer gleich ist. Umgekehrt entweicht es auch wieder, wenn der Druck in der Atmosphäre geringer als im Meer ist. Die Temperatur eines Meeres beeinflusst ebenfalls die Aufnahme von Kohlenstoffdioxid, da Wasser bei steigender Temperatur weniger Kohlenstoffdioxid aufnehmen kann.
Der aus der Atmosphäre aufgenommene Kohlenstoff verteilt sich im Ozean innerhalb einiger weniger Jahre in der von der Sonne durchleuchteten Schicht des Meeres. Zwei Mechanismen sorgen dafür, dass es in noch größere Tiefen gelangt. Am wichtigsten ist die sogenannte physikalische Kohlenstoffpumpe: Kohlenstoffreiches Oberflächenwasser kühlt sich in der Arktis ab, wird schwerer und sinkt ab, dann wird das kohlenstoffreiche Wasser über die kalte Tiefenströmung des globalen Förderbandes weiträumig in den Tiefen der Ozeane verteilt. Weniger wichtig, aber dennoch nicht unbedeutend ist die sogenannte biologische Kohlenstoffpumpe, bei der Kohlenstoff als Meeresschnee (biogener Teilchenregen) in tiefere Regionen absinkt. Es dauert hunderte bis tausende von Jahren, bis das aus der Atmosphäre aufgenommene anthropogene CO2 von den Ozeanen in die tiefsten Wasserschichten vorgedrungen und verteilt ist. Heute ist es bis in eine Wassertiefe von durchschnittlich 1000 m nachweisbar.[2] Bei Seamounts, an den Kontinentalhängen und in Flachmeeren (zum Beispiel in Teilen des Weddell-Meeres)[12] kann das anthropogene CO2 bereits bis zum Meeresboden gelangen.
Die gestiegene Menge von Kohlenstoffdioxid in der Erdatmosphäre hat in den vergangenen 200 Jahren dazu geführt, dass 118 ± 19 Gt Kohlenstoff oder 27 % bis 34 % der anthropogenen CO2-Emissionen von den Ozeanen aufgenommen wurden.[13] Im Jahr 2006 gelangten weltweit 36,3 Gt von Menschen zusätzlich produziertes CO2 oder ca. 9,9 Gt Kohlenstoff in die Atmosphäre.[14] Inklusive der natürlichen Quellen nimmt die Hydrosphäre gegenwärtig ungefähr 92 Gt des atmosphärischen Kohlenstoffs pro Jahr auf. Etwa 90 Gt davon werden von den Weltmeeren wieder abgegeben und 2 ± 1 Gt werden gespeichert.[2] Eine im Jahr 2003 erschienene Studie schätzt die Aufnahme von Kohlenstoff etwas genauer im Zeitraum 1980–1989 auf 1,6 ± 0,4 Gt und zwischen 1990 und 1999 auf 2,0 ± 0,4 Gt pro Jahr.[15]
Chemischer Prozess der Versauerung
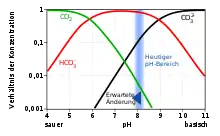
Kohlenstoffdioxid aus der Luft kann sich im Meerwasser lösen und liegt dann größtenteils in Form verschiedener anorganischer Verbindungen vor, deren relatives Verhältnis den pH-Wert der Ozeane reflektiert. Anorganischer Kohlenstoff findet sich im Ozean zu ca. 1 % in Kohlensäure und Kohlenstoffdioxid, zu ca. 91 % in Hydrogencarbonat-Ionen (HCO3−) und zu ca. 8 % in Carbonat-Ionen (CO32−). Im Wasser gelöstes Kohlenstoffdioxid steht über die folgenden Reaktionsgleichungen mit Hydrogencarbonat, Carbonat und Oxoniumionen (Hydroniumionen) im Gleichgewicht:
Die in diesem Prozess entstehenden Oxoniumionen (H3O+) bewirken den sinkenden pH-Wert, der als negativer dekadischer Logarithmus der Stoffmengenkonzentration (genauer: der Aktivität) von Oxoniumionen definiert ist.
Der Versauerung durch gelöstes CO2 wirkt die Anwesenheit von Calciumcarbonat (CaCO3) entgegen, das mit Hydrogencarbonat- und Carbonat-Ionen als chemisches Puffersystem (→ Pufferlösung) wirkt und so Protonen bindet:
Wie alle Carbonate der Erdalkalimetalle ist Calciumcarbonat in Wasser nur schwer löslich. Das Calciumcarbonat im Meerwasser stammt im Wesentlichen aus zwei Quellen, nämlich Sedimenten am Meeresboden und dem Eintrag durch Zufluss von Süßwasser. In Letzteres gelangt Carbonat durch Verwitterung kalkhaltiger Gesteine. Damit das Sediment zur Neutralisierung der Versauerung beitragen kann, muss das darin enthaltene Calciumcarbonat aufgelöst und durch Zirkulation vom Meeresboden in höhere Wasserschichten getragen werden. Wird in Modellrechnungen der verwitterungsbedingte Eintrag als konstant (mit 0,145 Gt pro Jahr Kohlenstoff in Form von Carbonat) angenommen, so würde die Versauerung der Meere innerhalb einiger hundert Jahre zu einer Umkehr der Sedimentbildungsrate führen. Erst in einem Zeitraum von ca. 8000 Jahren könnte der verwitterungsbedingte Eintrag von Calciumcarbonat diesen Effekt wieder ausgleichen.[16]
Bedeutende Mengen von Calciumcarbonat im Sediment entstehen durch Calcit-bildendes Plankton, besonders von Globigerinen (eine Gruppe der Foraminiferen), Coccolithophoriden (eine Gruppe der Kalkalgen) und Pteropoden. Kleinere Mengen werden beispielsweise in Korallenriffen gebildet. Plankton kann sich am Grunde des Meeres in Form eines carbonatreichen, biogenen Sediments (Kalkschlamm) ablagern, wenn die Wassertiefe nicht zu groß ist. Werden hingegen die Calcit- und Aragonit-Kompensationstiefen für die Calciumcarbonate Calcit und Aragonit überschritten, dann lösen sie sich vollständig auf. Diese Kompensationstiefen wandern im Zuge der Versauerung nach oben, und so gehen große Mengen von Kalkstein am Meeresgrund in Lösung. Für Aragonit konnte im Atlantik bereits ein Anstieg seit der Industrialisierung um 400 m auf heute 2500 m ermittelt werden. Bis 2050 wird eine weitergehende Erhöhung um dann 700 m erwartet.[17][18] 300 bis 800 m oberhalb der Calcit-Kompensationstiefe befindet sich die Lysokline, der Bereich, in dem der Auflösungsprozess beginnt. Auch in weniger tiefen Gebieten können folglich feste Carbonate wie in Calciumcarbonat zusätzlich gelöst werden, bis die Lösung wieder mit Carbonat-Ionen gesättigt ist. Die Reaktionsgleichung für die Kalklösung lautet:[19]
Folgen für Meereslebewesen und das Ökosystem Ozean
Bei marinen Lebewesen, die dem Meerwasser mit erhöhtem CO2-Gehalt ausgesetzt sind, spielt sich ein Prozess ab, der der Lösung von CO2 im Ozean sehr ähnlich ist. CO2 kann als Gas ungehindert durch Zellmembranen wandern und verändert so den pH-Wert der Körperzellen und des Blutes bzw. der Hämolymphe. Die Veränderung des natürlichen Säure-Base-Haushalts muss vom Organismus kompensiert werden, was manchen Tierarten besser und anderen schlechter gelingt. Eine dauerhafte Verschiebung der Säure-Base-Parameter innerhalb eines Organismus kann das Wachstum oder die Fortpflanzungsfähigkeit beeinträchtigen und so im schlimmsten Fall das Überleben einer Art gefährden.[20] In der erdgeschichtlichen Vergangenheit führten Versauerungsereignisse, die weniger stark ausgeprägt waren als die heutige menschengemachte Versauerung, mehrfach zu schweren Rückgängen der biologischen Vielfalt bzw. Massenaussterben.[21]
Schäden an Korallen

Die Lösung von Kohlenstoffdioxid bremst zwar die Erderwärmung, die daraus folgende langsame Versauerung der Ozeane kann aber schwerwiegende Folgen unter anderem für Tiere mit einem Schutzmantel aus Calciumcarbonat (Kalk) nach sich ziehen.[22][10][19] Wie oben beschrieben, verschiebt sich das chemische Gleichgewicht der Ozeane zu Lasten der Carbonat-Ionen. Deren Verbindung mit Calcium im Meerwasser zu Calciumcarbonat ist jedoch von vitaler Bedeutung für Kalkschalen bildende Meereslebewesen. Ein saurer werdender Ozean behindert die Biomineralisation von Korallen sowie von Kleinstlebewesen wie winzigen Meeresschnecken und Zooplankton, obwohl einige dieser Lebewesen den pH-Wert des Wassers gezielt erhöhen, indem sie die gelöste Menge an Kohlenstoffdioxid bei der Erzeugung der Kalkkristalle in den eigenen Zellen verringern.[23]
Korallen produzieren mit Aragonit die neben Calcit am häufigsten vorkommende Kalkform im Meer. Aragonit ist eine besonders leicht durch Kohlensäure lösbare Form von Kalk, was das Risiko für die Korallen durch saurer werdende Ozeane erhöht.[24] Bei einem Experiment an der israelischen Bar-Ilan-Universität wurden Korallen künstlich angesäuertem Wasser mit einem pH-Wert von 7,3 bis 7,6 ausgesetzt. Dies sind Werte, die von einigen Wissenschaftlern als in wenigen Jahrhunderten möglich angesehen werden, vorausgesetzt, dass sich der atmosphärische Gehalt von CO2 etwa verfünffacht.[25] Nach einem Monat in dem saureren Wasser begannen sich die Kalkschalen von den Korallen abzulösen, und in der Folge verschwanden sie vollständig. Überraschend für die Forscher war, dass die Polypen der Korallen überlebten. Als nach 12 Monaten der pH-Wert wieder auf 8,0–8,3 angehoben wurde, begannen die Polypen erneut mit der Kalkbildung. Dieses Ergebnis könnte erklären, warum die Korallen trotz früherer Epochen mit einem für sie ungünstigeren pH-Wert des Meerwassers überleben konnten. Trotz dieses Befundes sprechen die Forscher lediglich von einem möglichen „Refugium“ der Korallen und betonen die schwerwiegenden Folgen der Entkalkung auf die betroffenen Ökosysteme.[26] Ein negativer Effekt der Versauerung auf das Wachstum wurde auch für Steinkorallen der Gattung Lophelia pertusa nachgewiesen, die in der freien Natur in Tiefen von 60 m bis 2100 m vorkommen. In einem Experiment verringerte sich die Kalzifizierungsrate dieser Kaltwasserkorallen bei einem um 0,15 und 0,3 Einheiten reduzierten pH-Wert um 30 % beziehungsweise 56 %.[27]
Auch weitere für die Riffbildung bedeutende Lebewesen dürften unter der Versauerung leiden. In einem siebenwöchigen Experiment wurden Rotalgen aus der Familie der Corallinaceae, die eine wichtige Rolle beim Aufbau von Korallenriffen spielen, künstlich angesäuertem Meerwasser ausgesetzt. Gegenüber der Vergleichsgruppe sank bei den Algen im saureren Wasser die Reproduktionsrate und das Wachstum stark. Unter den Bedingungen eines weiter sinkenden pH-Wertes in den Ozeanen bedeutet dies wahrscheinlich erhebliche Folgen für betroffene Korallenriffe.[28]
Weitere Meereslebewesen

Die Zwischenstaatliche Sachverständigengruppe über Klimaänderungen (Intergovernmental Panel on Climate Change, IPCC) gibt 2007 im Vierten Sachstandsbericht eine wissenschaftliche „mittlere Sicherheit“ für negative Konsequenzen aus den saurer werdenden Weltmeeren für Kalkschalen bildende Organismen und von ihnen abhängige Spezies an.[30] In einer an der Kyoto University durchgeführten Untersuchung wuchsen Seeigel in künstlich angesäuertem Wasser deutlich langsamer, im Vergleich zu einer unter normalen Bedingungen gehaltenen Kontrollgruppe, oder verloren an Gewicht. Sie waren weniger fruchtbar und ihre Embryonen nahmen deutlich langsamer an Größe und Gewicht zu.[31] Bei Seeigeln der Art Heliocidaris erythrogramma, die in den Gewässern Südaustraliens heimisch sind, führte ein experimentell um 0,4 Einheiten auf 7,7 gesenkter pH-Wert zu einer vermutlich reduzierten Fortpflanzungsfähigkeit, festgestellt an der deutlich verminderten Geschwindigkeit und Beweglichkeit der Spermien. Dies könnte die Zahl von Nachkommen um ein Viertel senken.[32]
Die Kalzifizierungsrate von Miesmuscheln könnte bis Ende des 21. Jahrhunderts um 25 % und die der Pazifischen Felsenauster um 10 % abnehmen. Auf diese Werte kamen Wissenschaftler, indem sie einem bestimmten Szenario des IPCC folgten, das bis 2100 eine atmosphärische CO2-Konzentration von ca. 740 ppm vorsieht. Oberhalb eines Grenzwertes von 1.800 ppm beginnt sich die Muschelschale sogar aufzulösen, wodurch die Artenvielfalt an Küsten allgemein gefährdet ist und auch erhebliche wirtschaftliche Schäden drohen.[33]

Die ozeanische Nahrungskette basiert auf Plankton. Besonders Kalkalgen (so genannten Haptophyta) sind auf die Bildung einer Kalkschale angewiesen, um zu überleben. Wenn dies durch die Versauerung nicht mehr möglich ist, wären damit möglicherweise weitreichende Konsequenzen für die Nahrungskette der Ozeane verbunden.[34] Eine 2004 erschienene Studie des ehemaligen Leibniz-Institut für Meereswissenschaften weist auf die zahlreichen komplexen Effekte hin, die ein niedrigerer pH-Wert auf Plankton haben kann, darunter auf die schlechtere Ausgangslage für kalkbildende tierische Organismen verglichen mit Phytoplankton (Schwebalgen). Zugleich wird der unsichere Forschungsstand betont, der momentan keine weitreichenden Vorhersagen über die Entwicklung ganzer Ökosysteme zulässt.[35] Eine abnehmende Kalzifierungsrate konnte bei Foraminiferen der Ordnung Globigerinida im südlichen Ozean festgestellt werden. Die einzelligen Foraminiferen sind für ein Viertel bis die Hälfte des gesamten ozeanischen Kohlenstoffflusses verantwortlich. In den Untersuchungen wurde für die Foraminifere Globigerina bulloides ein um 30 bis 35 % verringertes Gewicht der Kalkschale im Vergleich zu abgestorbenen, aus Sedimenten geborgenen Exemplaren festgestellt. Die Folgen eines weiter abnehmenden pH-Wertes gelten als ungewiss.[36]
Nicht für alle Meereslebewesen bedeutet die Versauerung eine Einschränkung ihres Lebensraumes. Zunächst führt die gestiegene Menge von Kohlenstoffdioxid im Meer unter anderem zu einer besseren Kohlenstoffdioxid-Düngung der Meerespflanzen. Da der Effekt sich bei verschiedenen Pflanzen unterschiedlich auswirkt und mit der steigenden Wassertemperatur sowie dem abnehmenden pH-Wert verbunden ist, kann sich wiederum die Artenzusammensetzung ändern.[2] Bei einigen Spezies wurden überraschende Reaktionen auf die abnehmende Alkalität der Meere festgestellt. Für die Kalkalgenart Emiliania huxleyi zeigte eine Studie paradoxerweise eine mögliche Verdoppelung ihrer Kalzifizierungs- und Photosynthese-Rate, gemessen an pH-Werten wie sie bei einem atmosphärischen CO2-Gehalt von 750 ppm in den Ozeanen erwartet werden. Gleichzeitig wird eine deutlich abnehmende Wachstumsrate erwartet. E. huxleyi hält einen Anteil von beinahe 50 Prozent an der biologischen Kohlenstoffpumpe der Meere und leistet ein Drittel der meeresgebundenen Produktion von Calciumcarbonat, ist also eine Schlüsselspezies im Ökosystem. Infolge des bereits um 0,1 Einheiten gefallenen pH-Wertes an der Meeresoberfläche habe das durchschnittliche Gewicht dieser Kalkalgen im Verlauf der vergangenen 220 Jahre um 40 % zugenommen.[37] Eine weitere Untersuchung ergab für Schlangensterne der Art Amphiura filiformis eine erhöhte Kalzifizierungsrate unter saureren Wasserverhältnissen, mittels derer die Schlangensterne die widrigeren Bedingungen kompensieren. Diese Anpassung geht allerdings mit abnehmender Muskelmasse einher, eine auf lange Sicht wahrscheinlich nicht nachhaltige Strategie.[38]
Studien zum Einfluss eines niedrigeren pH-Wertes auf größere Meerestiere ergaben, dass beispielsweise der Laich und die Larven geschädigt werden können. Die Versuche wurden bei sehr viel niedrigeren pH-Werten unternommen, als in naher Zukunft zu erwarten ist, so dass sie nur eine begrenzte Aussagekraft aufweisen.[1]
Auswirkungen auf Fische
Eine Effekt auf das Verhalten von Fischen gilt als nicht bestätigt und wird bezweifelt weil die ursprünglichen Experimente die den Effekt fanden unter Verdacht des Betrugs stehen, viele folgende Experimente nicht verblindet waren und ein besser designtes Experiment, welches das Schwimmverhalten der Fische von einer Software statt von Menschen beurteilen lässt sowie um Betrug auszuräumen gefilmt wurde, keinen Effekt fand.[39]
In einer Studie an Puffotter-Katzenhaien konnte nachgewiesen werden, dass sich die zunehmende Versauerung der Meere negativ auf die Schuppenstrukturen von Haien auswirken könnte.[40][41]
Aktuelle und zukünftige Entwicklung
Aufgrund der je nach Temperatur unterschiedlichen Löslichkeit ist die Versauerung der Meere in den Polregionen am höchsten, da kaltes Wasser mehr Kohlenstoffdioxid lösen kann als warmes Wasser (siehe hierzu: Temperaturabhängigkeit der Henry-Konstante).[42] Auch regional und saisonal kann der pH-Wert Schwankungen unterliegen, zum Beispiel durch Änderungen von Meeresströmungen oder biogeochemische Prozesse.[43][44] Diese Einflüsse müssen von dem durch Treibhausgasemissionen verursachten Trend einzelner Messreihen getrennt werden. Bei einer detaillierten, über acht Jahre laufenden Untersuchung vor der US-amerikanischen Tatoosh Island, nahe der Olympic-Halbinsel im Staat Washington gelegen, schwankte der örtliche pH-Wert im Tages- wie auch im Jahresverlauf deutlich stärker, als zuvor angenommen, und zwar um bis zu einer pH-Einheit innerhalb eines Jahres sowie um 1,5 Einheiten im Untersuchungszeitraum 2000–2007. Parallel nahm der pH-Wert insgesamt signifikant ab, und zwar mit durchschnittlich −0,045 Einheiten pro Jahr deutlich schneller als von Modellen berechnet. Auf die Biologie vor Ort hatte diese Reduktionen einen erkennbaren Effekt. Die Kalifornische Muschel, Miesmuscheln und Entenmuscheln nahmen in der Folge ab, während verschiedene Seepocken sowie einige Algenarten zunahmen.[45]
Ohne den Senkeneffekt der Meere läge die atmosphärische Konzentration von Kohlenstoffdioxid heute um 55 ppm höher, also bei wenigstens 466 ppm statt bei aktuell 411 ppm.[46] Über den Zeitraum von Jahrhunderten gerechnet sollen die Ozeane in der Lage sein, zwischen 65 und 92 % der anthropogenen CO2-Emissionen aufzunehmen. Phänomene wie ein zunehmender Revelle-Faktor sorgen jedoch dafür, dass mit steigenden Temperaturen und wachsendem atmosphärischem CO2-Anteil die Aufnahmefähigkeit der Meere für Kohlenstoff sinkt.[13] Bis 2100 dürfte sich entsprechend die Aufnahmekapazität des Wassers für CO2 um etwa 7–10 % verringern.[47] Die Erwärmung des Meerwassers führt ebenfalls zu einer verringerten Kohlenstoffdioxid-Aufnahme, bis Ende des 21. Jahrhunderts wahrscheinlich um 9–14 %.[48]
Insgesamt dürfte die Senkenfähigkeit der Meere Modellrechnungen zufolge bis zum Ende des 21. Jahrhunderts um ca. 5–16 % abnehmen.[47] Es gibt Hinweise darauf, dass dieser Prozess möglicherweise bereits eingesetzt hat. Relativ zur theoretisch erwarteten Aufnahme hat der Südliche Ozean zwischen 1981 und 2004 anscheinend 0,08 Gt Kohlenstoff pro Jahr zu wenig aufgenommen.[49] Dies ist besonders bedeutend, da die Meere südlich von 30° S (der Südliche Ozean liegt südlich von 60° S) zwischen einem Drittel und der Hälfte des von Ozeanen weltweit gebundenen Kohlenstoffdioxids aufnehmen.[50] Im Nordatlantik schwächte sich die Aufnahmekapazität nicht nur theoretisch ab, sondern sie reduzierte sich faktisch zwischen 1994–1995 und 2002–2005 um über 50 % oder um ungefähr 0,24 Gt Kohlenstoff.[51] Dies deutet auf eine deutlich gesunkene Pufferkapazität des Meeres für atmosphärisches Kohlenstoffdioxid hin.[52] In beiden Fällen sind vermutlich veränderte Winde beziehungsweise abnehmende Durchmischung von Oberflächen- und Tiefenwasser mit ursächlich für den Rückgang.
Bei einer Verdoppelung der atmosphärischen CO2-Konzentration im Vergleich zum vorindustriellen Level von 280 ppm (parts per million, Teile pro Million) wird mit einer weiteren Absenkung des pH-Wertes auf 7,91 gerechnet, bei einer Verdreifachung auf 7,76[10] oder um ungefähr 0,5 Punkte.[1] Bis zum Ende des 21. Jahrhunderts wird damit ein so niedriger pH-Wert in den Ozeanen erwartet, wie er seit wenigstens 650.000 Jahren nicht mehr vorgekommen ist. Wird der Zeitraum der Schätzung um einige Jahrhunderte in die Zukunft erweitert, scheint eine Absenkung des pH-Werts um bis zu 0,7 Punkte möglich. Dieses Worst-Case-Szenario setzt voraus, dass der größte Teil der noch vorhandenen fossilen Brennstoffe verbraucht wird einschließlich der nicht wirtschaftlich nutzbaren Streuvorkommen. Dies wäre wahrscheinlich eine stärkere Versauerung als jemals zuvor in den vergangenen 300 Millionen Jahren, mit der möglichen Ausnahme seltener und extremer Katastrophenereignisse.[25] Ein solcher hypothetischer Zustand wäre im Rahmen menschlicher Zeitskalen kaum reversibel; es würde wenigstens mehrere zehntausend Jahre dauern, bis auf natürlichem Weg der vorindustrielle pH-Wert wieder erreicht würde, wenn überhaupt.[53][54]
Ozeanversauerung und Massenaussterbe-Ereignisse in der Erdgeschichte
Drei der fünf großen Massenaussterben im Phanerozoikum waren mit einem schnellen Anstieg der atmosphärischen Kohlenstoffdioxid-Konzentration verbunden, die wahrscheinlich auf dem intensiven Vulkanismus Magmatischer Großprovinzen in Kombination mit der thermischen Dissoziation von Methanhydrat beruhten.[55][56] Die geowissenschaftliche Forschung konzentrierte sich zunächst auf die Folgen von möglichen klimatischen Auswirkungen auf die Biodiversität,[57] bis eine Studie im Jahr 2004 auf den Zusammenhang des Massenaussterbens am Ende der Trias mit einer reduzierten Kalksättigung in den Ozeanen als Folge stark erhöhter vulkanogener CO2-Konzentrationen hinwies.[58] Das Massenaussterben an der Trias-Jura-Grenze gilt als gut dokumentiertes Beispiel eines marinen Aussterbe-Ereignisses aufgrund von Ozeanversauerung, da vulkanische Aktivitäten, Änderungen im Kohlenstoff-Isotopenverhältnis, Abnahme von Karbonatsedimentation und marines Artensterben in der stratigraphischen Abfolge präzise zusammenfallen[58][59][60][61][62] und zudem die erwartete Selektivität im Aussterbemuster auftrat, das vor allem Arten mit dicken aragonitischen Skeletten betraf.[58][59][63] Neben dem endtriassischen Massenaussterben wird Ozeanversauerung auch als Ursache des marinen Aussterbens am Ende des Perm[64][65] und an der Kreide-Paläogen-Grenze[66] diskutiert.
Weiterführende Artikel
- United Nations Environment Programme-Global Resource Information Database (UNEP/GRID) (Netzwerk des Umweltprogramms der Vereinten Nationen, globale Karten und Graphiken zu Treibhausgasen und Klima)
- BIOACID deutscher Forschungsverbund zum Thema Ozeanversauerung
Publikationen
Weblinks
- FONA-Podcast Ozeanversauerung - eine Bedrohung für das Leben im Meer, mit Ulf Riebesell (GEOMAR) und Thorsten Dittmar (Universität Oldenburg), Juli 2016
- Bundesministerium für Bildung und Forschung, bmbf.de: Wissenschaftsjahr 2016*17 – Meere und Ozeane
- Ozean der Zukunft: Ozeanversauerung: Fakten
- BIOACID-Programm des Bundesforschungsministeriums/GEOMAR I Helmholtz-Zentrum für Ozeanforschung Kiel: Häufig gestellte Fragen: Die wichtigsten Fakten zur Ozeanversauerung. 2010.
- Max-Planck-Gesellschaft/Tim Schröder: Luft gibt dem Ozean Saures. (PDF; 2,6 MB) MaxPlanckForschung 2/2013, S. 18–23
Englisch:
- David Archer: The Acid Ocean – the Other Problem with CO2 Emission. auf: RealClimate.org vom 2. Juli 2005.
- The Ocean Acidification Network
- The Ocean in a High CO2 World., Website der Intergovernmental Oceanographic Commission (IOC) der UNESCO
- European Project of Ocean Acidification (EPOCA)
- Woods Hole Oceanographic Institution: Ocean Acidification.
Einzelnachweise
- John Raven u. a.: Ocean acidification due to increasing atmospheric carbon dioxide. The Royal Society Policy Document 12/05, Juni 2005. (PDF, 1,1 MB)
- Wissenschaftlicher Beirat der Bundesregierung Globale Umweltveränderungen: Die Zukunft der Meere – zu warm, zu hoch, zu sauer. Sondergutachten, Berlin 2006. (PDF, 3,5 MB) (Memento vom 27. Januar 2007 im Internet Archive)
- Meeresatlas 2017 - Daten und Fakten über unseren Umgang mit dem Ozean, dort auf S. 29
- R. E. Zeebe, D. Wolf-Gladrow: CO2 in Seawater: Equilibrium, Kinetics, Isotopes. Elsevier Science, Amsterdam 2001, ISBN 0-444-50946-1.
- Siehe auch in der englischsprachigen Wikipedia den Abschnitt Seawater im Artikel pH.
- Arthur J. Spivack, Chen-Feng You, Jesse Smith: Foraminiferal boron isotope ratios as a proxy for surface ocean pH over the past 21 Myr. In: Nature. Vol. 363, 1993, S. 149–151, 13. Mai 1993, doi:10.1038/363149a0.
- Mojib Latif: Bringen wir das Klima aus dem Takt?, in: Klaus Wiegandt (Hrsg.), Mut zur Nachhaltigkeit. 12 Wege in die Zukunft. Frankfurt am Main 2016, 80-112, S. 106f.
- Fünfter Sachstandsbericht des IPCC, zit. nach: Stefan Rahmstorf, Katherine Richardson: Wie bedroht sind die Ozeane?, in: Klaus Wiegandt (Hrsg.), Mut zur Nachhaltigkeit. 12 Wege in die Zukunft. Frankfurt am Main 2016, 113-146, S. 127.
- Mark Z. Jacobson: Studying ocean acidification with conservative, stable numerical schemes for nonequilibrium air-ocean exchange and ocean equilibrium chemistry. In: Journal of Geophysical Research. Vol. 110, 2005, D07302, doi:10.1029/2004JD005220 (freier Volltext).
- NSF, NOAA und USGS: Impacts of Ocean Acidification on Coral Reefs and Other Marine Calcifiers: A Guide for Future Research. 2006. (PDF, 9,9 MB) (Memento vom 20. Juli 2011 im Internet Archive)
- Scott C. Doney, Victoria J. Fabry, Richard A. Feely, Joan A. Kleypas: Ocean Acidification: The other CO2 Problem. In: Annual Reviews of Marine Science. Januar 2009, S. 214, doi:10.1146/annurev.marine.010908.163834.
- M. Hoppema: Weddell Sea is a globally significant contributor to deep-sea sequestration of natural carbon dioxide. In: Deep-sea research. I, 2004, Vol. 51, S. 1169–1177, doi:10.1016/j.dsr.2004.02.011.
- Christopher L. Sabine, Richard A. Feely, Nicolas Gruber u. a.: The Oceanic Sink for Anthropogenic CO2. In: Science. Vol. 305, Nr. 5682, 2004, S. 367–371, doi:10.1126/science.1097403. (PDF) (Memento vom 6. Juli 2007 im Internet Archive)
- Josep Canadell, Corinne Le Quéré, Michael Raupach, Christopher Field, Erik Buitenhuis, Philippe Ciais, Thomas Conway, Nathan Gillett, R. Houghton, Gregg Marland: Contributions to accelerating atmospheric CO2 growth from economic activity, carbon intensity, and efficiency of natural sinks. In: Proceedings of the National Academy of Sciences. 2007, (online, PDF; 389 kB) (Memento des Originals vom 9. April 2008 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- Ben I. McNeil, Richard J. Matear, Robert M. Key u. a.: Anthropogenic CO2 Uptake by the Ocean Based on the Global Chlorofluorocarbon Data Set. In: Science. Vol. 299, Nr. 5604, 2003, S. 235–239, 10. Januar, doi:10.1126/science.1077429.
- D. Archer, H. Kheshgi, Ernst Maier-Reimer: The Dynamics of Fossil Fuel CO2 Neutralization by Marine CaCO3. In: Global Biogeochemical Cycles. Vol. 12, Nr. 259–276, 1998. (online)
- Toste Tanhua, Arne Körtzinger, Karsten Friis u. a.: An estimate of anthropogenic CO2 inventory from decadal changes in oceanic carbon content. In: Proceedings of the National Academy of Sciences. Vol. 104, Nr. 9, 2007, S. 3037–3042, doi:10.1073/pnas.0606574104.
- Siehe hierzu auch: Simone Ulmer: Die Ozeane – ein unterschätzter CO<sub>2</sub>-Speicher? (Memento vom 5. März 2007 im Internet Archive) In: Neue Zürcher Zeitung. 27. Februar 2007.
- Richard A. Feely, Christopher L. Sabine, Kitack Lee u. a.: Impact of Anthropogenic CO2 on the CaCO3 System in the Oceans. In: Science. Vol. 305, Nr. 5682, 2004, S. 362–366, doi:10.1126/science.1097329.
- World Ocean Review Der Einfluss des pH-Werts auf den Stoffwechsel von Meeresorganismen. 2010.
- Stefan Rahmstorf, Katherine Richardson: Wie bedroht sind die Ozeane?, in: Klaus Wiegandt (Hrsg.), Mut zur Nachhaltigkeit. 12 Wege in die Zukunft. Frankfurt am Main 2016, 113-146, S. 128.
- James C. Orr, Victoria J. Fabry, Olivier Aumont u. a.: Anthropogenic ocean acidification over the twenty-first century and its impact on calcifying organisms. In: Nature. Vol. 437, 29. September 2005, S. 681–686, doi:10.1038/nature04095.
- Stichwort Biomineralisation: Die Tricks der Kalk-Produzenten. auf: scinexx.de, 15. Januar 2005.
- Gabriela Negrete-García, Nicole S. Lovenduski, Claudine Hauri, Kristen M. Krumhardt, Siv K. Lauvset: Sudden emergence of a shallow aragonite saturation horizon in the Southern Ocean. In: Nature Climate Change. 9, 2019, S. 313, doi:10.1038/s41558-019-0418-8.
- Ken Caldeira, Michael E. Wickett: Oceanography: Anthropogenic carbon and ocean pH. In: Nature. Vol. 425, 2003, S. 365, doi:10.1038/425365a.
- Maoz Fine, Dan Tchernov: Scleractinian Coral Species Survive and Recover from Decalcification. In: Science. Vol. 315, Nr. 5820, S. 1811, 30. März 2007, doi:10.1126/science.1137094.
- C. Maier, J. Hegeman, M.G. Weinbauer, J.-P. Gattuso: Calcification of the cold-water coral Lophelia pertusa, under ambient and reduced pH. In: Biogeosciences. 6, 2009, S. 1671–1680. (online)
- Ilsa B. Kuffner, Andreas J. Andersson, Paul L. Jokiel, Ku’ulei S. Rodgers, Fred T. Mackenzie: Decreased abundance of crustose coralline algae due to ocean acidification. In: Nature Geoscience. online veröffentlicht am 23. Dezember 2007, doi:10.1038/ngeo100. Siehe auch die Presseerklärung des US Geological Survey zu dieser Studie.
- Philip L. Munday, Danielle L. Dixson, Jennifer M. Donelson u. a.: Ocean acidification impairs olfactory discrimination and homing ability of a marine fish. In: Proceedings of the National Academy of Sciences. Vol. 106, No. 6, 10. Februar 2009, S. 1848–1852, doi:10.1073/pnas.0809996106.
- Intergovernmental Panel on Climate Change: Climate Change 2007: Climate Change Impacts, Adaptation and Vulnerability. Summary for Policymakers. 2007. (PDF; 946 kB)
- Shirayama Yoshihisa, Haruko Kurihara, Hisayo Thornton u. a.: Impacts on ocean life in a high-CO2 world. Seto Marine Biological Laboratory, Kyoto University, 2004, PowerPoint-Präsentation.
- Jon N. Havenhand, Fenina-Raphaela Buttler, Michael C. Thorndyke, Jane E. Williamson: Near-future levels of ocean acidifi cation reduce fertilization success in a sea urchin. In: Current Biology. Vorab-Online-Veröffentlichung vom 31. Juli 2008, doi:10.1016/j.cub.2008.06.015.
- Frédéric Gazeau, Christophe Quiblier, Jeroen M. Jansen u. a.: Impact of elevated CO2 on shellfish calcification. In: Geophysical Research Letters. Vol. 34, 2007, L07603, doi:10.1029/2006GL028554.
- Ulf Riebesell, Ingrid Zondervan, Björn Rost, Philippe D. Tortell, Richard E. Zeebe, Francois M. Morel: Reduced calcification of marine plankton in response to increased atmospheric CO2. In: Nature. Vol. 407, 21. September 2000, S. 364–367, doi:10.1038/35030078.
- Ulf Riebesell: Effects of CO2 enrichment on marine phytoplankton. In: Journal of Oceanography. 60, 2004, S. 719–729, doi:10.1007/s10872-004-5764-z.
- Andrew D.Moy, William R. Howard, Stephen G. Bray, Thomas W. Trull: Reduced calcification in modern Southern Ocean planktonic foraminifera. In: Nature Geoscience. online veröffentlicht am 8. März 2009, doi:10.1038/ngeo460.
- M. Debora Iglesias-Rodriguez, Paul R. Halloran, Rosalind E. M. Rickaby u. a.: Phytoplankton Calcification in a High-CO2 World. In: Science. Vol. 320, 2008, Nr. 5874, S. 336–340, doi:10.1126/science.1154122.
- Hannah L. Wood, John I. Spicer, Stephen Widdicombe: Ocean acidification may increase calcification rates, but at a cost. In: Proceedings of the Royal Society B, Biological Sciences. online veröffentlicht am 6. Mai 2008, doi:10.1098/rspb.2008.0343.
- Martin Enserink: Does ocean acidification alter fish behavior? Fraud allegations create a sea of doubt. In: Science. 6. Mai 2021, abgerufen am 11. Mai 2021.
- Jacqueline Dziergwa, Sarika Singh u. a.: Acid-base adjustments and first evidence of denticle corrosion caused by ocean acidification conditions in a demersal shark species. In: Scientific Reports. 9, 2019, doi:10.1038/s41598-019-54795-7.
- Martin Vieweg: Ozeanversauerung nagt an Hai-Schuppen. In: wissenschaft.de (natur.de). 23. Dezember 2019, abgerufen am 28. Dezember 2019.
- Mojib Latif: Bringen wir das Klima aus dem Takt?, in: Klaus Wiegandt (Hrsg.), Mut zur Nachhaltigkeit. 12 Wege in die Zukunft. Frankfurt am Main 2016, 80-112, S. 107.
- Via Laser in die Vergangenheit der Ozeane. Abgerufen am 8. Februar 2017.
- Nathalie Goodkin et al.: Ocean circulation and biogeochemistry moderate interannual and decadal surface water pH changes in the Sargasso Sea. In: Geophysical Research Letters. Band 42, Nr. 12, 2015, S. 4931–4939.
- J. Timothy Wootton, Catherine A. Pfister, James D. Forester: Dynamic patterns and ecological impacts of declining ocean pH in a high-resolution multi-year dataset. In: Proceedings of the National Academy of Sciences. Vol. 105, 2008, No. 48, S. 18848–18853, December 2, doi:10.1073/pnas.0810079105.
- Täglich CO2. 23. Juli 2019, abgerufen am 23. Juli 2019.
- G.K.Plattner, F. Joos, T.F. Stocker, O. Marchal: Feedback mechanisms and sensitivities of ocean carbon uptake under global warming. In: Tellus B. Volume 53, Nr. 5, November 2001, S. 564–592, doi:10.1034/j.1600-0889.2001.530504.x.
- J.B. Greenblatt, J.L. Sarmiento: Variability and climate feedback mechanisms in ocean uptake of CO2. In: C.B. Field, M.R. Raupach (Hrsg.): SCOPE 62: The Global Carbon Cycle: Integrating Humans, Climate and the Natural World. Island Press, Washington DC 2004, S. 257–275.
- C. Le Quéré, C. Rödenbeck, E.T. Buitenhuis, T. J. Conway, R. Langenfelds, A. Gomez, C. Labuschagne, M. Ramonet, T. Nakazawa, N. Metzl, N. Gillett, M. Heimann: Saturation of the Southern ocean CO2 sink due to recent climate change. In: Science. Vol. 316, 2007, S. 1735–1738, doi:10.1126/science.1136188.
- James C. Orr, Ernst Maier-Reimer, Uwe Mikolajewicz u. a.: Estimates of Anthropogenic Carbon Uptake From Four Three-Dimensional Global Ocean Models. In: Global Biogeochemical Cycles. 2001, Vol. 15, Nr. 1, S. 43–60. (PDF; 5,7 MB)
- Ute Schuster, Andrew J. Watson: A variable and decreasing sink for atmospheric CO2 in the North Atlantic. In: Journal of Geophysical Research. 2007, Vol. 112, C11006, doi:10.1029/2006JC003941.
- HelmuthThomas, A. E. Friederike Prowe, Steven van Heuven u. a.: Rapid decline of the CO2 buffering capacity in the North Sea and implications for the North Atlantic Ocean. In: Global Biogeochemical Cycles. Vol. 21, 2007, GB4001, doi:10.1029/2006GB002825.
- Michael J. Henehan, Andy Ridgwell, Ellen Thomas, Shuang Zhang, Laia Alegret: Rapid ocean acidification and protracted Earth system recovery followed the end-Cretaceous Chicxulub impact. In: Proceedings of the National Academy of Sciences. 17. Oktober 2019, ISSN 0027-8424, S. 201905989, doi:10.1073/pnas.1905989116, PMID 31636204 (Online [abgerufen am 22. Oktober 2019]).
- Damian Carrington: Ocean acidification can cause mass extinctions, fossils reveal. In: The Guardian. 21. Oktober 2019, ISSN 0261-3077 (Online [abgerufen am 22. Oktober 2019]).
- D. J. Beerling, R. A. Berner: Biogeochemical constraints on the Triassic-Jurassic boundary carbon cycle event: TR-J BOUNDARY C-CYCLE DYNAMICS. In: Global Biogeochemical Cycles. Band 16, Nr. 3, September 2002, S. 10–1–10–13, doi:10.1029/2001GB001637 (Online [abgerufen am 25. Mai 2020]).
- David P.G. Bond, Paul B. Wignall: Large igneous provinces and mass extinctions: An update. In: Volcanism, Impacts, and Mass Extinctions: Causes and Effects. Geological Society of America, 2014, ISBN 978-0-8137-2505-5, doi:10.1130/2014.2505(02) (Online [abgerufen am 25. Mai 2020]).
- Hallam, A. & Wignall, P. B.: Mass extinctions and their aftermath. Oxford University Press, Oxford [England] 1997, ISBN 0-19-854917-2.
- Michael Hautmann: Effect of end-Triassic CO2-maximum on carbonate sedimentation and marine mass extinction. In: Facies. Band 50, Nr. 2, September 2004, ISSN 0172-9179, doi:10.1007/s10347-004-0020-y (Online [abgerufen am 25. Mai 2020]).
- Michael Hautmann, Michael J. Benton, Adam Tomašových: Catastrophic ocean acidification at the Triassic-Jurassic boundary. In: Neues Jahrbuch für Geologie und Paläontologie - Abhandlungen. Band 249, Nr. 1, 1. Juli 2008, S. 119–127, doi:10.1127/0077-7749/2008/0249-0119 (ingenta.com [abgerufen am 25. Mai 2020]).
- Sarah E. Greene, Rowan C. Martindale, Kathleen A. Ritterbush, David J. Bottjer, Frank A. Corsetti: Recognising ocean acidification in deep time: An evaluation of the evidence for acidification across the Triassic-Jurassic boundary. In: Earth-Science Reviews. Band 113, Nr. 1-2, Juni 2012, S. 72–93, doi:10.1016/j.earscirev.2012.03.009 (Online [abgerufen am 25. Mai 2020]).
- T. J. Blackburn, P. E. Olsen, S. A. Bowring, N. M. McLean, D. V. Kent: Zircon U-Pb Geochronology Links the End-Triassic Extinction with the Central Atlantic Magmatic Province. In: Science. Band 340, Nr. 6135, 24. Mai 2013, ISSN 0036-8075, S. 941–945, doi:10.1126/science.1234204 (Online [abgerufen am 25. Mai 2020]).
- Sofie Lindström, Bas van de Schootbrugge, Katrine H. Hansen, Gunver K. Pedersen, Peter Alsen: A new correlation of Triassic–Jurassic boundary successions in NW Europe, Nevada and Peru, and the Central Atlantic Magmatic Province: A time-line for the end-Triassic mass extinction. In: Palaeogeography, Palaeoclimatology, Palaeoecology. Band 478, Juli 2017, S. 80–102, doi:10.1016/j.palaeo.2016.12.025 (Online [abgerufen am 25. Mai 2020]).
- Michael Hautmann: Extinction: End-Triassic Mass Extinction. In: eLS. John Wiley & Sons, Ltd, Chichester, UK 2012, ISBN 978-0-470-01617-6, S. a0001655.pub3, doi:10.1002/9780470015902.a0001655.pub3 (Online [abgerufen am 25. Mai 2020]).
- J. L. Payne, D. J. Lehrmann, D. Follett, M. Seibel, L. R. Kump: Erosional truncation of uppermost Permian shallow-marine carbonates and implications for Permian-Triassic boundary events. In: Geological Society of America Bulletin. Band 119, Nr. 7-8, 1. Juli 2007, ISSN 0016-7606, S. 771–784, doi:10.1130/B26091.1 (Online [abgerufen am 25. Mai 2020]).
- M. O. Clarkson, S. A. Kasemann, R. A. Wood, T. M. Lenton, S. J. Daines: Ocean acidification and the Permo-Triassic mass extinction. In: Science. Band 348, Nr. 6231, 10. April 2015, ISSN 0036-8075, S. 229–232, doi:10.1126/science.aaa0193 (Online [abgerufen am 25. Mai 2020]).
- Michael J. Henehan, Andy Ridgwell, Ellen Thomas, Shuang Zhang, Laia Alegret: Rapid ocean acidification and protracted Earth system recovery followed the end-Cretaceous Chicxulub impact. In: Proceedings of the National Academy of Sciences. Band 116, Nr. 45, 5. November 2019, ISSN 0027-8424, S. 22500–22504, doi:10.1073/pnas.1905989116, PMID 31636204, PMC 6842625 (freier Volltext) – (Online [abgerufen am 25. Mai 2020]).