Stechmücken
Stechmücken (Culicidae) sind eine Familie von Insekten innerhalb der Ordnung der Zweiflügler. Im bundesdeutschen und im Schweizer Hochdeutsch werden die Insekten als Mücken bezeichnet, im österreichischen Hochdeutsch als Gelsen.[1] Weltweit gibt es mehr als 3600 Stechmückenarten.[2] In Europa kommen 104 Arten vor, von denen fast alle auch in Mitteleuropa zu finden sind.[3]
| Stechmücken | ||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|

Gelbfiebermücke (Aedes aegypti) | ||||||||||||
| Systematik | ||||||||||||
| ||||||||||||
| Wissenschaftlicher Name | ||||||||||||
| Culicidae | ||||||||||||
| Meigen, 1818 | ||||||||||||
| Unterfamilien | ||||||||||||
|
Mit Hilfe eines spezialisierten Mundwerkzeuges, des stechend-saugenden Rüssels, können weibliche Stechmücken die Haut ihrer Wirte durchstechen und Blut saugen. Die mit der Blutmahlzeit aufgenommenen Proteine (besonders aus Hämoglobin und Albumin) und Eisen (aus Porphyrin-Verbindungen wie Häme)[4] sind für die Produktion der Eier essentiell. Ansonsten ernähren sich weibliche Stechmücken wie auch die Männchen von Nektar und anderen zuckerhaltigen Pflanzensäften. Unterschiedliche Stechmückenarten können auf verschiedene Wirte oder Wirtsgruppen spezialisiert sein. Bestimmte Stechmücken sind als Krankheitsüberträger von Infektionskrankheiten, zum Beispiel Malaria oder Denguefieber, bedeutend.
Die stammesgeschichtlich älteste bisher bekannte Stechmücke ist als Inkluse (Einschluss) in etwa 79 Millionen Jahre altem Bernsteinfossil erhalten.[5] Eine ursprünglichere Schwesterart der Stechmücken ist in 90 bis 100 Millionen Jahre altem Bernstein überliefert.[6]
Bezeichnungen
Neben den standardsprachlichen Bezeichnungen werden Mücken bzw. Gelsen in Teilen Bayerns und Österreichs auch „Stauzen“, „Staunzen“, „Stanzen“, in vielen Teilen des deutschen Sprachraumes auch „Schnaken“ genannt. In den Mundarten sind die Bezeichnungen „Mücke“, „Schnake“, „Fliege“ und „Motte“ oft nicht klar abgegrenzt.[7]
Das Wort „Schnake“ steht hier im Gegensatz zur Bezeichnung Schnaken in der Zoologie, unter der die Arten einer anderen Familie der Zweiflügler zusammengefasst werden, die kein Blut saugen. Die zum Teil gebräuchliche Bezeichnung „Moskito“ ist von dem spanischen und portugiesischen Wort mosquito (wörtlich: kleine Fliege) abgeleitet, das ebenfalls „Mücke“ bedeutet. Von den Stechmücken sind andere blutsaugende Insekten abzugrenzen.
Vorkommen
Stechmücken sind weltweit verbreitet, sie fehlen nur in der Antarktis[8] und auf einigen isoliert liegenden ozeanischen Inseln,[9] oder auf Island.[10] Vor allem große sumpfige Gebiete wie in der Tundra und Taiga sind ideale Brutstätten für die Mücke. Allerdings haben die verschiedenen Arten sehr unterschiedliche Verbreitungsgebiete. In Deutschland, Österreich und der Schweiz sind neben anderen vorkommenden Arten insbesondere die Gemeine Stechmücke und die etwas größere Ringelmücke häufig.
Merkmale
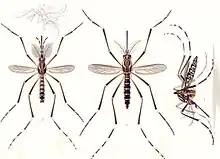
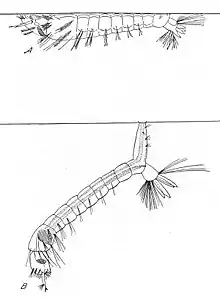
Erwachsene Stechmücken sind feingliedrige, abhängig von Art und der Ernährung der Jugendstadien unterschiedlich große zweigeflügelte Insekten, aber selten größer als 15 Millimeter. Ihre Flügel sind häutig, teilweise beschuppt, dazu verfügen sie als Zweiflügler über zwei Schwingkölbchen oder Halteren. Ihre Fühler sind mittellang und vielgliedrig, sie haben einen etwa ebenso langen Saugrüssel, einen schlanken Körper und lange Beine. Stechmücken wiegen etwa 2 bis 2,5 Milligramm.
Die Männchen sind meist kleiner als die Weibchen. Man erkennt sie vor allem an ihren buschigeren Fühlern. Weibliche Vertreter der Unterfamilie Culicinae haben zudem Mundtaster (Palpen), die erheblich kürzer sind als der Stechrüssel. Bei Vertretern der Unterfamilie Anophelinae sind die Palpen bei beiden Geschlechtern etwa so lang wie der Rüssel.
Verwechslungen
Es besteht die Möglichkeit einer Verwechslung mit anderen Zweiflüglern, vor allem mit Zuckmücken, Büschelmücken und Wiesenschnaken, die Stechmücken in ihrem Aussehen ähneln, jedoch kein Blut saugen.
Flugeigenschaften
Stechmücken können mit einer Geschwindigkeit von etwa 1,5 bis 2,5 Kilometer pro Stunde fliegen. Die Flughöhe einer Stechmücke ist im Allgemeinen abhängig von der jeweiligen Art, von der Höhe des Aufenthaltsorts über dem Meeresspiegel, vom Wetter, dem Luftdruck, der Temperatur und den Lichtverhältnissen. Bei warmem, windstillem Wetter mit leichter Bewölkung ohne starke, direkte Sonneneinstrahlung ist die Aktivität der Stechmücke am größten. Dann kann von einigen Arten zudem eine große Flughöhe erreicht werden, indem sie von thermischen Aufwinden in Höhen von über 100 Meter über dem Boden getragen werden. Bei kühler oder regnerischer Witterung fliegen viele Stechmücken nur kurze Distanzen und verbleiben eher in Bodennähe. Bei deutlichem Wind und Temperaturen im Bereich des Gefrierpunktes stellen sie die Flugaktivität komplett ein.
Forscher vom Georgia Institute of Technology haben festgestellt, dass Stechmücken dank ihrer geringen Masse Kollisionen mit Regentropfen überstehen. Dabei verkraften sie Beschleunigungen zwischen 100 und 300g, laut Studie „die höchsten Beschleunigungen im Tierreich“.[11][12][13]
Ernährung

Die Weibchen müssen nach der Befruchtung durch die Männchen eine Blutmahlzeit zu sich nehmen, um Eier zu bilden; die Aufnahme von Blut und dem darin enthaltenen Protein ist somit unentbehrlich für die Fortpflanzung der meisten Stechmücken. Die Blutmahlzeit wird mit Hilfe eines Stechrüssels aufgenommen. Dabei bilden verschiedene Mundwerkzeuge eine Struktur aus Stechborsten (Oberlippe oder Labrum, paarige Ober- und Unterkiefer oder Mandibel und Maxille sowie Schlundrohr oder Hypopharynx). Dieses Stechborstenbündel kann die Haut des Wirts durchdringen und bildet im Inneren zwei Kanäle. Durch den einen kann Speichel injiziert, durch den anderen das Blut aufgesaugt werden. In der Ruhestellung liegen die Stechborsten in einer von der Unterlippe Labium gebildeten Scheide verborgen. Beim Stich dringt die Unterlippe selbst nicht in die Haut ein, sondern wird gestaucht und biegt sich nach hinten.
Die Männchen saugen dagegen kein Blut. Ihre Stechborsten sind verkürzt, für einen Stich ungeeignet und dienen nur zum Aufsaugen freiliegender Flüssigkeiten.
Zuckerhaltige Pflanzensäfte werden sowohl von Weibchen als auch von Männchen aufgenommen, um ihren Energiebedarf zu decken. Die wichtigste Kohlenhydratquelle ist dabei Nektar, wobei bestimmte Nektarquellen anderen vorgezogen werden. Als effektive Bestäuber von Pflanzen sind sie bisher allerdings nur für zwei Arten beschrieben worden: die Orchidee Habenaria (Platanthera) obtusata und das Ohrlöffel-Leimkraut Silene otites, ein Nelkengewächs. Dabei scheinen auch bestimmte von den Blüten produzierte Duftstoffe für Stechmücken attraktiv zu sein.[14]
Eine Ausnahme von der Regel, dass weibliche Stechmücken Blut für die Produktion ihrer Eier benötigen, bilden die Weibchen der Gattung Toxorhynchites, deren Mundwerkzeuge sich nicht für den Stich eines Blutwirts eignen. Die Larven dieser Gattung fressen andere Mückenlarven und sind damit in der Lage, bereits im Jugendstadium genügend Protein für die Eiproduktion als erwachsenes Weibchen aufzunehmen und zu speichern. Auch bei anderen Stämmen oder Arten wie bei Culex pipiens molestus[15] kann es vorkommen, dass Weibchen ohne Blutmahlzeit ein erstes Gelege produzieren (Autogenie), bei dem die Eizahl deutlich verringert ist.[16] Teilweise ist es sogar möglich, dass mehr als nur ein autogenes Gelege produziert wird.[17]
Auffindung der Nahrungsquelle:
Durch Labor- und Freilandexperimente hat man herausgefunden, dass Stechmücken vor allem durch ausgeatmetes Kohlenstoffdioxid und Körperdüfte (zum Beispiel verschiedene Fettsäuren und Ammoniak) ihre Blutwirte finden. Abhängig von Art und Wirtsspezifität können dabei einzelne Substanzen eine besondere Bedeutung haben. So ist beispielsweise bei der auf den Menschen spezialisierten Gelbfiebermücke (Aedes (Stegomyia) aegypti) die auf der menschlichen Haut auftretende Milchsäure ein zentraler Reiz für die Wirtsfindung.[18]
Bei der Wirtsfindung folgen die Stechmücken der Duftfahne ihres Wirts bis zu ihrer Quelle. Dabei geben anscheinend neben der chemischen Zusammensetzung der Duftfahne auch ihre Größe, Struktur und Form der Mücke wichtige Informationen über den Wirt und seine Entfernung.[19][20] Im Nahbereich spielen zusätzlich visuelle Hinweise und die Körperwärme eine Rolle.
Fortpflanzung
Viele Stechmückenarten paaren sich in stationären Schwärmen, die zu bestimmten Tageszeiten (oft zur Dämmerung) gebildet werden. Diese Paarungsschwärme können aus tausenden Individuen bestehen; auch dies ist abhängig von der Art. Die einzelnen Teilnehmer fliegen dabei in Schleifen oder Zickzackbewegungen und orientieren sich normalerweise an auffälligen Landmarken. Die Schwärme bestehen zum größten Teil aus Männchen. Möglicherweise spielen bei der Schwarmbildung und dem Anlocken der Weibchen arteigene Duftstoffe (Aggregationspheromone) eine Rolle.[21]
Sich nähernde Weibchen fliegen in den Schwarm hinein und werden begattet. Dabei orientieren sich die Männchen vor allem an dem Summton der Weibchen, den sie mit Hilfe spezieller Hörorgane an der Basis ihrer buschigen Antennen wahrnehmen (Johnstonsches Organ). Obwohl die Antennen der Weibchen für den Empfang von Tönen weniger gut geeignet zu sein scheinen, wurde inzwischen nachgewiesen, dass auch die Weibchen auf den Flügelschlagton der Männchen reagieren – beide Partner passen während der Annäherung die Höhe ihrer Flugtöne aneinander an.[22]
Auch eine Vielzahl anderer Insekten bilden Paarungsschwärme. Die meisten im Sommer angetroffenen Schwärme werden beispielsweise von Zuckmücken gebildet.
Entwicklung
Das Leben einer Stechmücke gliedert sich in vier verschiedene Stadien: Ei, Larve, Puppe und Imago (das ausgewachsene Tier).
Ei
Die Eier werden je nach Art entweder einzeln (zum Beispiel Aedes oder Anopheles) oder in Eipaketen oder Schiffchen (zum Beispiel Culex) abgelegt. Die Ablage erfolgt auf der Wasseroberfläche oder in Wassernähe. Die meisten Arten bevorzugen stehende Gewässer. Teilweise reichen bereits kleinste Wassermengen wie in Baumhöhlen, Felsmulden, Bromelien oder ähnlichen Reservoiren aus. Oft sind die Eier von Stechmücken mit solchen Eiablagebiotopen trockenheitsresistent und können ein Austrocknen überstehen (zum Beispiel Gelbfiebermücke oder Asiatische Tigermücke). Die Gattung Wyeomyia legt ihre Eier auch in die Fangbehälter insektenfressender Kannenpflanzen ab, Vertreter der Gattung Deinocerites verwenden normalerweise die Wasseransammlungen am Ende der Höhlen bestimmter Landkrabben.
Viele Vertreter der Stechmücken legen ihre Eier in feuchten oder sumpfigen Biotopen ab, die Larven schlüpfen dann bei einer Überschwemmung (zum Beispiel die Wiesen- oder Auwaldmücken Aedimorphus vexans und Ochlerotata sticticus oder andere einheimische Vertreter der Gattung). In diesem Fall ist das Ei dann auch gemeinhin das überwinternde Stadium.
Larve
Es gibt vier Larvenstadien. Stechmückenlarven sind ausschließlich Wasserbewohner, atmen aber atmosphärische Luft. Vertreter der Unterfamilien Culicinae haben am achten Hinterleibssegment ein mehr oder weniger langes Atemrohr, durch das sie an der Wasseroberfläche hängend atmen. Als Ausnahme zapfen Larven der Gattung Mansonia mit ihren zähnchenbewehrten Atemsiphons die luftgefüllten Interzellularräume von Pflanzen an und sind so von der Wasseroberfläche unabhängig. Bei der Unterfamilie Anophelinae hängt die Larve horizontal unter der Wasseroberfläche und atmet durch eine ebenfalls am achten Hinterleibssegment befindliche Atemöffnung.
Detritus und Mikroorganismen dienen als Nahrung, die mithilfe bürstenartiger Mundwerkzeuge herbeigestrudelt und dann gefressen wird. Die Larven der Gattung Toxorhynchites leben dagegen räuberisch von anderen Stechmückenlarven. Bei Nahrungsknappheit kommt es bei diesen Larven sogar zu Kannibalismus, weshalb sich in den engen Brutplätzen – in den Tropen meist Bambusstümpfen – selten mehr als eine vollständig ausgewachsene Larve einer Art der Toxorhynchites befindet.
Bei Störung tauchen Stechmückenlarven schnell von der Wasseroberfläche ab. Sie bewegen sich dabei schlängelnd oder zuckend und mithilfe von ruderförmigen Haarbüscheln und -fächern fort.
Die Dauer des Larvenstadiums ist abhängig von der Art, der Temperatur und dem Nährstoffgehalt des Larvenbiotops.
Abhängig von ihren Jugendbiotopen können bestimmte Mückenarten als Larve überwintern (zum Beispiel Mansonia).
Puppe
Mit der vierten Häutung schlüpft die Puppe, die als Ruhestadium keine Nahrung aufnimmt. In diesem Stadium atmet das Tier, normalerweise ebenfalls an der Wasseroberfläche, durch zwei am Prothorax befindliche Atemhörnchen. Hier ist die Gattung Mansonia die Ausnahme; auch ihre Puppen zapfen Luft aus Pflanzen ab.
Stechmückenpuppen sind beweglich und können bei Gefahr schnell von der Wasseroberfläche abtauchen und fliehen.
Die Puppenruhe ist normalerweise kurz, nach wenigen Tagen schlüpft das erwachsene Tier.
Imago
Die Imago (das erwachsene Insekt) schlüpft innerhalb weniger Minuten aus einem dorsalen Riss in der Puppenhaut und ist nach etwa einer Stunde flugfähig. Männchen schlüpfen oft früher aus als die Weibchen.
Viele Anopheles-Arten und die Gattungen Culex und Culiseta überwintern in unseren Breiten als begattete Weibchen an kühlen, feuchten und geschützten Stellen, beispielsweise in Kellern, Höhlen oder Viehställen. Die Männchen sterben im Herbst.
- Entwicklungsstadien
 Mückengelege (Eischiffchen), wahrscheinlich der Gattung Culex. Länge 7 mm
Mückengelege (Eischiffchen), wahrscheinlich der Gattung Culex. Länge 7 mm Larve aus der Unterfamilie Culicinae mit endständigem Atemrohr
Larve aus der Unterfamilie Culicinae mit endständigem Atemrohr Kopf einer culicinen Larve
Kopf einer culicinen Larve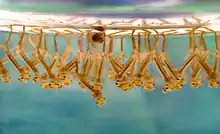 Larven und eine Puppe von Culex in Atemposition an der Wasseroberfläche
Larven und eine Puppe von Culex in Atemposition an der Wasseroberfläche Atemrohr einer Larve aus der Unterfamilie Culicinae
Atemrohr einer Larve aus der Unterfamilie Culicinae Larve der Gattung Anopheles, Unterfamilie Anophelinae
Larve der Gattung Anopheles, Unterfamilie Anophelinae Stechmücken-Puppe – die Vertreter unterschiedlicher Gattungen ähneln sich sehr.
Stechmücken-Puppe – die Vertreter unterschiedlicher Gattungen ähneln sich sehr.
Stechmücken als Krankheitsüberträger
Beim Stich können mit dem Speichel der Stechmücke auch Krankheitserreger (Viren, Bakterien sowie einzellige oder mehrzellige Parasiten) übertragen werden, welche die Mücke bei einer vorangegangenen Nahrungsaufnahme aufgenommen hat.[23] Wichtig ist hierbei, dass sich die Krankheitserreger nach dem Stich eines infizierten Wirts auch in der Mücke vermehren und in die Speicheldrüsen gelangen. Dafür müssen die Erreger beziehungsweise ihre darauf spezialisierten Zwischenstadien die Mücke ebenfalls infizieren. Deshalb kann auch nicht jede Mücke jeden Krankheitserreger übertragen. Die Zeitspanne zwischen der Aufnahme eines Krankheitserregers und der Möglichkeit, ihn weiterzugeben, wird bei Stechmücken und anderen Krankheitsvektoren „extrinsische Inkubationszeit“ genannt. Sie ist temperaturabhängig und dauert meistens zwischen 10 und 14 Tagen. Sticht ein infizierter Vektor also vor Ablauf der extrinsischen Inkubationszeit einen Wirt, kann die Krankheit noch nicht weitergegeben werden.
Wie bei allen Vektoren ist potentiell auch eine mechanische Übertragung durch Erregeranhaftung (Kontamination) des Stechrüssels der Stechmücke möglich, wenn das Insekt während der Nahrungsaufnahme bei einer infizierten Person gestört wird und alsbald auf einer anderen nicht infizierten Person weitersaugt. In der Praxis ist jedoch eine erhebliche Menge von Erregern für eine Infektion erforderlich. Ob diese Mindestmenge zum Beispiel bei einer Kontamination des Stechrüssels allein erreicht werden kann, ist fraglich. Epidemiologisch gibt es auch bis heute zumindest bei den Stechmücken für diese Übertragungsart keine eindeutigen Anzeichen.
Zu den wichtigsten von Stechmücken übertragenen Krankheitserregern gehören Plasmodien (Malaria), im Lymph- oder Blutgefäßsystem lebende parasitäre Würmer (Filariose, Dirofilariose), Viren (Gelbfieber, Denguefieber, West-Nil-Fieber, Chikungunyafieber, Rift-Valley-Fieber) oder Bakterien (Tularämie).
Auch in Europa kommen von Stechmücken übertragene Krankheiten vor. Zu den bekanntesten zählen das West-Nil-Fieber und das Chikungunyafieber. Zu den weniger prominenten von Mücken übertragenen Viruserkrankungen gehört zum Beispiel das in Skandinavien und Karelien vorkommende Sindbis-Virus, das Hautausschläge und hartnäckige Gelenkschmerzen hervorrufen kann. Die entsprechend hervorgerufene Krankheit heißt je nach Untertyp des Virus in Norwegen und Schweden Ockelbo-Krankheit, in Finnland Pogosta-Krankheit und im russischen Teil Kareliens Karelisches Fieber.[24] Durch den Klimawandel bedingt ist von einer zunehmenden Infektionsgefahr durch Stechmücken in Deutschland auszugehen.[25]
Durch den Stich hervorgerufene Körperreaktionen beim Menschen
Schmerzempfindung
Beim Stich einer Stechmücke kann eine sehr geringfügige Schmerzempfindung zustande kommen, wenn der in die Haut eindringende Stechrüssel (Proboscis) einen Schmerznerv trifft oder streift und das betreffende Nahrungsopfer den Stich bewusst wahrnimmt. Allerdings spielen beim Menschen hinsichtlich der dabei dann empfundenen Schmerzintensität diesbezüglich im Gehirn abgespeicherte Vorerfahrungen und emotionale Bewertungen des miterlebten Stichs eine Rolle.
Körperreaktionen und Behandlung
Kurze Zeit nach dem Stich tritt eine gewöhnlich auf die Einstichstelle begrenzte allergische Reaktion ein. Diese ist zumeist verbunden mit einem mehr oder minder starken Juckreiz. Beides wird von den Proteinen ausgelöst, welche die Stechmücke in die Saugstelle einspritzt, um das Gerinnen des Bluts zu verhindern. Oft bildet sich an der Einstichstelle für einige Stunden eine Quaddel. Diese Quaddeln entstehen nach dem Stich durch die Ausschüttung von körpereigenem Histamin.
Auf die gereizte Stelle aufgetragene Antihistaminika haben keine nachgewiesene lindernde Wirkung. Mehrere wissenschaftliche Studien zeigten allerdings, dass eine prophylaktische Gabe oraler Antihistaminika die allergische Reaktion unterdrücken kann. Bei einer großen Stechmückenbelastung kann also für Risikopatienten eine solche präventive Behandlung sinnvoll sein.[26]
Lokale Hyperthermie kann dabei helfen, die Symptome zu reduzieren. Durch die kurzzeitige Temperaturerhöhung der betroffenen Stelle soll der Histaminausstoß verringert und die Weiterleitung des Juckreizes unterbrochen werden.[27] Für die Behandlung kann zum Beispiel ein Wärmestift verwendet werden. In einer Studie konnte die positive Wirkung solcher Wärmestifte bestätigt werden.[28]
Schäden an Weidevieh
Nach dem Hurrikan Lili im Jahr 2002, dem Hurrikan Rita 2005 sowie 2020 nach dem Hurrikan Laura waren in Louisiana, USA Verluste bei Weidevieh nach dem Auftreten großer Moskitoschwärme zu beobachten. Betroffen sind insbesondere Rinder, die im Freien in Koppeln gehalten werden. Die Tiere versuchen durch Bewegung den Stichen zu entkommen, bis sie vor Erschöpfung zusammenbrechen.[29]
Bekämpfung der Stechmücke

Die Bekämpfung von Stechmücken hat eine lange Tradition. Sie begann als Nebeneffekt der Trockenlegung von Feuchtgebieten bereits in der Vorgeschichte. Seit langer Zeit weiß man zudem, dass ein Ölfilm auf den Brutgewässern zur Erstickung der Larven führt. Diese als umweltschädlich geltende Methode wird auch heute noch angewendet. Das Insektizid DDT wurde von den 1940er bis in die 2010er Jahre in vielen Ländern zur Malaria-Bekämpfung eingesetzt.
Seit 1987 wird entlang des Oberrheins von der Kommunalen Aktionsgemeinschaft zur Bekämpfung der Schnakenplage das Bakterium Bacillus thuringiensis israelensis (BTI) zur Bekämpfung von Stechmücken (vor allem von Aedimorphus vexans, die in dieser Gegend auch Rheinschnake genannt wird) eingesetzt. Das Mittel wird großflächig mit Hubschrauber als Eisgranulat ausgebracht und führt zu einem Absterben der Mückenlarven durch Schädigung des Verdauungstrakts. Diese Art der Bekämpfung findet inzwischen auch in anderen Regionen Deutschlands (zum Beispiel am Chiemsee) Anwendung.
Wichtigstes Vorgehen in normalen Wohnsiedlungen ist das regelmäßige Leeren von Regentonnen oder kleinen Wasseransammlungen bzw. deren Abdeckung. Im Gartenteich kann die Entwicklung von Stechmücken zum Beispiel mit einem Fischbesatz behindert werden. Fische fressen allerdings auch andere, in einem möglichst artenreichen Gartenteich erwünschte Wasserbewohner, die ihrerseits teilweise Räuber von Stechmücken sind. So jagen erwachsene Libellen (Odonata) auch adulte Stechmücken; Libellenlarven können einen vermindernden Effekt auf die Anzahl von Mückenlarven haben. Die Larven und Erwachsenen der Rückenschwimmer (Notonectidae), der Schwimmkäfer (Dytiscidae) und bestimmter Wasserfreunde (Hydrophilidae) fressen ebenfalls Stechmückenlarven.[30]
Es gibt darüber hinaus verschiedene Einzelmaßnahmen des Insektenschutzes, mit denen man sich vor Mückenstichen schützen kann.
Ökologische Aspekte
Eine Laborstudie hatte das Ergebnis, dass besonders die ersten und zweiten Larvenstadien der harmlosen Zuckmücke Chironomus riparius schon von Konzentrationen des biologischen Stechmücken-Larvizides Bti betroffen waren, die erheblich unter den im Feld verwendeten Konzentrationen liegen. Zuckmücken sind wegen ihrer weiten Verbreitung und hoher Populationszahlen in Überschwemmungsgebieten eine wichtige Nahrungsquelle für andere Insekten und Wirbeltiere.[31]
In den Tundren der Erde spielen die enorm großen Mückenschwärme eine Rolle bei den jährlichen Wanderungen der Rentiere, indem sie die Tiere veranlassen, immer höher ins Gebirge zu steigen.[32] Ohne diese zyklischen Wanderungen würden die empfindlichen Tundren des hohen Nordens sehr schnell überweidet werden. Eine vermutete große Bedeutung der Bestäubungsfunktion vor allem in den blüten- und mückenreichen, aber bienenarmen Tundren des Nordens ist noch nicht abschließend untersucht.[33]
Gentechnische Ansätze
Mithilfe der Gentechnik wurden verschiedene Ansätze zur Stechmückenbekämpfung entwickelt. Eine Strategie besteht in der Freisetzung von genetisch sterilen Männchen, die nach der Paarung mit Weibchen nicht lebensfähige Nachkommen produzieren (Autozidverfahren oder sterile insect technique). Eine weitere Strategie umfasst das Einbringen von krankheitsunempfindlichen Genen in Stechmückenpopulationen, wodurch diese keine Krankheiten mehr übertragen können.[34]
Arten und Gattungen (Auswahl)
- Gattung Anopheles
- Anopheles algeriensis
- Anopheles atroparvus
- Anopheles claviger
- Anopheles gambiae „Gambische Malariamücke“
- Anopheles maculipennis „Fiebermücke“
- Anopheles messeae
- Anopheles plumbeus
- Anopheles stephensi „Stephens Malariamücke“
- Gattung Bironella
- Gattung Chagasia
- Tribus Aedini (Belkin, 1962) (Stand 2009, nach Reinert, Harbach & Kitching)
- Gattung Acartomyia (Theobald, 1903)
- Acartomyia mariae (Sergent & Sergent, 1903)
- Acartomyia phoeniciae (Coluzzi & Sabatini, 1968)
- Acartomyia zammitii (Theobald, 1903)
- Gattung Aedes (Meigen, 1818)
- Aedes aegypti (Linnaeus, 1762) „Gelbfiebermücke“
- Aedes albopictus (Skuse, 1894) „Asiatische Tigermücke“
- Aedes cinereus (Meigen, 1818)
- Aedes cretinus Edwards, 1921
- Aedes geminus (Peus, 1970)
- Aedes japonicus (Theobald, 1901) „Asiatische Buschmücke“
- Aedes koreicus (Edwards, 1917) „Koreanische Buschmücke“
- Aedes punctor (Kirby, 1837)
- Aedes rossicus (Dolbeski, Gorickaja & Mitrofanova 1930)
- Aedes vexans (Meigen, 1830) „Wiesenmücke oder Rheinschnake“
- Gattung Dahliana (Reinert, Harbach & Kitching, 2006)
- Dahliana echinus (Edwards, 1920)
- Dahliana geniculatus (Olivier, 1791)
- Dahliana gilcolladoi (Sanchez-Covica Villa, Rodriguez Rodriguez & Guillen Uera, 1985)
- Gattung Fredwardsius (Reinert, 2000)
- Fredwardsius vittatus (Bigot, 1861)
- Gattung Finlaya (Theobald, 1903)
- Finlaya kochi
- Gattung Georgecraigius (Reinert, Harbach & Kitching, 2006)
- Untergattung Georgecraigius
- Georgecraigius (Georgecraigius) atropalpus (Coquillett, 1902)
- Georgecraigius (Georgecraigius) epactius (Dyar & Knab, 1908)
- Untergattung Horsfallius (Reinert, Harbach & Kitching, 2006)
- Georgecraigius (Horsfallius) fluviatilis (Lutz, 1904)
- Untergattung Georgecraigius
- Gattung Haemagogus
- Gattung Ochlerotatus (Lynch Arribálzaga, 1891)
- Untergattung Ochlerotatus (Lynch Arribálzaga, 1891)
- Ochlerotatus (Ochlerotatus) angustivittatus (Dyar & Knab, 1907)
- Ochlerotatus (Ochlerotatus) atactavittatus (Arnell, 1976)
- Ochlerotatus (Ochlerotatus) auratus (Grabham, 1906)
- Untergattung Rusticoidus (Shevchenko & Prudkina, 1973)
- Ochlerotatus (Rusticoidus) krymmontanus (Alekseev, 1989)
- Ochlerotatus (Rusticoidus) lepidonotus (Edwards, 1920)
- Ochlerotatus (Rusticoidus) quasirusticus (Torres Cafiamares, 1951)
- Ochlerotatus (Rusticoidus) refiki (Medschid, 1928)
- Ochlerotatus (Rusticoidus) rusticus (Rossi, 1790)
- Ochlerotatus (Rusticoidus) rusticus var. subtrichurus (Martini, 1927)
- Ochlerotatus (Rusticoidus) subdiversus (Martini, 1926)
- Untergattung Woodius (Reinert, Harbach & Kitching, 2009)
- Ochlerotatus (Woodius) diantaeus (Howard, Dyar & Knab, 1913)
- Ochlerotatus (Woodius) intrudens (Dyar, 1919)
- Unbeschriebene Untergattung
- Ochlerotatus annulipes (Meigen, 1830)
- Ochlerotatus behningi (Martini, 1926)
- Ochlerotatus berlandi (Seguy, 1921)
- Ochlerotatus cantans cantans (Meigen, 1818)
- Ochlerotatus cantans var. subvexans (Martini, 1922)
- Ochlerotatus caspius (Pallas, 1771)
- Ochlerotatus caspius ssp. meirai (Ribeiro, Ramos, Capela & Pires, 1980)
- Ochlerotatus caspius var. hargreavesi (Edwards, 1920)
- Ochlerotatus cataphylla (Dyar, 1916)
- Ochlerotatus coluzzii (Rioux, Guilvard & Pasteur, 1998)
- Ochlerotatus communis (de Geer, 1776)
- Ochlerotatus cyprius (Ludlow, 1920)
- Ochlerotatus dorsalis (Meigen, 1830)
- Ochlerotatus detritus (Haliday, 1833)
- Ochlerotatus duplex (Martini, 1926)
- Ochlerotatus euedes (Howard, Dyar & Knab, 1913)
- Ochlerotatus excrucians (Walker, 1856)
- Ochlerotatus flavescens (Mueller, 1764)
- Ochlerotatus hexodontus (Dyar, 1916)
- Ochlerotatus hungaricus (Mihalyi, 1955)
- Ochlerotatus impiger (Walker, 1848)
- Ochlerotatus leucomelas (Meigen, 1804)
- Ochlerotatus nigrinus (Eckstein, 1918)
- Ochlerotatus nigripes (Zetterstedt, 1838)
- Ochlerotatus pionips (Dyar, 1919)
- Ochlerotatus pulcritarsis (Rondani, 1872)
- Ochlerotatus pullatus (Coquillett, 1904)
- Ochlerotatus punctodes (Dyar, 1922)
- Ochlerotatus riparius (Dyar & Knab, 1907)
- Ochlerotatus sticticus (Meigen, 1838) „Auwaldmücke“ (früher Aedes stricticus)
- Ochlerotatus surcoufi (Theobald, 1912)
- Ochlerotatus thibaulti (Dyar & Knab, 1910)
- Untergattung Ochlerotatus (Lynch Arribálzaga, 1891)
- Gattung Psorophora Robineau-Desvoidy, 1827
- Gattung Verrallina (Theobald, 1903)
- Verrallina harbachius
- Verrallina neomacleaya
- Verrallina verrallina
- Gattung Zeugnomyia (Leicester, 1908)
- Gattung Acartomyia (Theobald, 1903)
- Tribus Culicini
- Gattung Culex
- Culex pipiens „Gemeine Stechmücke“ oder „Nördliche Hausmücke“
- Culex pipiens molestus „Eigenständige Form der Gemeinen Stechmücke“
- Culex quinquefasciatus „Südliche Hausmücke“
- Culex modestus
- Gattung Culex
- Tribus Culisetini
- Gattung Culiseta
- Culiseta annulata „Ringelmücke“ oder „Große Hausmücke“
- Culiseta morsitans
- Gattung Culiseta
- Tribus Mansoniini
- Gattung Mansonia
- Gattung Coquillettidia (Dyar, 1905)
- Coquillettidia richiardii (Ficalbi, 1889)
- Tribus Sabethini
- Gattung Sabethes
- Gattung Wyeomyia
Siehe auch
- andere blutsaugende Mücken: Kriebelmücken, Sandmücken und Gnitzen
- weitere blutsaugende Fliegen: Tsetsefliegen, Bremsen, Lausfliegen und einige echte Fliegen
- Stechmückenbekämpfung
- Kommunale Arbeitsgemeinschaft zur Bekämpfung der Schnakenplage
- Mückenatlas
Literatur
- N. Becker u. a.: Mosquitoes and their Control. Kluwer Academic/ Plenum Publishers. New York/ Boston u. a. 2003, ISBN 0-306-47360-7.
- Heiko Bellmann, Klaus Honomichl, Werner Jacobs, M. Renner: Biologie und Ökologie der Insekten: Ein Taschenlexikon. 4., überarbeitete Auflage. Elsevier Spektrum-Akademischer Verlag, Heidelberg 2007, ISBN 978-3-8274-1769-5.
- M. Chinery: Pareys Buch der Insekten. Kosmos, Stuttgart 2004, ISBN 3-440-09969-5.
- J. D. Gillett: The Mosquito: Its Life, Activities and Impact on Human Affairs. Doubleday, Garden City 1972, ISBN 0-385-01179-2.
- W. Lechthaler: Culicidae – Key to Larvae, Pupae and Males from Central and Western Europe. Bestimmungssoftware auf CD-ROM. Eutaxa-Eigenverlag, 2005, ISBN 3-9501839-2-2.
- E. Martini: Über Stechmücken, besonders deren europäische Arten und ihre Bekämpfung. Barth, Leipzig 1920.
- Werner Mohrig: Die Culiciden Deutschlands. Untersuchungen zur Taxonomie, Biologie und Ökologie der einheimischen Stechmücken (= Parasitologische Schriftenreihe. Heft 18). G. Fischer, Jena 1969.
- F. Peus: Stechmücken. (= Die Neue Brehm – Bücherei. Band 22). Westarp-Wissenschaften-Verlagsgesellschaft, Hohenwarsleben 2003, ISBN 3-89432-516-X (Nachdruck der Auflage von 1951).
- A. Rose, M. Geier: Warum es nützt, den Feind zu locken: Stechmücken in die Irre geführt. Stechmücken als Krankheitsüberträger. In: W. Fürst, J. Bauernschmitt (Hrsg.): Biotechnologie in Bayern. Media Mind, München 2004, S. 64–68 (Volltext als PDF-Datei 145 kB).
- F. Schaffner u. a.: The Mosquitoes of Europe/ Les Moustiques d’Europe. Bestimmungssoftware auf CD-ROM. IRD Éditions, Paris & EID Méditeranée, Montpellier 2001, ISBN 2-7099-1485-9.
- A. Spielman, Michael D’Antonio: Mosquito: A Natural History of Our Most Persistent and Deadly Foe. Hyperion Press, New York 2001, ISBN 0-7868-6781-7.
- R. Réaumur: Die Stechmücken. In: J. Soentgen, M. Schweiger (Hrsg.): René-Antoine Ferchault de Réaumur 1683-1757: Insekten. Eine Auswahl. Übersetzt und zusammengestellt von Friedrich Koch. Universität Augsburg, Augsburg 2014, S. 64–85 (PDF-Datei; 1987 kB)
Weblinks
- Institut für Medizinische Parasitologie der Universität Bonn, 31. Dezember 2001, apug.de: Mögliche Auswirkungen von Klimaveränderungen auf die Ausbreitung von primär humanmedizinisch relevanten Krankheitserregern über tierische Vektoren sowie auf die wichtigen Humanparasiten in Deutschland (zu Culicidae und deren Vektorfunktion ab S. 61; PDF-Datei; 3,43 MB)
- biologie.uni-regensburg.de: Von Stechmücken übertragene Infektionskrankheiten: ein Überblick.
- Christiane Knoll, Michael Lange, Gudrun Fischer: Mensch gegen Mücke – Der Kampf geht in die nächste Runde, Deutschlandfunk, Wissenschaft im Brennpunkt vom 28. Februar 2016.
- e-m-b.org: European Mosquito Bulletin
- hydro-kosmos.de: Stechmücken und ihre Lieblingsgewässer
- Walter Reed Biosystematics Unit (WRBU), mosquitocatalog.org: Systematic Catalog of Culicidae. Datenbank der Mückenarten der Welt (englisch)
- Das Projekt mueckenatlas.de kartografiert mithilfe privater Zusendungen die Verbreitung der Stechmückenarten in Deutschland.
Einzelnachweise
- Ulrich Ammon, Hans Bickel, Jakob Ebner, Ruth Esterhammer u. a.: Variantenwörterbuch des Deutschen. Die Standardsprache in Österreich, der Schweiz und Deutschland sowie in Liechtenstein, Luxemburg, Ostbelgien und Südtirol. de Gruyter, Berlin/ New York 2004, ISBN 3-11-016574-0.
- Systema Dipterorum: Catalogue of Life. In: Catalogue of Life - indexing the world's known species. Naturalis Biodiversity Center, 30. Juni 2018, abgerufen am 22. Juli 2018 (englisch).
- Culicidae bei Fauna Europaea
- Guoli Zhou u. a.: Fate of blood meal iron in mosquitoes. In: Journal of Insect Physiology. Band 53, Nr. 11, 2007, S. 1169–1178.
- G. O. Poinar u. a.: Paleoculicis minutus (Diptera: Culicidae) n. gen., n. sp., from Cretaceous Canadian amber with a summary of described fossil mosquitoes. In: Acta Geologica Hispanica. Nr. 35, 2000, S. 119–128. PDF 177 kB
- A. Borkent, D. A. Grimaldi: The earliest fossil mosquito (Diptera: Culicidae) in Mid-Cretaceous Burmese amber. In: Annals of the Entomological Society of America. Band 97, Nr. 5, 1 September 2004, S. 882–888 ((Abstract)).
- Jacob Grimm, Wilhelm Grimm: Deutsches Wörterbuch. digitalisierte Fassung im Wörterbuchnetz des Trier Center for Digital Humanities, Version 01/21; Auf: woerterbuchnetz.de, abgerufen am 15. Mai 2021.
- Leopoldo M. Rueda: Global diversity of mosquitoes (Insecta: Diptera: Culicidae) in freshwater. In: Hydrobiologia. 2008, Band 595, S. 477–487, doi:10.1007/s10750-007-9037-x.
- Vincent Robert, Filiz Günay, Gilbert Le Goff et alt.: Distribution chart for Euro-Mediterranean mosquitoes (western Palaearctic region). In: Journal of the European Mosquito Control Association. 2019, Band 37, S. 1–28.
- Af hverju lifa ekki moskítóflugur á Íslandi, fyrst þær geta lifað báðum megin á Grænlandi? Abgerufen am 5. Juli 2021 (isländisch).
- Andrew K. Dickerson, Peter G. Shankles, Nihar M. Madhavan, David L. Hua: Mosquitoes survive raindrop collisions by virtue of their low mass. In: Proceedings of the National Academy of Sciences. 4. Juni 2012, doi:10.1073/pnas.1205446109
- Heftige Kollision Regentropfen können einer Mücke nichts anhaben. In: Spiegel Online. 5. Juni 2012.
- YouTube: Can mosquitoes fly in the rain? 20. Oktober 2011 (2:55 min)
- U. S. Jhumur, S. Dötterl, A. Jürgens: Floral Odors of Silene otites: Their Variability and Attractiveness to Mosquitoes. In: Journal of Chemical Ecology Nr. 34, 2008, S. 14–25, doi:10.1007/s10886-007-9392-0.
- Becker u. a.: Mosquitoes and their control. Springer, 2003, ISBN 0-306-47360-7.
- E. Roubaud: Cycle autogène d ’attente et générations hivernales suractives inapparentes chez le moustique commun. Culex pipiens L. In: Comptes rendus de l'Académie des Sciences. Nr. 188, Paris 1929, S. 735–738.
- T. Su, M. S. Mulla: Physiological Aspects of Autogeny in Culex tarsalis. (Diptera: Culicidae): Influences of Sugar-feeding, Mating, Body Weight, and Wing Length. In: Journal of Vector Ecology. Band 22, Nr. 2, 1997, S. 115–121.
- B. Steib u. a.: The effect of lactic acid on odor related host preference of yellow fever mosquitoes. In: Chemical Senses. Nr. 26, 2001, S. 523–528.
- M. Geier u. a.: Influence of odour plume structure on upwind flight of mosquitoes towards hosts. In: Journal of Experimental Biology. Nr. 202, 1999, S. 1639–1648.
- U. Kröckel u. a.: New tools for surveillance of adult yellow fever mosquitoes: Comparison of trap catches with human landing rates in an urban environment. In: Journal of the American Mosquito Control Association. Nr. 22, 2006, S. 229–238.
- M. Cabrera, K. Jaffe: An aggregation pheromone modulates lekking behaviour in the vector mosquito Aedes aegypti (Diptera: Culicidae). In: Journal of the American Mosquito Control Association. 2007, Band 23, Nr. 1, S. 1–10.
- G. Gibson, I. Russel: Flying in tune: sexual recognition in mosquitoes. In: Current Biology. Band 16, Nr. 13, 2006, S. 1311–1316.
- Veterinärmedizinische Universität Wien: Epidemiologie. (Memento vom 28. März 2010 im Webarchiv archive.today) Zugriff 20. Oktober 2008.
- M. Laine, R. Luukkainen, A. Toivanen: Sindbis viruses and other alphaviruses as cause of human arthritic disease (review). In: Journal of Internal Medicine. Band 256, Nr. 6, 2004, S. 457–471.
- Ulrich Kuch (Biodiversität und Klima Forschungszentrum): Klimawandel und Mücken-übertragene Infektionskrankheiten in Deutschland. Vortrag auf der Tagung Klimawandel und Biodiversität - Folgen für Deutschland. (Memento vom 10. August 2014 im Webarchiv archive.today) Auf: bik-f.de, Mai 2011 (Volltext als PDF-Datei).
- Wolfgang Hemmer: Insekten als Auslöser allergischer Reaktionen. In: Horst Aspöck (Hrsg.): Krank durch Arthropoden. - Denesia 30. Oberösterreichische Landesmuseen, 2010, ISSN 1608-8700, S. 396–398.
- Jan Kedves: Süddeutsche Zeitung - Juckt mich nicht. Abgerufen am 20. Oktober 2020.
- Christian Mueller, Grossjohann, Fischer: The use of concentrated heat after insect bites/stings as an alternative to reduce swelling, pain, and pruritus: an open cohort-study at German beaches and bathing-lakes. In: Clinical, Cosmetic and Investigational Dermatology. Band 2011, Dezember 2011, ISSN 1178-7015, S. 191–196, doi:10.2147/CCID.S27825, PMID 22253544, PMC 3257884 (freier Volltext) – (dovepress.com [abgerufen am 26. Mai 2019]).
- Moskitos töten nach Hurrikan in USA Hunderte Rinder orf.at, 12. September 2020, abgerufen 12. September 2020.
- H. Quiroz-Martínez, A. Rodriguez-Castro: Aquatic insects as predators of mosquito larvae. In: AMCA Bulletin. Band 23, Nr. 7, 2007, S. 110–117.
- Anna Kästel, Stefanie Allgeier, Carsten A. Brühl: Decreasing Bacillus thuringiensis israelensis sensitivity of Chironomus riparius larvae with age indicates potential environmental risk for mosquito control. In: Scientific Reports. Band 7, Nr. 1, 19. Oktober 2017, Artikel Nr. 13565, ISSN 2045-2322, doi:10.1038/s41598-017-14019-2.
- Renbete och biologisk mångfald – kunskapssammanställning. (Memento vom 13. August 2014 im Internet Archive) Auf: lansstyrelsen.se
- Alan Weisman: Die Welt ohne uns. Reise über eine unbevölkerte Erde. Piper, München 2007, ISBN 978-3-492-05132-3.
- John M. Marshall: The Cartagena Protocol and genetically modified mosquitoes. In: Nature Biotechnology. Band 28, Nr. 9, September 2010, S. 896–897.