Ethylencarbonat
Ethylencarbonat, korrekt auch als 1,3-Dioxolan-2-on bezeichnet, ist eine farblose und fast geruchlose, bei Raumtemperatur feste Verbindung.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
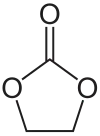 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Ethylencarbonat | |||||||||||||||
| Andere Namen | ||||||||||||||||
| Summenformel | C3H4O3 | |||||||||||||||
| Kurzbeschreibung |
farblose Kristalle[2] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 88,06 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte |
1,32 g·cm−3 (40 °C)[3] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
248 °C (Zersetzung)[3] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Brechungsindex |
1,4148 (50 °C)[4] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
−508,4 kJ/mol (g)[6] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Synthese
Ethylencarbonat 2 ist als cyclischer Ester aus Kohlensäure und Ethylenglycol aufzufassen, wird aber aus Ethylenoxid 1 und Kohlenstoffdioxid (CO2) hergestellt, als Katalysatoren finden dabei in der Industrie quartäre Ammoniumsalze Verwendung, im Labor auch Aluminium-Porphin-Komplexe oder bis-(Triphenylphosphin)-nickel(0)[7]. Letztere gestatten die Addition von Kohlenstoffdioxid auch unter sehr milden Bedingungen durchzuführen:[8][9]
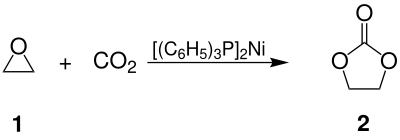
2007 wurde von Shell der besonders elegante OMEGA-Prozess patentiert, in dem in Wasser Ethylencarbonat aus Ethylenoxid hergestellt und in der gleichen Anlage zu Ethylenglycol hydrolysiert wird. Dieser Weg vermeidet die bei der direkten Ringöffnung von Ethylenoxid praktisch unvermeidliche Bildung von Oligomeren.
Industriell kann aus jedem Epoxid bzw. Epoxidharz das entsprechende Carbonat hergestellt werden, indem bei ca. 80 °C Kohlendioxid mit 2–6 bar auf die gerührte Oberfläche einer Epoxidlösung in Toluol oder Xylol gepresst wird.
Eigenschaften
Cyclische Carbonate bilden bei ca. 120 °C mit Glycolen oder anderen hochsiedenden Alkoholen offenkettige Carbonate.
Cyclische Carbonate bilden bei ca. 80 °C mit Aminen offenkettige Urethane. Primäre Amine sind dabei wesentlich reaktiver als sekundäre.
Ethylencarbonat hat einen Flammpunkt von 143 °C.[3]
Verwendung
Ethylencarbonat wird in der chemischen Industrie als Ausgangsstoff für Synthesen und als Lösungsmittel bei höheren Temperaturen verwendet. So dient es als
- Hochtemperatur-Lösungsmittel bei der Verspinnung von Polynitril-Fasern
- Ausgangsprodukt für die Synthese von Oxazolidinonen, Imidazolidonen, Pyrimidinen und Purinen
- Komponente in Elektrolytlösungen für Lithium-Batterien
- preiswertes Reagenz zur Einführung von 2-Hydroxyethylierung bei Aminen, Amiden und Phenolen[10][11]
Risikobewertung
Ethylencarbonat wurde 2015 von der EU gemäß der Verordnung (EG) Nr. 1907/2006 (REACH) im Rahmen der Stoffbewertung in den fortlaufenden Aktionsplan der Gemeinschaft (CoRAP) aufgenommen. Hierbei werden die Auswirkungen des Stoffs auf die menschliche Gesundheit bzw. die Umwelt neu bewertet und ggf. Folgemaßnahmen eingeleitet. Ursächlich für die Aufnahme von Ethylencarbonat waren die Besorgnisse bezüglich Verbraucherverwendung, Exposition von Arbeitnehmern, hoher (aggregierter) Tonnage, anderer gefahrenbezogener Bedenken und weit verbreiteter Verwendung sowie der möglichen Gefahr durch reproduktionstoxische Eigenschaften. Die Neubewertung fand ab 2018 statt und wurde von Lettland durchgeführt. Anschließend wurde ein Abschlussbericht veröffentlicht.[12][13]
Siehe auch
Einzelnachweise
- Eintrag zu ETHYLENE CARBONATE in der CosIng-Datenbank der EU-Kommission, abgerufen am 12. Dezember 2021.
- Eintrag zu 1,3-Dioxolan-2-on. In: Römpp Online. Georg Thieme Verlag, abgerufen am 1. Oktober 2014.
- Datenblatt Ethylencarbonat (PDF) bei Merck, abgerufen am 19. Januar 2011.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-244.
- Eintrag zu Ethylencarbonat in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2018. (JavaScript erforderlich)
- CRC-Handbook 9. Aufl. (2009–2010), S. 5–23 (Memento vom 26. April 2015 im Internet Archive). - Vergleich mit Propylencarbonat: Ethylencarbonat-Wert müßte im Bereich -523 ... -525 kJ/mol liegen, Wert -503±4 kJ/mol bei NIST ebenfalls zu niedrig, siehe hierzu Eintrag zu Ethylencarbonat. In: P. J. Linstrom, W. G. Mallard (Hrsg.): NIST Chemistry WebBook, NIST Standard Reference Database Number 69. National Institute of Standards and Technology, Gaithersburg MD, abgerufen am 22. März 2010..
- Leffel, J. , & Co, Louis Frederick Fieser, Mary Fieser: Fiesers' Reagents for Organic Synthesis, Volume 4. Wiley, 1967, ISBN 978-0-471-25881-0, S. 41 (books.google.de).
- Takuzo Aida, Shohei Inoue: Activation of carbon dioxide with aluminum porphyrin and reaction with epoxide. Studies on (tetraphenylporphinato)aluminum alkoxide having a long oxyalkylene chain as the alkoxide group. In: Journal of the American Chemical Society. 105, 1983, S. 1304–1309, doi:10.1021/ja00343a038.
- Carmen Martín, Giulia Fiorani, Arjan W. Kleij: Recent Advances in the Catalytic Preparation of Cyclic Organic Carbonates. In: ACS Catalysis 5, 2015, S. 1353–1370, doi:10.1021/cs5018997.
- Patent WO 2007088514 A1. - WO 2011089385 A1
- John H. Clements: Reactive Applications of Cyclic Alkylene Carbonates. In: Industrial & Engineering Chemistry Research. 42, 2003, S. 663–674, doi:10.1021/ie020678i.
- Europäische Chemikalienagentur (ECHA): Substance Evaluation Conclusion and Evaluation Report.
- Community rolling action plan (CoRAP) der Europäischen Chemikalienagentur (ECHA): ethylene carbonate, abgerufen am 1. Mai 2020.
