Fischer-Tropsch-Synthese
Die Fischer-Tropsch-Synthese (auch Fischer-Tropsch-Verfahren, kurz FT-Synthese) ist ein großtechnisches Verfahren zur Herstellung von Kohlenwasserstoffen aus Synthesegas, einem Gemisch aus Kohlenstoffmonoxid und Wasserstoff. Die deutschen Chemiker Franz Fischer und Hans Tropsch entwickelten das Verfahren am Kaiser-Wilhelm-Institut für Kohlenforschung in Mülheim an der Ruhr und meldeten es 1925 zum Patent an. Die Reaktionen finden in Gegenwart von Metallkatalysatoren, Temperaturen von etwa 150 bis 300 °C und Drücken bis etwa 25 bar statt. Als industrielle Katalysatoren dienen Kontakte auf Basis von Cobalt oder Eisen.
 Franz Fischer (1911) |
 Hans Tropsch |
Neben Kohle stehen Erdgas, Erdöl oder Biomasse als Rohstoffquellen für die Synthesegaserzeugung zur Verfügung. Als Produkte entstehen flüssige, schwefelarme synthetische Kraftstoffe wie Dieselkraftstoff und synthetische Motoröle. Anfallende längerkettige Kohlenwasserstoffe, sogenannter Paraffingatsch, dient als Rohstoffbasis für die chemische Industrie oder als Fischer-Tropsch-Wachs als Hilfsmittel in der Klebstoffindustrie, für Beschichtungen oder in der Polymerverarbeitung. Als Nebenprodukte fallen sauerstoffhaltige Kohlenwasserstoffe wie Ethanol und Aceton sowie Ethen, Propen und höhere Olefine sowie Alkohole an. Koppelprodukte des Prozesses sind Wasser und Kohlenstoffdioxid. Die Produktpalette der Fischer-Tropsch-Synthese lässt sich durch Reaktionsparameter, die Art des Reaktors und des Katalysators steuern.
Im Zuge der nationalsozialistischen Autarkiepolitik erlangte die Fischer-Tropsch-Synthese eine große wirtschaftliche Bedeutung in Deutschland, da sie zur Deckung des Bedarfs an flüssigen Kraft- und Schmierstoffen sowie zur Bereitstellung von Chemierohstoffen auf Basis der einheimischen Kohle beitrug. In Südafrika errichtete die Firma Sasol ab Mitte der 1950er Jahre große Fischer-Tropsch-Anlagen, die Synthesegas aus südafrikanischer Kohle zu Motorenbenzin und Grundstoffen für die chemische Industrie weiterverarbeiten. In Malaysia und Katar liefern moderne Fischer-Tropsch-Anlagen flüssige Kraftstoffe aus Erdgas.
Geschichte
Erste Arbeiten

Die ersten Arbeiten zur Hydrierung von Kohlenstoffmonoxid mit Wasserstoff führten Paul Sabatier und Jean Baptiste Senderens im Jahr 1902 durch.[1] Mit Nickel- und Cobalt-Katalysatoren erhielten sie bei atmosphärischem Druck und Temperaturen zwischen 200 und 300 °C Wasser und Methan als Hauptprodukte. Der Prozess hätte den Heizwert von Stadtgas erhöht und das darin enthaltene giftige Kohlenstoffmonoxid vermieden, setzte sich aber aus Kostengründen nicht durch.[2] Sabatier erhielt 1912 den Nobelpreis für Chemie für seine Arbeiten zur Hydrierung.[3]
Die BASF meldete im Jahr 1913 ein Patent an, das die Produktion von gesättigten und ungesättigten aliphatischen Kohlenwasserstoffen mittels Hydrierung von Kohlenstoffmonoxid bei einem Druck von etwa 100 bar und Temperaturen von 400 °C unter Verwendung von Nickel-, Cobalt-, Zink- und weiteren Metallen oder deren Oxiden als Katalysatoren beschrieb.[4]
Franz Fischer, Gründungsdirektor des 1912 errichteten Kaiser-Wilhelm-Institut für Kohlenforschung in Mülheim an der Ruhr, dessen Unterhalt zum großen Teil von der Steinkohlen-Industrie aufgebracht wurde, setzte seinen Forschungsschwerpunkt zu Beginn der 1920er Jahre auf die Verwertung von Kokereigas. Dabei handelt es sich um ein Gemisch aus Wasserstoff, Methan, Stickstoff und Kohlenstoffmonoxid, das bei der Verkokung der Kohle anfiel und der Schwerindustrie im Überschuss zur Verfügung stand.
Zusammen mit Hans Tropsch entwickelte er 1921 ein auf alkalisierten eisenhaltigen Katalysatoren basierendes Verfahren zur Herstellung von Gemischen aus sauerstoffhaltigen Verbindungen aus Synthesegas, das sogenannte Synthol-Verfahren.[5] Bei einem Druck von 100 bis 150 bar und einer Temperatur von etwa 400 °C erhielten sie Mischungen von Aldehyden, Ketonen, Carbonsäureestern, Alkoholen und Carbonsäuren, sogenanntes Synthol.
Im darauf folgenden Jahr gelang dem Chemiker Matthias Pier die großtechnische Herstellung von Methanol durch Hydrierung von Kohlenstoffmonoxid im Hochdruckverfahren an mit alkalifreien Zinkoxid-Chromoxid-Katalysatoren. Da die Gegenwart von Eisen zur Methanbildung führte, wurden die Reaktoren mit Kupfer ausgekleidet. Die Verwendung alkalisierter Kontakte lieferte höhere Alkohole, vor allem Isobutanol. Durch diese Erfolge fokussierte die BASF ihre Forschung zur Kohlenstoffmonoxidhydrierung auf die Methanolherstellung und die Isobutylölsynthese.[6][7]
Arbeiten am Kaiser-Wilhelm-Institut für Kohlenforschung
Der Mangel an Erdöl und der damit verbundene Engpass in der Kraftstoffversorgung während des Ersten Weltkriegs löste im Deutschen Reich eine politisch und militärisch motivierte Suche nach alternativen Lösungen aus, vor allem auf Basis der einheimischen Kohle.
Fischer beauftragte Otto Roelen, der als Assistent von Tropsch bereits seit 1921 zum Mülheimer Institut gehörte, ab 1924 zunächst mit der weiteren Untersuchung des Syntholverfahrens. Nachdem sich die damit hergestellten sauerstoffhaltigen Gemische als untauglich für die Verwendung als Motorkraftstoff erwiesen hatten, änderte Tropsch die Reaktionsbedingungen und führte die Versuche unter Normaldruck durch. Obwohl zu Beginn nur geringe Ausbeuten erzielt wurden, führten die Arbeiten von Fischer, Tropsch und Roelen schließlich zur technischen Herstellung von aliphatischen Kohlenwasserstoffen unter Verwendung von Cobalt- oder Eisenkatalysatoren.[8]
Großtechnisches Verfahren
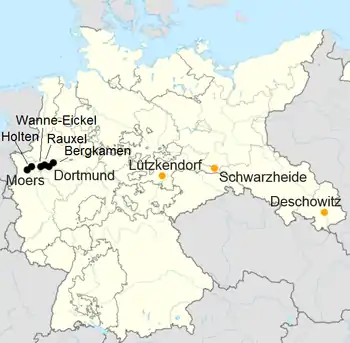
Während des Zweiten Weltkriegs erlangte die FT-Synthese (kriegs-)wirtschaftliche Bedeutung in Deutschland. Mit ihr konnte der Bedarf an flüssigen Kraftstoffen, sogenanntes Kogasin, wie das Syntheseprodukt nach seiner Herstellungsfolge aus Koks, Gas, Benzin, genannt wurde, aus einheimischer Kohle gedeckt werden.[9] Insgesamt errichtete die chemische Industrie bis zum Ende des Zweiten Weltkriegs neun Anlagen, die mit der FT-Synthese arbeiteten und eine Kapazität von 0,6 Mio. t/a hatten.
Da die Fischer-Tropsch-Kraftstoffe eine niedrige Oktanzahl aufwiesen, baute die nationalsozialistische Wirtschaftsführung stattdessen mehr Hydrieranlagen nach dem Bergius-Pier-Verfahren, die ein höherwertiges Motorenbenzin lieferten; Paraffingatsch wurde schwer erhältlich. Erst ab 1940 steigerten die Fischer-Tropsch-Anlagen ihren Ausstoß erheblich, was zu einer guten Versorgung mit Gatsch führte. Auf Veranlassung von Imhausen ließ der Kommissar für Wirtschaftsfragen Wilhelm Keppler die Fischer-Tropsch-Anlagen auf das Mitteldruckverfahren umstellen, das eine höhere Ausbeute an Paraffingatsch lieferte.
Ein Verfahren von Arthur Imhausen nutzte die höhermolekulare Fraktion, das Paraffingatsch, zur Fettsäuresynthese durch Paraffinoxidation.[10] Die Fettsäuren wurden als Rohstoff im Unternehmen Märkische Seifenindustrie eingesetzt, ab dem Jahr 1939 jedoch auch zur Herstellung eines synthetischen Speisefetts verwendet.[11]
| Standort | Betreiber | Einsatzstoff | Produktionskapazität 1943/44 in Tonnen pro Jahr |
| Holten | Ruhrchemie | Steinkohle | 60.000 |
| Rauxel | Gewerkschaft Victor | Steinkohle | 40.000 |
| Wanne-Eickel | Krupp | Steinkohle | 55.000 |
| Bergkamen | Essener Steinkohlenbergwerke | Steinkohle | 85.000 |
| Dortmund | Hoesch | Steinkohle | 55.000 |
| Moers | Rheinpreußen | Steinkohle | 75.000 |
| Schwarzheide | BRABAG | Braunkohle | 180.000 |
| Lützkendorf | Mitteldeutsche Treibstoff- und Oelwerke A.G. | Braunkohle | 30.000 |
| Deschowitz | Schaffgotsch Benzin GmbH | Braunkohle | 40.000 |
| Summe aller FT-Anlagen | 620.000 | ||
Nachkriegszeit
Mit erdölbasierten Kraftstoffen waren die Produkte der FT-Synthese nie konkurrenzfähig, so dass die Industrie das Verfahren nach dem Krieg nahezu vollständig aufgab. Die Anlagen wurden gemäß dem Washingtoner Beschluss der Westmächte demontiert.[13] Nach der Ölkrise wurde die Forschung in den 1970er Jahren jedoch wieder aufgenommen und in Bottrop eine Pilotanlage errichtet. Diese wurde bereits Ende der 1980er Jahre wieder eingestellt, da sich die Produktion nur rentierte, wenn der Benzinpreis über 2,30 Deutsche Mark lag.[14]
Verfahren der Sasol

In der Republik Südafrika, die ebenfalls über ausreichend Kohleressourcen verfügte und Erdöl importieren musste, wurde aus politischen Gründen 1955 die erste moderne Coal-to-Liquid (CtL)-Anlage Südafrikas in Betrieb genommen. Gebaut wurde sie durch die eigens gegründete Suid Afrikaanse Steenkool en Olie (Sasol) unter Beteiligung der deutschen Lurgi AG. Die Pilotanlage Sasol 1 wurde für etwa 6.000 Barrel Kraftstoff pro Tag ausgelegt. Ab 1980 wurden die Kapazitäten bedingt durch die politische Entwicklung Südafrikas deutlich ausgeweitet.
So nahm die Sasol 1980 und 1982 Sasol II und Sasol III in Betrieb.[10] Damit stand eine Gesamtkapazität von 104.000 Barrel/Tag zur Verfügung. Mit der politischen Öffnung wurde das Programm auf Erdgas als Rohstoffquelle ausgedehnt, 1995 und 1998 schuf Sasol weitere Kapazitäten für 124.000 Barrel/Tag CtL- und GtL-Kraftstoff (Gas-to-Liquid). Da die Steinkohle im Tagebau relativ preisgünstig gewonnen werden kann, deckte das Land noch 2006 etwa 40 % seines Kraftstoffbedarfs aus Kohlebenzin.[15]
Sasol wurde durch die südafrikanischen Entwicklungen Weltmarktführer auf dem Gebiet der XtL-Technologien und baute 2006 in Katar ein modernes GtL-Werk mit einer Kapazität von 34.000 Barrel/Tag. Dabei handelt es sich um ein Hochtemperaturverfahren mit Prozesstemperaturen von 350 °C (Synthol und Advanced Synthol), bei dem Ottokraftstoffe und Alkene als Plattformchemikalien produziert werden. Gemeinsam mit Foster Wheeler plante Sasol zudem eine Fischer-Tropsch-Anlage in China. Diese Anlage mit einer Jahreskapazität von 60.000 Barrel verwendet ein Niedrigtemperaturverfahren mit 250 °C und dient der Gewinnung von Dieselkraftstoff und Wachsen.
Rohstoffwende
1993 nahm der Mineralölkonzern Royal Dutch Shell seine erste GtL-Anlage in Betrieb. Die Anlage in Bintulu in Malaysia hat eine Kapazität von 12.000 Barrel/Tag und wird in einem eigens entwickelten Fischer-Tropsch-Verfahren, der Shell Middle Distillate Synthesis (SMDS-Verfahren), betrieben. Gemeinsam wollen Shell und Sasol weitere GtL-Kapazitäten von etwa 60.000 Barrel GtL/Tag aufbauen.
Die USA verfügen über große, dicht an der Oberfläche liegende Kohleflöze, die relativ leicht im Tagebau abgebaut werden können. Die United States Air Force testete angesichts gestiegener Treibstoffpreise bei gleichzeitig hohem Bedarf am 19. September 2006 auf der Edwards Air Force Base eine Boeing B-52H mit einem 50:50-Gemisch aus gewöhnlichem JP-8-Treibstoff und synthetisch aus Kohle gewonnenem Treibstoff.[16] Der Testflug sollte die Frage klären, wie sich dieser Treibstoff in der Praxis bewährt und ob ein wirtschaftlicher Betrieb zuverlässig möglich ist. Ein begleitendes Forschungsprojekt kam zu dem Schluss, dass Fischer-Tropsch-Kraftstoffe eine Alternative als Quelle von JP-8 für die US Air Force bietet.[17]
Im Zuge der Rohstoffwende rückten vor allem Biokraftstoffe in den Fokus der Kraftstoffherstellung. Dabei erhielt die Fischer-Tropsch-Synthese erneut das Interesse von Forschung und Entwicklung. Zwar werden Biomass to Liquid-Kraftstoffe besonders in Europa als Biokraftstoffe der zweiten Generation gefördert, jedoch wurde noch keine BtL-Produktion in Betrieb genommen. Einzelne Pilotprojekte sind angelaufen, die mittlerweile insolventen Choren Industries wollten in einem Werk in Freiberg, Sachsen, den von ihnen als SunFuel und SunDiesel bezeichneten BtL-Kraftstoff herstellen.[18]
Verfahren
Die Kapazität der drei auf Kohle basierenden Fischer-Tropsch-Anlagen der Sasol in Südafrika betrug 2001 etwa 7.500.000 Tonnen pro Jahr. Die Anlagen produzieren Chemikalien, lineare Olefine, Motorenbenzin, Diesel und Wachse. Die Kapazität der Mossgas-Anlage in Südafrika, die Methan als Rohstoff einsetzt, betrug 2001 etwa 1.020.000 Tonnen pro Jahr. Typische Produkte sind Motorenbenzin und Diesel. Weitere Anlagen sind in Malaysia, Nigeria und Qatar in Betrieb.[19]
Die Katalysatoren für industrielle Fischer-Tropsch-Anlagen basieren auf Cobalt oder Eisen. Kohle oder andere wasserstoffarme Rohstoffe werden bevorzugt mit Eisen-basierenden Katalysatoren hergestellt, da diese gleichzeitig die Wassergas-Shift-Reaktion katalysieren und so helfen, den notwendigen Wasserstoff bereitzustellen.[20]
Die Bereitstellung von gereinigtem Synthesegas ist meist der aufwändigste Teilprozess einer Fischer-Tropsch-Anlage. Dessen erwünschte Zusammensetzung ist wiederum bestimmt durch die zu produzierenden Produkte. Die Zusammensetzung bestimmt wiederum die Wahl des Katalysators. Die Gesamtgleichung der Cobalt-katalysierten Fischer-Tropsch-Synthese lässt sich durch die folgenden Reaktionsgleichung darstellen:
Die Eisen-katalysierte Reaktionsgleichung lautet:
Kohle als Rohstoff
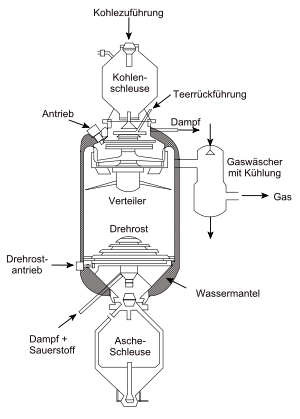
Zur Bereitstellung des Synthesegases für die Fischer-Tropsch-Synthese wurde ursprünglich allein Kohle zunächst bei Temperaturen von über 1000 °C in der Kohlevergasung, zum Beispiel im Lurgi-Druckvergaser, Winkler-Generator oder Koppers-Totzek-Reaktor, mit Wasserdampf und Luft oder Sauerstoff zu Synthesegas umgesetzt. Da bei dieser Umsetzung im ersten Schritt nur ein Wasserstoff-zu-Kohlenstoffmonoxid-Verhältnis von 0,7 erreicht wird, wird ein Teil des Kohlenstoffmonoxids mit Wasser in einer Wassergas-Shift-Reaktion zu Kohlenstoffdioxid und Wasserstoff umgesetzt, bis ein Verhältnis von 2:1 erreicht ist. Das Synthesegas wird abgekühlt, wobei Phenol und Ammoniak abgetrennt werden, und einer Rectisolwäsche unterworfen, wobei Kohlenstoffdioxid, Schwefelwasserstoff, Blausäure und organische Bestandteile entfernt werden.[10] Die Katalysatoren sind schwefelempfindlich, der Schwefelwasserstoffanteil wird meist auf einen Volumengehalt von weniger als 30 ppb herabgesetzt.[10] Das Reingas enthält noch etwa 12 % Methan, Ethan, Stickstoff und Edelgase sowie etwa 86 % Kohlenstoffmonoxid und Wasserstoff im Verhältnis 1:2.[10]
Erdgas, Biomasse und Abfälle als Rohstoff
Der große Vorteil des Fischer-Tropsch-Prozesses ist, dass jeder energiereiche Rohstoff für den Prozess grundsätzlich geeignet ist. Das sind neben Kohle und Erdgas auch Biogas, Holz, landwirtschaftliche Abfälle oder Haushaltsmüll. Die weltweit erste Anlage zur Nutzung fester Biomasse entstand 2005 in Choren bei Freiberg. 2011 wurde sie insolvent.
2009 erfolgte die allgemeine Zulassung der Fischer-Tropsch-Kraftstoffe (FT-SPK) durch die ASTM als Flugkraftstoff. Im Jahre 2014 bevorzugten Fluggesellschaften, wie British Airways und Cathay Pacific die Herstellung von FT-Kraftstoffen aus Hausmüll und hatten mit dem Aufbau entsprechender Anlagen in London und Hongkong begonnen.[22]
Druck und Temperatur
Das gereinigte Rohgas, das ein Verhältnis von Wasserstoff zu Kohlenstoffmonoxid von etwa 2 bis 2,2 aufweist, wird heterogen-katalytisch in einer Aufbaureaktion zu Kohlenwasserstoffen wie Paraffinen, Olefinen und Alkoholen umgesetzt. Endprodukte sind Benzin (synthetisches Benzin), Diesel, Heizöl sowie Rohstoffe für die chemische Industrie. Die Reaktion findet bereits bei Atmosphärendruck und bei einer Temperatur von 160 bis 200 °C statt; technisch werden je nach Verfahren höhere Drücke und Temperaturen verwendet. Die Synthese verläuft nach folgendem Reaktionsschema:
- (Alkane)
- (Alkene)
- (Alkohole)
Pro Kilogramm Kraftstoff entstehen etwa 1,25 Kilogramm Wasser, für dessen Herstellung etwa die Hälfte des eingesetzten Wasserstoffs verwendet wird. Eisenhaltige Katalysatoren katalysieren die Wassergas-Shift-Reaktion, sodass statt Wasser und dem giftigen Kohlenmonoxid, Kohlenstoffdioxid und Wasserstoff anfallen:[23]
Katalysatoren
In der Fischer-Tropsch-Synthese wird eine Vielzahl von Katalysatoren eingesetzt. Die am häufigsten verwendeten basieren auf den Übergangsmetallen Cobalt, Eisen, Nickel und Ruthenium. Als Träger finden poröse Metalloxide mit großen spezifischen Oberflächen wie Kieselgur, Aluminiumoxid, Zeolithe und Titandioxid Verwendung.[24]
Die Katalysatoren können durch Imprägnierung der porösen Metalloxide mit Metallsalzlösungen und anschließende Kalzinierung hergestellt werden.[25] Die Katalysatoraktivität wird durch Promotoren, dies sind nicht selbst katalytische aktive Katalysatorkomponenten, wie Alkalimetalle oder Kupfer gesteigert. Weiterhin beeinflussen die Porengrößenverteilung des Trägers, die Kalzinierungs- und Reduktionsbedingungen und durch die daraus resultierenden Partikelgrößen des aktiven Katalysatormetalls die katalytische Aktivität. Substanzen wie Alkalimetalle, die für Eisenkatalysatoren gute Promotoren darstellen, wirken etwa bei Cobaltkatalysatoren als Katalysatorgift. Cobalt, Nickel und Ruthenium verbleiben während der Reaktion im metallischen Zustand, während Eisen eine Reihe von Oxiden und Carbiden bildet. Es wird jedoch vermutet, dass Cobaltoxiden, die durch unvollständige Reduktion des eingesetzten Salzes zurückbleiben, eine Promotorenrolle zukommt.
Eisen- und cobalthaltige Katalysatoren werden meist durch Fällung, oft zusammen mit anderen Metallen und sonstigen Promotoren, gewonnen.[26][27] Der ursprüngliche Katalysator von Fischer und Tropsch wurde durch Co-Fällung von Cobalt-, Thorium- und Magnesiumnitrat hergestellt, wobei dem frisch gefällten Katalysator das Kieselgur zugesetzt wurde.[28] Die weiteren Schritte wie Formgebung, Trocknung und Reduktion des Cobaltsalzes beeinflussen die Aktivität des Katalysators maßgeblich. Cobaltkatalysatoren zeigen nur geringe Aktivität in der Wassergas-Shift-Reaktion, während Eisenkatalysatoren diese katalysieren.
Verfahrensführung
Die Verfahrensführung wird bestimmt durch die Notwendigkeit, die große Reaktionswärme von etwa 3000 Kilojoule pro Kubikmeter konvertiertem Synthesegas abzuführen. Die Wärme wird durch Wasser abgeführt, dessen Temperatur durch Einstellen des Drucks geregelt wird. Zu hohe Temperaturen führen zur Methanbildung sowie einer schnellen Verkokung des Katalysators.[23]
Produkte
Das typische Fischer-Tropsch-Produkt enthält rund 10–15 % Flüssiggase (Propan und Butane), 50 % Benzin, 28 % Kerosin, 6 % Weichparaffin (Paraffingatsch) und 2 % Hartparaffine. Das Verfahren ist für die großtechnische Produktion von Benzin und Ölen aus Kohle, Erdgas oder Biomasse von Bedeutung. Die Kettenlängenverteilung der während der Reaktion gebildeten Kohlenwasserstoffe folgt einer Schulz-Flory-Verteilung.[29] Die Kettenlängenverteilung kann durch folgende Gleichung beschrieben werden:
- ,
wobei Wn der Gewichtsanteil der Kohlenwasserstoffmoleküle mit n Kohlenstoffatomen ist und α die Kettenwachstumswahrscheinlichkeit. Im Allgemeinen wird α durch den Katalysator und die spezifischen Prozessbedingungen bestimmt. Durch Variation der Prozessbedingungen und des Designs des Katalysators lässt sich die Selektivität zu verschiedenen Produkten, etwa Olefinen als Rohstoffe für die chemische Industrie, steuern.
Reaktionsmechanismus
Ursprünglich wurde angenommen, dass die Bildung von Kohlenwasserstoffen über die Hydrierung von oberflächengebundenen Metallcarbidspezies abläuft. Durch mechanistische Untersuchungen mit 14C-markiertem Kohlenstoffmonoxid konnte nachgewiesen werden, dass dieser Mechanismus nur einen kleinen Beitrag zur Gesamtreaktion leisten konnte.[30] In der Folgezeit wurden verschiedene Mechanismen vorgeschlagen und untersucht, wobei der Einbau von 14C-markierten Komponenten und die nachfolgende Untersuchung der 14C-Verteilung in den Produkten eine oft angewandte Untersuchungsmethode darstellten.
Der Reaktionsmechanismus lässt sich in die Schritte Chemisorption von Kohlenstoffmonoxid und dissoziative Chemisorption von Wasserstoff, Kettenwachstum, Wasserstoffübertragung, Hydrogenolyse und Desorption unterteilen. Analog zur Hydroformylierung wird angenommen, dass oberflächengebundene Metallcarbonyle Teil des katalytisch aktiven Systems sind. Der Kettenwachstumsschritt könnte über die Bildung von Acylkomplexen und deren anschließende Hydrierung zum Alkylkomplex verlaufen. In die Metall-Alkyl-Bindung könnte ein weiteres Molekül Kohlenstoffmonoxid insertieren.[10]
Kinetische Untersuchungen in Rohrreaktoren, mit denen bei anderen heterogen-katalysierten Reaktion der geschwindigkeitsbestimmende Schritt, etwa die chemische Reaktion, die Diffusion durch die Grenzschicht oder die Porendiffusion, bestimmt werden konnte, führten bei der Untersuchung der Fischer-Tropsch-Synthese zu keinem eindeutigen Ergebnis.[10] Das Reaktionsnetzwerk besteht aus einer Reihe von komplexen, teilweise reversiblen chemischen und Transportreaktionen. Es wird außerdem angenommen, dass sich das katalytisch aktive Zentrum unter Reaktionsbedingungen durch Chemisorption der Reaktanden ausbildet und sich über die Länge der Katalysatorschüttung ändert.[10] Durch Untersuchungen in gradientenfreien Reaktoren wurde eine Aktivierungsenergie von 93 bis 95 kJ mol−1 und ein inhibierender Einfluss der Kohlenstoffmonoxidkonzentration gezeigt.[31][32] Bei kinetischen Untersuchungen in gradientenfreien Spinning-Basket-Reaktoren wurde die Bildung einer oberflächengebundenen Methylenspezies, die durch Hydrierung von chemisorbierten Kohlenstoffmonoxid entsteht, als geschwindigkeitsbestimmender Schritt identifiziert. Als ein solcher Schritt der Wassergas-Shift-Reaktion gilt die Bildung einer oberflächengebundenen Formylspezies.[33]
Anderson-Emmett-Mechanismus
In Untersuchungen von Anderson und Paul Hugh Emmett wurde herausgefunden, dass an Metallzentren chemisorbiertes Kohlenstoffmonoxid durch Wasserstoff zu einem enolischen Primärkomplex der Art M=CH(OH) (M = Metall) hydriert wird. Das Kettenwachstum erfolgt durch Kohlenstoff-Kohlenstoff-Verknüpfung zweier benachbarter Enole unter Wasserabspaltung. Durch Hydrierung dieser Zwischenstufe entsteht ein Methylhydroxycarbenkomplex, der wiederum für den Aufbau einer Kohlenstoffkette mit benachbarten Enolkomplexen unter Wasserabspaltung bereitsteht. Man erkannte, dass 14C-markiertes 1-Propanol schnell in den entstehenden Kohlenwasserstoff eingebaut wird. Dies wurde als Hinweis auf intermediäre Enolkomplexe gewertet.[34]
Pichler-Schulz-Mechanismus
Beim Pichler-Schulz-Mechanismus ist das Kettenwachstum durch Insertion von Kohlenstoffmonoxid in eine Metall-Alkyl-Bindung mit anschließender Hydrierung zum um eine CH2-Gruppe gewachsenen Alkylrest bestimmt. Dieser Mechanismus impliziert, dass die Insertion und die anschließende Hydrierung schnell im Vergleich zur Kettenabbruchreaktion verlaufen. Unterstützt wird dieser Mechanismus unter anderem durch das Verschwinden der Infrarot-Bande von adsorbiertem Kohlenstoffmonoxid während der Fischer-Tropsch-Reaktion.[35]
Sachtler-Biloen-Mechanismus
Neuere Studien scheinen einen Mechanismus über den Zerfall von chemisorbierten Kohlenstoffmonoxid in adsorbierte C1-Spezies und Sauerstoff zu unterstützen.[36] Hinweise darauf basieren auf dem leichten Einbau von voradsorbierten markierten Kohlenstoffen in die entstehende Kohlenwasserstoffkette. Das Kettenwachstum erfolgt dabei nach einem Gaube–Maitlis-Modell über oberflächengebundene Alkyliden- oder Alkylidin-Spezies.[36]
Verfahrensvarianten
Arge-Synthese

Das Verfahren wird in mehreren Varianten durchgeführt. Neben dem von Fischer und Tropsch entwickelten Normaldruckverfahren wurde das von Pichler entwickelte Mitteldruckverfahren, auch Hochlast- oder Arge-Synthese genannt, von einer Arbeitsgemeinschaft der Firmen Ruhrchemie und Lurgi kommerzialisiert. Dabei erfolgt die Umsetzung der Kohlevergasungsprodukte an mit Kupfer und Kaliumcarbonat dotierten Eisenkontakten im Festbettverfahren bei Temperaturen um 220 bis 240 °C und Drücken bis 25 bar. Das Kohlenstoffmonoxid-zu-Wasserstoff-Verhältnis liegt bei 1 zu 1,7. Als Produkte werden Paraffin/Olefin-Gemische, sogenanntes Gatsch, erhalten.
Die Reaktion ist exotherm mit 158 Kilojoule pro Mol gebildeter CH2-Gruppe bei 250 °C:[10]
Ein Problem ist die Abführung der hohen Hydrierwärme, um eine möglichst isotherme Reaktionsführung zu gewährleisten. Der Arge-Reaktor hatte ursprünglich einen Durchmesser von drei Metern und war mit 2052 Katalysatorrohren bestückt, die etwa 35 Tonnen oder 40 Kubikmeter Katalysator fassen. Der Katalysator ist dabei in engen, von Wasser umspülten Rohren angeordnet. Die Reaktionswärme wird durch Siedewasser unter Druck abgeführt. Eine ungenügende Wärmeabfuhr führt zu einem Temperaturgradienten über der Katalysatorschüttung und kann zu erhöhter Methanproduktion oder einer Verkokung der Kontakte führen.[10] Eine nachlassende katalytische Aktivität der Kontakte wird durch eine Erhöhung der Reaktionstemperatur ausgeglichen.
Das Katalysatorvolumen beträgt in modernen Reaktoren circa 200 m3. Eine Fischer-Tropsch-Anlage mit mehreren Reaktoren benötigt pro Stunde etwa 1.500.000 m3 bei Normbedingungen Synthesegas und stellt dabei pro Jahr etwa 2.000.000 t Kohlenwasserstoffe her. Die Synthese wird dreistufig durchgeführt mit einem Gesamtumsatz von circa 94 %.
Kölbel-Rheinpreussen-Verfahren
Neben der Durchführung im Festbettreaktor gibt es Verfahrensvarianten in einer Ölsuspension (Rheinpreußen-Koppers-Verfahren).[37][38]
Hydrocol-Prozess
Eine Verfahrensvarianten mit Wirbelschichtverfahren (Hydrocol-Verfahren), als Flugstaubsynthese, bei dem der Katalysator als verwirbelter Flugstaub vorhanden ist,[39].
Synthol-Verfahren
Eine Reaktionsvariante ist die von den Firmen Sasol und Kellogg entwickelte Synthol-Synthese. Sie ist nicht mit dem von Fischer und Tropsch entwickelten gleichnamigen Verfahren zu verwechseln. Bei dem Verfahren handelt es sich um eine Flugstaubsynthese; bei ihm wird der Katalysator als Pulver mit dem Reaktionsgas eindosiert. Das Verfahren arbeitet bei 25 bar und Temperaturen über 300 °C. Dadurch bilden sich bevorzugt niedermolekulare Kohlenwasserstoffe. Das Verhältnis Kohlenstoffmonoxid zu Wasserstoff beträgt circa 1:2.[10]
Literatur
- Günter Luxbacher: Kohle-Öl-Benzin – Die Fischer-Tropsch-Syntese in der interinstitutionellen Kooperation 1933-1944, in: Helmut Meier: Gemeinschaftforschung, Bevollmächtigte und der Wissentransfer – Die Rolle der Kaiser-Wilhelm-Gesellschaft im System kriegsrelevanter Forschung des Nationalsozialismus, Wallstein, Göttingen 2007, ISBN 978-3-8353-0182-5, S. 453-502.
- Thorsten Gottschau: Biomass-to-Liquid (BtL)-Kraftstoffe. Übersicht und Perspektiven. In: Rainer Schretzmann, Jörg Planer (Hrsg.): Kraftwerk Feld und Wald. Bioenergie für Deutschland., AID, Bonn 2007, ISBN 978-3-8308-0680-6, (Tagungsband zum AID-Forum Landwirtschaft am 10. November 2006 in Bonn)
- Steffen Bukold: Öl im 21. Jahrhundert. Band 2: Alternativen und Strategien. Oldenbourg, München 2009, ISBN 978-3-486-58898-9
- Friedrich Benthaus u. a.: Rohstoff Kohle. Eigenschaften, Gewinnung, Veredelung, 1. Auflage, Verlag Chemie, Weinheim 1978, ISBN 3-527-25791-8
- Manfred Rasch: Geschichte des Kaiser-Wilhelm-Instituts für Kohlenforschung 1913–1943, Weinheim 1989.
Weblinks
Einzelnachweise
- P. Sabatier, J. B. Senderens: Hydrogenation of CO over Nickel to Produce Methane. In: J. Soc. Chem. Ind. 21, 1902, S. 504–506.
- Emil Fischer: Die Aufgaben des Kaiser-Wilhelm-Instituts für Kohlenforschung. In: Stahl und Eisen. 32, 1912, S. 1898–1903.
- The Method of Direct Hydrogenation by Catalysis, Vortrag von Paul Sabatier anlässlich der Verleihung des Nobelpreises, 11. Dezember 1912 (abgerufen am 12. November 2016)
- BASF, Patent DRP 293,787 (1913)
- Franz Fischer, Hans Tropsch: Über die Herstellung synthetischer Ölgemische (Synthol) durch Aufbau aus Kohlenoxyd und Wasserstoff. In: Brennstoff-Chem. 4, 1923, S. 276–285.
- Kai-Olaf Hinrichsen, Jennifer Strunk: Basischemikalie Methanol. In: Nachrichten aus der Chemie. 54, 2006, S. 1080–1084, doi:10.1002/nadc.20060541109.
- Friedrich Asinger: Methanol, Chemie- und Energierohstoff. Akademie-Verlag, Berlin, 1987, ISBN 3-05-500341-1, S. 122.
- Franz Fischer, Hans Tropsch: Über die direkte Synthese von Erdöl-Kohlenwasserstoffen bei gewöhnlichem Druck. (Erste Mitteilung). In: Berichte der deutschen chemischen Gesellschaft (A and B Series). 59, 1926, S. 830–831, doi:10.1002/cber.19260590442.
- Christoph Janiak, Thomas M. Klapötke, Hans-Jürgen Meyer, Erwin Riedel: Moderne anorganische Chemie. 2003, ISBN 3-11-017838-9, S. 769.
- F. Benthaus u. a.: Rohstoff Kohle. Eigenschaften, Gewinnung, Veredelung, Verlag Chemie, Weinheim, 1. Auflage, 1978, ISBN 3-527-25791-8, S. 43.
- Zwanzig Minuten Kohlenklau, dafür doppelte Fettration. In: Der Spiegel. Nr. 46, 1947 (online).
- Franz Kainer: Die Kohlenwasserstoff-Synthese nach Fischer-Tropsch. Springer Verlag, 1950, ISBN 978-3-642-49125-2, S. 217.
- Aus strategischen Gründen: Politischer Treibstoff. In: Der Spiegel. Nr. 26, 1949 (online).
- Billiges Benzin aus Bottrop, bei Welt.de. Abgerufen am 15. Oktober 2013.
- Der heimliche Ölkonzern aus Südafrika, bei Handelsblatt.de. Abgerufen am 15. Oktober 2013.
- C-17 flight uses synthetic fuel blend. Abgerufen am 12. Oktober 2013.
- Hopper T. Smith: Ace in the Hole: Fischer-Tropsch Fuels and National Security. In: Army War Coll. Carlisle Barracks PA, 2010.
- B. Kamm: Production of Platform Chemicals and Synthesis Gas from Biomass. In: Angewandte Chemie International Edition. 46, 2007, S. 5056–5058, doi:10.1002/anie.200604514.
- Mark E Dry: High quality diesel via the Fischer-Tropsch process - a review. In: Journal of Chemical Technology & Biotechnology. 77, 2002, S. 43–50, doi:10.1002/jctb.527.
- Dragomir B. Bukur, Branislav Todic, Nimir Elbashir: Role of water-gas-shift reaction in Fischer–Tropsch synthesis on iron catalysts: A review. In: Catalysis Today. 275, 2016, S. 66–75, doi:10.1016/j.cattod.2015.11.005.
- Friedrich Asinger: Einführung in die Petrolchemie. Akademie Verlag, Berlin, 1959, S. 24–35.
- Michael Engel, Lukas Rohleder: Alternative Flugkraftstoffe - Chancen und Herausforderungen. In: Internationales Verkehrswesen, Heft 1, März 2015 (67. Jahrgang), ISSN 0020-9511, S. 24–27.
- Friedrich Asinger: Chemie und Technologie der Paraffin-Kohlenwasserstoffe. Akademie Verlag, 1956, S. 64–68.
- Andrei Y. Khodakov, Wei Chu, Pascal Fongarland: Advances in the Development of Novel Cobalt Fischer-Tropsch Catalysts for Synthesis of Long-Chain Hydrocarbons and Clean Fuels. In: ChemInform. 38, 2007, doi:10.1002/chin.200733255.
- S. Storsater, B. Totdal, J. Walmsley, B. Tanem, A. Holmen: Characterization of alumina-, silica-, and titania-supported cobalt Fischer-Tropsch catalysts. In: Journal of Catalysis. 236, 2005, S. 139–152, doi:10.1016/j.jcat.2005.09.021.
- Wolfgang A. Herrmann: Metallorganische Aspekte der Fischer-Tropsch-Synthese. In: Angewandte Chemie. 94, 1982, S. 118–131, doi:10.1002/ange.19820940205.
- Wilfried Rähse: Untersuchung der kondensierten Eisenhydroxide. In: Zeitschrift für anorganische und allgemeine Chemie. 438, 1978, S. 222–232, doi:10.1002/zaac.19784380124.
- B.I.O.S. - Final Report No. 447, Item No. 30: Interrogation of Dr. Otto Roelen of Ruhrchemie A.G. Archiviert vom Original am 8. Februar 2012; abgerufen am 3. August 2012.
- P. L. Spath, D. C. Dayton: Preliminary Screening - Technical and Economic Assessment of Synthesis Gas to Fuels and Chemicals with Emphasis on the Potential for Biomass-Derived Syngas. (Memento vom 17. Dezember 2008 im Internet Archive) (PDF; 1,6 MB), NREL/TP510-34929, Dezember 2003, S. 95.
- J. T. Kummer, T. W. DeWitt, P. H. Emmett: Some Mechanism Studies on the Fischer-Tropsch Synthesis Using 14C In: Journal of the American Chemical Society. 70, 1948, S. 3632–3643, doi:10.1021/ja01191a029.
- Ian C. Yates, Charles N. Satterfield: Intrinsic kinetics of the Fischer-Tropsch synthesis on a cobalt catalyst. In: Energy & Fuels. 5, 1991, S. 168–173, doi:10.1021/ef00025a029.
- Gerard P. van der Laan, A. A. C. M. Beenackers: Kinetics and Selectivity of the Fischer-Tropsch Synthesis: A Literature Review. In: Catalysis Reviews. 41, 1999, S. 255–318, doi:10.1081/CR-100101170.
- Gerard P. van der Laan, Antonie A.C.M. Beenackers: Intrinsic kinetics of the gas-solid Fischer-Tropsch and water gas shift reactions over a precipitated iron catalyst. In: Applied Catalysis A: General. 193, 2000, S. 39–53, doi:10.1016/S0926-860X(99)00412-3.
- W. Keith Hall, R. J. Kokes, P. H. Emmett: Mechanism Studies of the Fischer-Tropsch Synthesis: The Incorporation of Radioactive Ethylene, Propionaldehyde and Propanol In: Journal of the American Chemical Society. 82, 1960, S. 1027–1037, doi:10.1021/ja01490a005.
- Hans Schulz: Short history and present trends of Fischer-Tropsch synthesis. In: Applied Catalysis A: General. 186, 1999, S. 3–12, doi:10.1016/S0926-860X(99)00160-X.
- R. A. van Santen, I. M. Ciobîc?, E. van Steen, M. M. Ghouri: Mechanistic Issues in Fischer-Tropsch Catalysis. In: Bruce C. Gates, Helmut Knözinger: Advances in Catalysis. Vol. 54, Burlington Academic Press, 2011, ISBN 978-0-12-387772-7, S. 127–187.
- Herbert Kölbel, Milos Ralek: The Fischer-Tropsch Synthesis in the Liquid Phase. In: Catalysis Reviews. 21, 2006, S. 225, doi:10.1080/03602458008067534.
- Herbert Kölbel, Paul Ackermann: Großtechnische Versuche zur Fischer-Tropsch-Synthese im flüssigen Medium. In: Chemie Ingenieur Technik. 28, 1956, S. 381, doi:10.1002/cite.330280602.
- Maria Höring, Ernst E. Donath: Verflüssigung und Vergasung von Kohle. In: Die Naturwissenschaften. 61, 1974, S. 89–96, doi:10.1007/BF00606276.
