Freies Elektronenpaar
Ein freies Elektronenpaar (auch nichtbindendes oder bei wörtlicher Übersetzung des englischen lone pair auch einsames Elektronenpaar genannt) besteht aus zwei Elektronen an einem Atom, welche einen entgegengesetzten Spin haben und dasselbe Atom- und Molekülorbital besetzen. In der Chemie werden diese Elektronen auch als Valenzelektronen bezeichnet. Das freie Elektronenpaar ist als Valenzelektronenpaar im Allgemeinen an keiner Bindung mit anderen Atomen beteiligt, sondern nur zu einem Atom gehörig – eine Ausnahme ist z. B. Ozon. In einer Valenzstrichformel wird ein freies Elektronenpaar entweder durch zwei Punkte (IUPAC-Empfehlung) oder durch einen Strich an dem betreffenden Atom dargestellt.[1] Es gibt auch die Darstellung der freien Elektronen als Elektronenwolken. Die folgenden Abbildungen zeigen Moleküle mit blau markierten freien Elektronenpaaren:
 Wasser mit zwei Elektronenpaaren als Punkte.
Wasser mit zwei Elektronenpaaren als Punkte. Wasser mit zwei Elektronenpaaren als Striche.
Wasser mit zwei Elektronenpaaren als Striche. Wasser mit zwei Elektronenpaaren als Elektronenwolken.
Wasser mit zwei Elektronenpaaren als Elektronenwolken. Kohlenstoffdioxid mit vier freien Elektronenpaaren.
Kohlenstoffdioxid mit vier freien Elektronenpaaren. Blausäure mit einem freien Elektronenpaar.
Blausäure mit einem freien Elektronenpaar.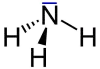 Ammoniak mit einem freien Elektronenpaar.
Ammoniak mit einem freien Elektronenpaar. Stickstoffmolekül mit zwei freien Elektronenpaaren.
Stickstoffmolekül mit zwei freien Elektronenpaaren.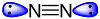 Stickstoffmolekül mit zwei Elektronenwolken.
Stickstoffmolekül mit zwei Elektronenwolken.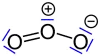 Ozon mit sechs freien Elektronenpaaren.
Ozon mit sechs freien Elektronenpaaren.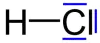 Chlorwasserstoff mit drei freien Elektronenpaaren.
Chlorwasserstoff mit drei freien Elektronenpaaren.
Freie Elektronenpaare tragen zum räumlichen Bau von Molekülen bei, deren Gestalt mit dem Elektronenpaarabstoßungs-Modell (VSEPR-Modell) für einfache Verbindungen vorhergesagt werden kann. Bekanntestes Beispiel ist die gewinkelte Form des Wassermoleküls, die ausschlaggebend für einige Eigenschaften des Wassers ist.
Im Gegensatz zu einem freien Elektronenpaar stellt ein bindendes Elektronenpaar die Verbindung zwischen zwei Atomen dar. Diese wird als kovalente Bindung bezeichnet.
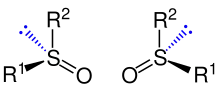
Chiralität aufgrund eines freien Elektronenpaares
Ein freies Elektronenpaar verhält sich an einem Stereozentrum wie ein weiterer Substituent.
Amine
Besitzt ein tertiäres Amin NR1R2R3 drei verschiedene organische Reste (R1 ≠ R2 ≠ R3) und ein freies Elektronenpaar am Stickstoffatom, so könnte man erwarten, dass solche Amine chiral sind. Bei Raumtemperatur lassen sich jedoch wegen der schnell ablaufenden Inversion („Durchschwingen“ des freien Elektronenpaares) in der Regel keine Enantiomere isolieren. Dies gilt aber nicht für spezielle tertiäre Amine in denen das Stickstoffatom durch eine „Brückenkopf“-Stellung (z. B. Trögersche Base[2]) an der Inversion gehindert ist. Deshalb gibt es von der Trögerschen Base zwei stabile Enantiomere, die beispielsweise chromatographisch an einer chiralen stationären Phase getrennt werden können.[3]
Einzelnachweise
- Eintrag zu lone (electron) pair. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.L03618.
- Siegfried Hauptmann: Organische Chemie. 2. Auflage. VEB Deutscher Verlag für Grundstoffindustrie, Leipzig 1985, ISBN 3-342-00280-8, S. 96.
- Ernest L. Eliel, Samuel H. Wilen: Stereochemistry of Organic Compounds. John Wiles & Sons, 1994, ISBN 0-471-05446-1, S. 360.
- Albert Gossauer: Struktur und Reaktivität der Biomoleküle. Verlag Helvetica Chimica Acta, Zürich 2006, ISBN 3-906390-29-2, S. 235–236.