Hämatophagie
Hämatophagie (altgr. αἷμα haima ‚Blut‘ und φαγεῖν phagein ‚essen‘, ‚fressen‘) bezeichnet die Ernährungsweise einiger Tiere von Blut. Zu diesen Lebewesen gehören Gliederfüßer, vor allem blutsaugende Insekten (z. B. Stechmücken, Bettwanzen), Spinnentiere (z. B. Zecken, Herbstgrasmilben), aber auch Darmparasiten, Blutegel, Fische wie die Neunaugen sowie Säugetiere wie die Vampirfledermäuse.

Nur wenige Tiere sind auf Blut als ausschließliche Nahrungsquelle angewiesen, oft gibt es dieses Erfordernis nur in bestimmten Lebensabschnitten, für einige Arten ist eine „Blutmahlzeit“ nur während der Eireifung obligat, dann betrifft es die Weibchen mit befruchteten Eiern. Bei den Stechmücken haben nur die Weibchen zum Blutsaugen geeignete Mundwerkzeuge.
Die Hämatophagie wird von einigen primär herbivoren Tierarten nur selten praktiziert, um ihre Ernährung durch hochwertiges Protein oder andere Nahrungsbestandteile zu bereichern.
Organismen
Mensch
In einigen Kulturkreisen ist oder war die Verwendung von Blut als Nahrungsbestandteil oder für Riten (Blutopfer) erforderlich. Das Trinken von Rinderblut, teilweise vermischt mit Milch, gehört zum Leben und den Zeremonien der Massai.[1] Die Eskimos verzehren Seehund- und Walrossblut,[2] aber auch in Europa werden Blutprodukte wie Blutwurst als Lebensmittel akzeptiert.[3] Blutwurst gilt als eine der ältesten Wurstarten, da sie bereits in Homers Odyssee erwähnt wird.[4]
Außerdem ist Hämatophagie ein stetig wiederkehrendes Thema der Literatur (Bram Stoker: Dracula, 1897), des Horrorfilms und auch Fernsehserien (Liste von Vampirfilmen und -serien).
Endoparasiten
Im Blut lebende Parasiten wie Plasmodien (der Haemospororida) ernähren sich vom Blut ihres Wirtes (Reptilien, Vögel, Säugetiere und Mensch) mit hoher Wirtsspezifität.
Vandelliinae wie Vandellia cirrhosa (aus der Familie Schmerlenwelse im Amazonasbecken) schwimmen in die Kiemenöffnungen größerer Fische, dringen zur Kiemenaorta vor, perforieren sie mit ihren spitzen Zähnen und nehmen das austretende Blut ohne Saugakt auf.
Ektoparasiten
Etwa 14.000 Arten der Insekten aus 5 Ordnungen sind Hämatophagen,[5] daneben viele Vertreter weiterer Stämme und Klassen, auch der Chordatiere wie Fische, Vögel und Säugetiere. Die Evolution auch der hämatophagen Insekten verlief mehrmals parallel (konvergent).[6]
| Stamm / Klasse | Ordnung / Tiergruppe | Beispiel | Mundwerkzeuge | Gerinnungshemmer im Speichel | Schmerzhemmer im Speichel | Opfer (Wirt) |
|---|---|---|---|---|---|---|
| Ringelwürmer | Egel | Medizinischer Blutegel | bezahnter Saugmund | Hirudin[7] | ja[7] | Säugetiere, Mensch |
| Gliederfüßer / Krebstiere | Asseln / Gnathiidae | Paragnathia formica | u. a. Anti-Thrombin, drei Trypsin Inhibitoren (18 kDa, 21 kDa und 22 kDa)[8] | ? | Fische | |
| Gliederfüßer / Spinnentiere | Milben / Zecken | Schildzecken: Gemeiner Holzbock | Stechrüssel | ja | ja | Vögel, Säugetiere, Mensch |
| Lederzecken | Stechrüssel | ja | ja | |||
| Milben / Prostigmata | Herbstgrasmilbe | Stechrüssel | ja | ja | Säugetiere | |
| Gliederfüßer / Insekten | Zweiflügler / Stechmücken | Aedes, Anopheles, Stegomyia, Kriebelmücken,[6] Gnitzen, Sandmücken | Stechrüssel | Anti-Faktor X (Xa) (Trypsin Inhibitor vom Kazal-Typ)[9] | ? | Amphibien, Reptilien, Vögel, Säugetiere, Mensch |
| Uranotaenia lateralis | Stechrüssel | wahrscheinlich | ? | Schlammspringer | ||
| Zweiflügler / Fliegen | Bremsen, Stechfliegen, Zungenfliegen, Tsetsefliegen, Lausfliegen (Hirschlausfliege), Wadenstecher | Beißwerkzeuge + Saugrüssel | ja | ? | Vögel, Säugetiere, Mensch | |
| Flöhe | Rattenfloh, Hundefloh, Katzenfloh, Kaninchenfloh, Menschenfloh | Stechrüssel | ja | ? | Säugetiere, Mensch | |
| Tierläuse (nur Anoplura) | Menschenläuse, Filzlaus, Seehundlaus, Schweinelaus | Stechrüssel | ja | ? | bestimmte Säugetiere, Mensch | |
| Schnabelkerfe | blutsaugende Wanzen | Stechrüssel | ja | ? | Vögel, Säugetiere, Mensch | |
| Schmetterlinge / Eulenfalter | Calyptra | stechender Saugrüssel | ? | ? | Säugetiere, Mensch | |
| Chordatiere / Petromyzontida | Neunauge | Saugmaul mit Raspelzähnen | ja | ? | Fische | |
| Chordatiere / Vögel | Sperlingsvögel / Tangaren | Vampirfink | Schnabel | vermutlich nein | vermutlich nein | Blaufußtölpel, Nazcatölpel |
| Chordatiere / Säugetiere | Fledertiere / Blattnasen / Vampirfledermäuse | Gemeiner Vampir (Desmodus rotundus) | bezahnter Mund, Zunge mit Rillen | Desmoteplase[10] als Faktor X (Xa)- und Faktor IX-Inhibitor | ja | Säugetiere (bes. große Herbivoren), Mensch |
| Kammzahnvampir (Diphylla ecaudata) | bezahnter Mund, Zunge mit Rillen | ja | ja | Vögel |

Blutaufnahme
Mundwerkzeuge
Hämatophage Tiere müssen mit entsprechenden Mundwerkzeugen bzw. Zahnbildungen ausgestattet sein, die ein Überwinden der Oberhaut des Wirtes und Erschließen von Gefäßen ermöglichen.
Auf verschiedene Weise wird dann das Blut aufgenommen. Viele der Stechrüssel, besonders blutsaugender Insekten, sind sehr dünne Röhren (Kapillarsauger, Solenophagen), die aufgrund Kapillarwirkung die Blutflüssigkeit aufnehmen, ohne Erfordernis einer Pumpleistung oder eines erzeugten Unterdrucks, z. B. Zweiflügler (Diptera).[11][12] Andere Hämatophagen saugen aktiv die Blutmahlzeit auf, z. B. Schildzecken (Ixodidae) oder Vampirfledermäuse (Desmodontinae).
Spinnentiere

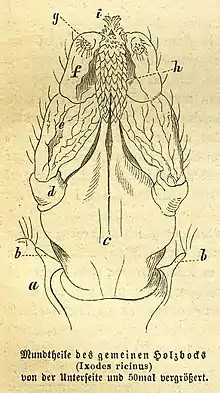
Der Gemeine Holzbock (Ixodes ricinus) verfügt über einen hochausgebildeten Stech- und Saugapparat. Der Mundbereich ist ein vom sonstigen Körper abgegliederter Teil (Gnathosoma oder auch Capitulum), der die Saugwerkzeuge enthält. Diese Werkzeuge setzen sich aus mehreren Komponenten zusammen. Zum ersten Teil gehören die keulenförmigen Pedipalpen, sie dienen als Tastorgan (wie auch bei vielen anderen Spinnentieren), um die Beschaffenheit der Wirtshaut genau zu erfassen. Bevorzugt werden dünne Hautstellen mit warmer Temperatur und hoher Feuchte. Ein Stück weiter innen an der Oberseite befinden sich die beiden Cheliceren. Sie besitzen an der Spitze mehrere scharfe Zähne, mit denen der Holzbock ein Loch in die Haut schneiden kann. Nach dem Schnitt des Lochs kommt das sogenannte Hypostom zum Einsatz. Es ist ein zapfenartiger Körperteil in der Mitte des Capitulum, welches auf der Unterseite Reihen grober Zähne trägt, während die Oberseite flexibel und in der Mitte etwas rinnenförmig eingesenkt ist. In etwa drei Stufen dringen die teleskopartigen Strukturen ein, indem sie abwechselnd, voneinander unabhängig, in die Körperöffnung des Opfers geschoben werden.[14][15] Durch das Hypostom und (bei den Schildzecken) zementartig erhärtenden Speichel verankert sich das Tier in der Haut, das Blut wird durch den Pharynx, der als Pumpe wirkt, in die Nahrungsrinne und dann in die an der Basis des Hypostoms liegende Mundöffnung eingesaugt.[16]
Zweiflügler

Stechmücken (Culicidae) benützen einen Stechapparat, welcher durch Kombination mehrerer Mundwerkzeuge gebildet wird. Zwei Teile sind äußerlich unterscheidbar: der dünne starre Stechrüssel und eine flexible Scheide, die bei der Blutmahlzeit als Führung dient. Der Stechrüssel setzt sich zusammen aus den Stechborsten: Oberlippe (Labrum), paarige Oberkiefer (Mandibel) und Unterkiefer (Maxille) sowie Schlundrohr (Hypopharynx). Dieses zum Stechrüssel vereinigte Bündel kann die Haut des Wirtes durchdringen. Im Inneren bildet es zwei Kanäle. Durch den Hypopharynx kann das Blut durch Kapillarwirkung aufgenommen, durch die mittels anderer Stechborsten gebildete Röhre Speichel injiziert werden. In Ruhestellung liegt der Stechrüssel in einer von der Unterlippe (Labium) gebildeten Scheide geschützt. Beim Stich dringt die Unterlippe selbst nicht in den Wirt ein, sie wird nach hinten weggekrümmt und hilft, den Stechrüssel an der Einstichstelle zu fixieren, ohne selbst dort einzudringen.
Am Ende des Labrums (Stechborste aus Oberlippe) befinden sich drei Gruppen von Sensillen, von denen die apikalen und subapikalen zum Auffinden der blutführenden Stelle, die campaniformen zur Kontrolle des Blutflusses erforderlich sind.[17]
Die entsprechenden Mundwerkzeuge sind beim Männchen verkümmert und erlauben nur die Aufnahme von Flüssigkeiten ohne Einstich und an ihrem Labrum ist nur eine Sensillengruppe (campaniforme) entwickelt.
Knochenfische
Der im Süßwasser vorkommende Schmerlenwels Vandellia cirrhosa lebt über Sandbänken, leicht mit Sand bedeckt und wartet auf vorbeischwimmende Großfische. Vandellia cirrhosa ist ein Parasit. Er kann die Harnstoffe aus den über die Kiemenatmung ausgetauschten Stoffwechselprodukten großer Fische wahrnehmen und schwimmt, der Konzentration folgend, in die Kiemenöffnungen der Fische. Seine eigenen Kiemenstacheln benutzt er, um bis zur Kiemenaorta hochzuklettern und zum Festhalten. Mit nadelförmigen Zähnen perforiert er die Arterie und nimmt das Blut des Wirtsfisches auf, was ihm den Beinamen „Brasilianischer Vampirfisch“ einbrachte. Vandellia cirrhosa ist jedoch kein Blutsauger, denn die Art verfügt über keine Saugorgane. Der Druck des aus der Arterie ausströmenden Blutes reicht aus, um den Fisch innerhalb von 30 bis 145 Sekunden mit Blut zu füllen. Danach lässt er vom Wirtstier ab.
Säugetiere
Vampirfledermäuse (Desmodontinae) besitzen sichelförmige Schneide- und Eckzähne zum lochförmigen Aufschneiden der Haut ihrer Opfer, neben zurückgebildeten Backenzähnen ohne Kauflächen. Das austretende Blut wird mit der Zunge aufgeleckt oder mit eingefalteter Zunge über Rillen an ihrer Unterseite aufgesaugt. Eine kurze Speiseröhre und der schlauchförmige Magen sind weitere anatomische Anpassungen an die Ernährungsweise.
Speichel
Der Speichel hämatophager Ektoparasiten hat weniger die Aufgabe, den Schluckvorgang wie bei anderen Ernährungsweisen zu unterstützen, denn die Blutmahlzeit ist sehr wasserreich. Primär dient der Speichel dazu, die Blutaufnahme zu erleichtern, indem der Blutgerinnung entgegengewirkt wird und die Wunde während der Blutmahlzeit möglichst nicht vom Opfer wahrgenommen werden kann. Stoffe, die die Blutgerinnung hemmen, sowie schmerzunterdrückende Substanzen werden daher oft mit dem Speichel bei der Blutentnahme in die Wunde abgegeben.
Endoparasiten benötigen diese Mechanismen nicht, bei ihnen stehen solche zur Verhinderung einer Immunantwort im Vordergrund, allerdings nicht als Speichelkomponenten.
Lokalanästhesie
Der Speichel vieler hämatophager Ektoparasiten enthält schmerzbetäubende Stoffe. Diese Komponenten werden meist frühzeitig während der Wundsetzung abgegeben, um zu verhindern, dass das Opfer den Biss wahrnehmen kann.[18] Erforderlich ist das hauptsächlich für Ektoparasiten, die zur Blutmahlzeit länger verweilen müssen. Schnelle Attacken mit kurzer Verweildauer stellen eine alternative Strategie dar, eine andere besteht darin, Körperareale zu besiedeln, welche vom Opfer selbst nur schlecht kontrolliert werden.
Auch der Speichel von Vampirfledermäusen enthält lokalanästhetisch wirksame Komponenten, sie belecken die Stelle ihres Opfers, bevor sie dort Haare bzw. Federn entfernen und dann ein Loch beißen.
Gerinnungshemmer
Für fast alle hämatophagen Tiergruppen wurden gerinnungshemmende Stoffe im Speichel festgestellt.[6][7][8][9][19][20][21] Nur für hämatophage Schmetterlinge und Vögel sind keine gerinnungshemmenden Stoffe im Speichel bekannt.
Die Bedeutung gerinnungshemmender Stoffe muss für hämatophage Ektoparasiten hoch sein, denn entsprechend der mehrfachen parallelen Evolution solcher Tiergruppen, auch innerhalb der Insekten, entwickelten sich die Gerinnungshemmer in ihrem Speichel ebenfalls jedes Mal parallel.[6] Damit wird eine zwingende Notwendigkeit aufgrund dieser Ernährungsweise offenbar, die eine Erklärung fordert.[19] Sie könnte darin gesucht werden, dass es sich Hämatophagen nicht leisten können, ihre feinen röhrigen Mundwerkzeuge durch Gerinnsel zu verstopfen. Auch ist naheliegend, dass die Blutung während der Mahlzeit nicht aufgrund Gerinnung versiegen sollte. Insbesondere eine Entnahme aufgrund der Kapillarwirkung des Stechrüssels würde durch Gerinnungsvorgänge behindert. Experimentell zeigte sich, dass hämatophage Raubwanzen auch nach Entfernen ihrer Speicheldrüsen Blut aufnehmen können, sie benötigen dann aber selbst für geringere Mengen viel mehr Zeit. Dies wird mit Schwierigkeiten erklärt, nach einem Blutgefäß zu sondieren. Dem Insekt ist mit seinen Mundwerkzeugen die effektive Suche nach einem Gefäß nur möglich, solange der Blutfluss nicht unterbricht. Ohne Abgabe gerinnungshemmenden Speichels kann nur die geringe Anfangsblutung genutzt werden, die beim zufälligen Öffnen des Gewebes entstand, bis zur rasch einsetzenden Gerinnung. Das Insekt muss wiederholt eine neue Ansatzstelle setzen, bis es zufällig ein ergiebiges Gefäß trifft.[21]
Der Speichel von Vampirfledermäusen enthält ebenfalls Gerinnungshemmer, bei dem Gemeinen Vampir (Desmodus rotundus) das Protein Desmoteplase.[10] Als Faktor X (Xa)- und Faktor IX-Inhibitor verhindert es die Blutgerinnung für bis zu acht Stunden nach dem Biss.
Die gerinnungshemmenden Mechanismen sind verschiedenartig, einige richten sich gegen bestimmte Gerinnungsfaktoren, andere gegen eine Thrombozytenaggregation.[20]
Diese gerinnungshemmenden Stoffe werden auch von der pharmazeutischen Forschung untersucht, da sie zur Vorbeugung vor und Auflösung von Thromben und Blutgerinnseln beitragen könnten um zur Verhinderung von Thrombosen und Embolien beizutragen.
Blutverarbeitung
Verdauung
Blut enthält relativ viel Wasser und Protein, dagegen wenig Fette und Kohlenhydrate. Entsprechend sind zur Verdauung viele Proteasen erforderlich.[22]
Manche der Ektoparasiten beherbergen Endosymbioten, so lebt Aeromonas veronii biovar sobria im Darm des Blutegels (Hirudo medicinalis), vermutlich dessen Blutverdauung unterstützend.[18]
Exkretion und Eireifung
Insbesondere für fliegende Ektoparasiten stellt der Wasserballast eine Herausforderung dar, denn die Blutaufnahme kann ihr eigentliches Körpergewicht übertreffen und ihre Flugfähigkeit sehr beeinträchtigen. Das betrifft sowohl Insekten wie auch beispielsweise Fledermäuse. Vampirfledermäuse kehren oft innerhalb einer Nacht wiederholt zum selben Opfer zurück, um ihre Mahlzeit fortzusetzen, nachdem sie ihre Blutmahlzeit von etwa 20 bis 30 Milliliter verdaut und den Wasseranteil größtenteils ausgeschieden haben, denn deutlich über 30 Milliliter (etwa 30 Gramm) würde die Flugkräfte der Tiere mit einem Eigengewicht von 15 bis 50 Gramm überfordern. Nach der Blutmahlzeit wird daher die Diurese hormonell stark angeregt, um einen Großteil der Wassermenge sehr rasch über ihr Harnorgan auszuscheiden.[5][23][24] Die Notwendigkeit einer Wasserausscheidung ist für nicht hämatophage Tiere unbekannt, im Gegenteil, ein Großteil der Nierenarbeit und der Wasserresorption im Verdauungstrakt von Landtieren, insbesondere fliegenden, ist dahin gerichtet, Wasserausscheidungen zu minimieren.
Wie für andere Tiere, besteht für hämatophage Organismen die Notwendigkeit, überflüssige Stoffwechselprodukte auszuscheiden. Aufgrund der hohen Aufnahme von Sauerstofftransportmolekülen aus dem Blut fallen besonders Eisen aus Porphyrin-Verbindungen (wie Häme) und Stickstoffverbindungen aus den Eiweißen (wie Hämoglobin und Albumin) im Überfluss an.[25][26]
Die Notwendigkeit einer Stickstoffausscheidung betrifft fast alle Tiere. Guanin ist das stickstoffhaltige Hauptausscheidungsprodukt der Lederzecke (Argas arboreus) mit einem Anteil von 59,2–97,3 % an der Exkretionsmasse, es beinhaltet 70–100 % des ausgeschiedenen Stickstoffs.[25]
Während für viele Organismen Eisen einen limitierenden Faktor darstellt, ist es für hämatophage Organismen im Überfluss vorhanden, sodass es ausgeschieden werden muss. Andererseits stellt aber Eisen für viele Hämatophagen gleichzeitig auch einen essentiellen Stoff dar, insbesondere für die Eireifung blutsaugender Insekten, weshalb bei Stechmücken beispielsweise nur Weibchen während der Eireifung Blut saugen. Etwa 87 % der Eisenaufnahme aus Häme werden von der Gelbfiebermücke (Aedes aegypti) nach der Mahlzeit ausgeschieden, etwa 7 % für die Eireifung verwendet und etwa 6 % in Körpergewebe gespeichert. Bei Eisenaufnahme aus Transferrin wurden etwa 8 % davon ausgeschieden, etwa 77 % kam der Eientwicklung zugute und etwa 15 % wurden in Körpergewebe gespeichert. Da Transferrin in der Nahrung erheblich weniger vorkommt, stammt aber etwa 98 % des Eisengehaltes der Eier aus Häme.[26]1,2–8,6 % der Ausscheidung von Argas arboreus erfolgt in Form von Hämatin, welches neben Eisen auch 0,23–1,45 % des aufgenommenen Stickstoffs enthält.[25] Der Hämatingehalt verleiht den Exkrementen vieler Hämatophagen eine schwarze Farbe.
Sekundärübertragung
Viele Ektoparasiten mit häufigem Wirtswechsel, besonders hämatophage, sind für weitere Parasiten oder pathogene Mikroorganismen beliebte Vektoren, die ihrem Transport und ihrer Ausbreitung dienen. So kann ein hämatophager Ektoparasit wie z. B. die Anophelesmücke den hämatophagen Endoparasiten Plasmodium (Malariaerreger) übertragen.[27] Unter den Bakterien treten besonders Borrelien als übertragene Pathogene hervor.[28]
Die Aufklärung der Chagas-Krankheit um 1910 gelang nicht durch die Identifizierung des Erregers bei Erkrankten, sondern durch die Identifizierung eines vorher unbekannten Flagellaten (Trypanosoma cruzi) bei Raubwanzen (Reduviidae).[29]
Wenn Blutegel beispielsweise nicht antibiotisch vorbehandelt wurden, haben etwa 20 % der medizinischen Anwendung von Blutegeln Aeromonas-Infektionen zur Folge, denn sie beherbergen die gefürchteten „Krankenhauserreger“ als Endosymbioten.[18] Direkt ins Blut eingebracht, können die Bakterien Blutvergiftungen (Sepsis) auslösen.
Strategien der Opfer
Umgang mit Endoparasiten
Eine Strategie der Wirte besteht darin, im Lauf der Evolution den Immunschutz gegen Endoparasiten stetig zu verbessern.
Möglichem Befall durch Endoparasiten kann der Mensch häufig durch Hygienemaßnahmen, Impfschutz oder präventiven Arzneimitteleinnahme vorgebeugt werden. Allerdings stehen gegen die meisten hämatophagen Endoparasiten kaum wirksame Schutzimpfungen zur Verfügung.
Tatsächlicher Befall kann oft durch Therapiemaßnahmen (Operation oder Arzneimittel) vermindert oder kuriert werden.
Vermeidung von Ektoparasiten

Zur Vermeidung hämatophager Ektoparasiten dienen vielfältige Strategien der bedrohten Wirte. Dazu gehören beispielsweise eine gute Beweglichkeit, besonders manuelle (Primaten) oder durch andere Körperteile (Kuhschwanz, Zunge der Katze), feste Körperbedeckung (Gliederfüßer, dichte Kleidung), Körperreinigung (Elefanten, Mensch), soziale Fellpflege (Fledermäuse),[30] zwischenartliche Körperpflege (Partnergarnelen, Madenhacker), Abreiben (viele Säugetiere),[31] Sensitivität der Körperoberfläche, Haararmut (Mensch), Repellent- und Biozideinsatz (Pyrethrum). Eine weitere Möglichkeit ist, sich zu verstecken, hinter Moskitonetzen (Mensch), unterzutauchen, mit Schlammschicht zu bedecken (Wasserbüffel) oder die eigene Wärmeabstrahlung zu kaschieren (Rentiere flüchten deshalb manchmal im Sommer auf Schneeflächen).
Therapiemaßnahmen
Die Primärtherapie stellt das Entfernen des Parasiten durch Körperpflege dar. Bei stärkerem Befall sind Waschzusätze sinnvoll (Lausmittel). In hartnäckigen Fällen werden chirurgische Maßnahmen zur Entfernung nötig.
Infolge der meist erfolgenden Speichelabgabe des Ektoparasiten in die Wunde werden einerseits meist Proteine oder andere Allergene übertragen, andererseits oft Krankheitserreger. Die Allergene lösen eine Immunreaktion unter lokaler Histaminfreisetzung und Entzündung der Bissstelle aus, die irritierend bis schmerzhaft sein kann, selten kann auch eine allergische Reaktion eintreten, die ärztlich behandelt werden muss.
Die Folgen einer durch hämatophage Parasiten des Menschen übertragenen Infektion und ihre medikamentöse Behandlung stellen manchmal eine ernste und langfristige medizinische Herausforderung dar.
Sonstiges: Blutgeruch
Ob Blutgeruch (Wahrnehmung von Geruch, der von Blut stammt oder diesem ähnelt) hämatophage Organismen anzieht, ist nicht beschrieben. Für einige Aas- und Fleischfresser jedoch ist die Witterung von Blut bekannt:
Raubfische wie Haie sind bekannt dafür, durch blutende Köder angelockt zu werden.[32] Eine Welsart in Amazonien, Cetopsis candiru, zu den Walwelsen (Cetopsidae) gehörend, ernährt sich von toten oder sterbenden größeren Fischen und von Kadavern im Wasser treibender Säugetiere, indem sie in die Bauchdecke ein Loch fressen und die Tiere von innen auffressen.[33] Sie folgen dabei dem Aas- und Blutgeruch und stehen im Verdacht, für Überfälle auf badende Frauen, vor allem während der Menstruation, verantwortlich zu sein.[34]
Besonders verräterisch für Raubtiere ist der flüchtige Stoff trans-4,5-Epoxy-(E)-2-decenal aus dem Blut.[35]
Weblinks
Literatur
Lexikon der Biologie. 7. Band. Spektrum Akademischer Verlag, Heidelberg 2004, ISBN 3-8274-0332-4.
Einzelnachweise
- Bekure: Maasai Herding: An analysis of the livestock production system of Maasai pastoralists in Eastern Kajiado District, Kenya. ILRI, Solomon Bekure (Herausgeber), Band 4, 1991
- Jan Borm, Jean Malaurie: Walroßsuppe, Seehundblut. In: Lettre International, 2002, S. 80.
- Leitsätze Fleisch Nr.2.232 (PDF) Deutsches Lebensmittelbuch
- Text der Odyssee, 18.Gesang, Zeilen 44-47. Gutenberg-DE „Hier sind Ziegenmagen, mit Fett und Blute gefüllet /Die wir zum Abendschmaus auf glühende Kohlen geleget./ Wer nun am tapfersten kämpft, und seinen Gegner besieget /Dieser wähle sich selbst die beste der bratenden Würste“
- T. S. Adams: Hematophagy and hormone release. In: Annals of the Entomological Society of America. Band 92, Nr. 1, 1999, S. 1–13, doi:10.1093/aesa/92.1.1.
- Andrezza Campos Chagas et al.: Anticoagulant activity in salivary gland homogenates of Thyrsopelma guianense (Diptera: Simuliidae), the primary vector of onchocerciasis in the Brazilian Amazon. In: Memorias do Instituto Oswaldo Cruz, Band 105, Nr. 2, 2010, S. 174–178.
- Meir Rigbi et al.: The saliva of the medicinal leech Hirudo medicinalis II. Inhibition of platelet aggregation and of leukocyte activity and examination of reputed anaesthetic effects. In: Comparative Biochemistry and Physiology Part C: Comparative Pharmacology, Band 88, Nr. 1, 1987, S. 95–98.
- B. M. Manship, A. J. Walker, L. A. Jones, A. J. Davies: Blood feeding in juvenile Paragnathia formica (Isopoda: Gnathiidae): biochemical characterization of trypsin inhibitors, detection of anticoagulants, and molecular identification of fish hosts. In: Parasitology, Band 139, Nr. 6, 2012, S. 744–754, doi:10.1017/S0031182011002320.
- Kenneth R. Stark, Anthony A. James: Isolation and characterization of the gene encoding a novel factor Xa-directed anticoagulant from the yellow fever mosquito, Aedes aegypti. In: Journal of Biological Chemistry, Band 273, Nr. 33, 1998, S. 20802–20809.
- C. Hawkey: Plasminogen activator in saliva of the vampire bat Desmodus rotundus. In: Nature, Band 211, 1966, S. 434–435, PMID 5967844.
- R. Lucius, B. Loos-Frank: Biologie von Parasiten, Berlin, Heidelberg 2008, ISBN 978-3-540-37707-8
- Peter Wenk, Alfons Renz: Parasitologie: Die Biologie der Humanparasiten, Thieme-Verlag, Stuttgart 2008, ISBN 978-3-13-149901-1
- A. E. Brehm: Illustriertes Tierleben Band 6, 1869, Hildburghausen.
- Dania Richter: Stechvorgang gefilmt, Schema-Animation des Stechvorganges und räumliche rasterelektronenmikroskopische Aufnahme des Stechapparates (Skripte von lifescience.com und brightcove.com müssen gestattet werden), abgerufen 1. November 2013.
- Dania Richter, Franz-Rainer Matuschka, Andrew Spielman, L. Mahadevan: How ticks get under your skin: insertion mechanisms of the feeding apparatus of Ixodes ricinus ticks. In: Proc. R. Soc. B, Band 280, Nr. 1773, 22. Dezember 2013. doi:10.1098/rspb.2013.1758.
- Daniel E. Sonenshine, Jennifer M. Anderson: Mouthparts and digestive system. In: Daniel E. Sonenshine, R. Michael Roe (Hrsg.): Biology of Ticks. 2. Auflage. Volume 1. Oxford University Press, 2013, ISBN 0-19-974405-X
- Robert M. K. W. Lee, D. A. Craig: The labrum and labral sensilla of mosquitoes (Diptera: Culicidae): a scanning electron microscope study. In: Canadian Journal of Zoology, Band 61, Nr. 7, 1983, S. 1568–1579, doi:10.1139/z83-211 mit vielen SEM-Abbildungen.
- Joerg Graf: Symbiosis of Aeromonas veronii biovar sobria and Hirudo medicinalis, the medicinal leech: a novel model for digestive tract associations. In: Infection and Immunity, Band 67, Nr. 1, 1999, S. 1–7.
- José M. C. Ribeiro, Ivo M. B. Francischetti: Role of arthropod saliva in blood feeding: Sialome and post-sialome perspectives. In: Annual Review of Entomology, Band 48, Nr. 1, 2003, S. 73–88, doi:10.1146/annurev.ento.48.060402.102812.
- E. W. Cupp, M. S. Cupp, J. M. C. Ribeiro, S. E. Kunz: Blood-Feeding Strategy of Haematobia irritans (Diptera: Muscidae). In: Journal of Medical Entomology. Band 35, Nr. 4, 1998, S. 591–595, doi:10.1093/jmedent/35.4.591.
- J. M. C. Ribeiro, E. S. Garcia: The role of the salivary glands in feeding in Rhodnius Prolixus. In: J Exp Biol, Band 94, 1980, S. 219–230.
- Frank W. Fisk: Studies on proteolytic digestion in adult Aedes aegypti mosquitoes. In: Annals of the Entomological Society of America, Band 43, Nr. 4, 1950, S. 555–572.
- William A. Wimsatt: Transient behavior, nocturnal activity patterns, and feeding efficiency of vampire bats (Desmodus rotundus) under natural conditions. In: Journal of Mammalogy. 1969, S. 233–244, doi:10.2307/1378339, JSTOR 1378339.
- William N. McFarland, William A. Wimsatt: Renal function and its relation to the ecology of the vampire bat, Desmodus rotundus. In: Comparative Biochemistry and Physiology, Band 28, Nr. 3, 1969, S. 985–1006.
- Tawfik Hefnawy: Biochemical and Physiological Studies of Certain Ticks (Ixodoidea). Osmotic Pressure of Hemolymph and Gut and Coxal Fluids during the Gonotrophic Cycle of Argas (Persicargas) persicus (Oken) and A. (P.) arboreus Kaiser, Hoogstraal, and Kohls (Argasidae). In: Journal of Parasitology. Band 58, Nr. 6, 1. Januar 1972, S. 1197–1200, doi:10.2307/3278164, JSTOR:3278164.
- Guoli Zhou et al.: Fate of blood meal iron in mosquitoes. In: Journal of Insect Physiology, Band 53, Nr. 11, 2007, S. 1169–1178.
- Marion Steinbüchel: Molekulare Mechanismen der Plasmodium-Anopheles Interaktionen. 2006.
- J. A. Salinas-Melendez et al.: Prevalence of antibodies against Borrelia burgdorferi in dogs from Monterrey, Mexico. (Memento des Originals vom 26. September 2013 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis. In: Journal of Animal and Veterinary Advances, Band 10, Nr. 20, 2011, S. 2720–2723.
- Francois Delaporte: Chagas disease: history of a continent’s scourge In: History of a Continent’s Scourge. Fordham Univ. Press, 2012.
- Gerald Kerth et al.: Social interactions among wild female Bechstein’s bats (Myotis bechsteinii) living in a maternity colony. In: Acta Ethologica, Band 5, Nr. 2, 2003, S. 107–114, doi:10.1007/s10211-003-0075-8.
- Tom L. Burst, Michael R. Pelton: Black bear mark trees in the Smoky Mountains. In: Bears: Their Biology and Management, 1983, S. 45–53.
- Irenäus Eibl‐Eibesfeldt, Hans Hass: Erfahrungen mit Haien. In: Zeitschrift für Tierpsychologie, 16, Nr. 6, 1959, S. 733–746.
- W. Goulding: Amazon. The flooded forest. BBC books, London 1989.
- E. Schraml: Pareiodon microps - ein parasitischer Wels? In: AqualogNews, Nr. 72, 2006, S. 20–21.
- Sara Nilsson, Johanna Sjöberg, Mats Amundin, Constanze Hartmann, Andrea Buettner, Matthias Laska: Behavioral responses to mammalian blood odor and a blood odor component in four species of large carnivores. In: PLoS one, Band 9, Nr. 11, 10. November 2014, e112694, doi:10.1371/journal.pone.0112694.