Propylenoxid
Propylenoxid oder 1,2-Epoxypropan (PO) ist eine heterocyclische organische Verbindung aus der Gruppe der Epoxide (Oxirane). Die leicht entflammbare, in Wasser und Alkohol lösliche, farblose Flüssigkeit besitzt einen ätherischen Geruch. Propylenoxid wird aus Propen gewonnen und hauptsächlich zur Herstellung von wasserlöslichen Propylenglycol-Derivaten verwendet, kann aber auch als Korrosionsschutzzusatz für Pestizide, Kühlflüssigkeiten und Desinfektionsmittel Verwendung finden. Das Epoxid Propylenoxid ist kein natürlich vorkommender Stoff, sein Vorkommen in der Atmosphäre wird auf Industrieemissionen und deren Weiterverarbeitung zurückgeführt.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
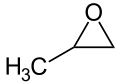 | |||||||||||||||||||
| Vereinfachte Strukturformel ohne Stereochemie | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Propylenoxid | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C3H6O | ||||||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit etherischem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 58,08 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte |
0,83 g·cm−3 (20 °C)[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
34 °C[1] | ||||||||||||||||||
| Dampfdruck | |||||||||||||||||||
| Löslichkeit |
gut in Wasser (681 g·l−1 bei 20 °C)[1] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Zulassungsverfahren unter REACH |
besonders besorgniserregend: krebserzeugend, erbgutverändernd (CMR)[3] | ||||||||||||||||||
| MAK | |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Thermodynamische Eigenschaften | |||||||||||||||||||
| ΔHf0 |
−123,0 kJ/mol (l) | ||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Darstellung und Gewinnung
1985 belief sich die Produktion von Propylenoxid weltweit auf etwa 2,9 Mt, 1991 auf etwa 4,2 Mt, 2001 ca. 4,8 Mt und 2008 rund 5,5 Mt. Die installierte weltweite jährliche Produktionskapazität lag am 1. Januar 2002 bei 5,8 Mt.[6]
Eine Direktoxidation von Propen mit Sauerstoff zu Propylenoxid, wie bei der Herstellung von Ethylenoxid aus Ethen, ist zwar technisch möglich, aber unwirtschaftlich, weil die Reaktion mit einer geringen Selektivität und unter Bildung mehrerer Oxidationsprodukte abläuft, die aufwendig getrennt werden müssten. Typische Nebenprodukte sind Acetaldehyd, Formaldehyd sowie Kohlenmonoxid und deren Oxidationsfolgeprodukte.[7] Insofern haben sich die im Folgenden beschriebenen Verfahren durchgesetzt.
Chlorhydrinverfahren
Beim Chlorhydrinverfahren wird aus Propen mit Chlor und Wasser (wobei Hypochlorige Säure in situ erzeugt wird) ein Isomerengemisch von 1-Chlor-2-propanol und 2-Chlor-1-propanol erzeugt. In einem zweiten Reaktionsschritt werden diese Isomere mit Hydroxidionen zu Propylenoxid und Wasser umgesetzt. Die Hydroxidionen werden aus Kalkmilch (Ca(OH)2) gewonnen, so dass als Folgeprodukt Calciumchlorid (CaCl2) anfällt (auf 100 kg Propylenoxid kommen 200 kg Calciumchlorid). Dieses führt zu einer großen Abwasserbelastung.
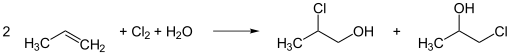
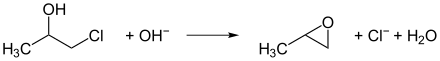
Der Propylenoxid-Herstellkapazitätsanteil nach dem Chlorhydrinverfahren lag 1985 weltweit bei rund 55 %, 1991 bei etwa 52 % und 2010 nur noch bei rund 34 %.
Oxiran-Verfahren (Prileschajew-Reaktion)
Die Epoxidierung von Propen erfolgt bei der Prileschajew-Reaktion über die katalytische Umsetzung mit einem Hydroperoxid, dessen stark reaktionsfreudige Peroxidgruppe mit der Doppelbindung des Propens reagiert.
In der Styrol-Variante wird Ethylbenzol mit Sauerstoff in das entsprechende Peroxid überführt, das mit Propen zu Propylenoxid reagiert. Das parallel entstehende 1-Phenylethanol (Phenylmethylcarbinol) wird mit Aluminiumoxid unter Abspaltung von Wasser zu Styrol umgesetzt.
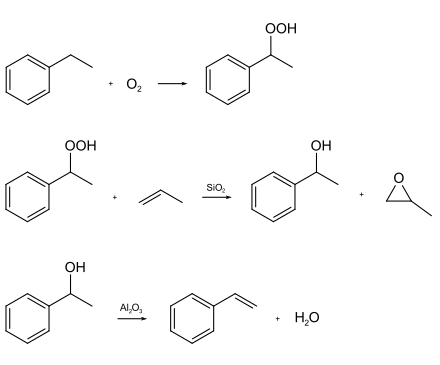
Pro Tonne produziertes Propylenoxid fallen bei diesem Verfahren ca. 1,8 Tonnen Styrol als Koppelprodukt an.
In der iso-Butan-Variante wird iso-Butan durch Oxidation in tert-Butylhydroperoxid überführt, das mit Propen zu Propylenoxid und tert-Butanol reagiert. Das tert-Butanol kann anschließend durch Dehydratisierung in iso-Buten und dieses mit Wasserstoff wieder in iso-Butan zurückgeführt werden.
HPPO-Verfahren
Bei diesem der Prileschajew-Reaktion ähnlichen Verfahren erfolgt die Umsetzung des Propylens mit Wasserstoffperoxid (engl. Kürzel HP):
Da als einziges Folgeprodukt Wasser entsteht, gilt dieses Verfahren als besonders wirtschaftlich und umweltfreundlich. Es benötigt eine vorgeschaltete Anlage zur Herstellung von Wasserstoffperoxid, aber muss im Gegensatz zu den anderen Verfahren keine Infrastruktur oder Märkte für Nebenprodukte aufweisen. Die koreanische SKC hat in Ulsan (Südkorea) im Jahr 2008 die weltweit erste großtechnische Anlage zur Herstellung für Propylenoxid nach dem Evonik/Uhde-HPPO-Verfahren in Betrieb genommen.[8] Die Anlage hat eine Kapazität von 100.000 Tonnen jährlich. Eine weitere, deutlich größere Anlage, die ein ähnliches Verfahren nutzt, wurde 2008 in Antwerpen errichtet und wird gemeinsam von BASF und Dow Chemical betrieben.[9] Dow Chemical nimmt 2016 in Jubail eine weitere Großanlage in Betrieb.
Enantiomerenreines Propylenoxid
Die Synthese der Propylenoxidenantiomeren geht vom (R)- bzw. (S)-Alanin aus. Dieses wird zunächst unter Retention mit Natriumnitrit und Salzsäure zur 2-Chlorpropionsäure umgesetzt. Nach Reduktion mit Lithiumaluminiumhydrid zum Alkohol und Ringschluss mittels Natriumhydroxid unter Inversion werden das (S)- bzw. (R)-Propylenoxid erhalten.[10]
Eigenschaften
Physikalische Eigenschaften
Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 4,09487, B = 1065,27 und C = −46,86 im Temperaturbereich von 199,7 bis 307,4 K.[11]
Zusammenstellung der wichtigsten thermodynamischen Eigenschaften Eigenschaft Typ Wert [Einheit] Bemerkungen Standardbildungsenthalpie ΔfH0liquid
ΔfH0gas−122,6 kJ·mol−1[12]
−94,68 kJ·mol−1[12]als Flüssigkeit
als GasVerbrennungsenthalpie ΔcH0liquid −1917,4 kJ·mol−1[12] Wärmekapazität cp 125,1 J·mol−1·K−1 (25 °C)[13]
75,55 J·mol−1·K−1 (25 °C)[14]als Flüssigkeit
als GasKritische Temperatur Tc 482,3 K[15] Kritischer Druck pc 49,23 bar[15] Kritisches Volumen ρc 0,186 l·mol−1[15] Schmelzenthalpie ΔfH0 6,569 kJ·mol−1[13] beim Schmelzpunkt Verdampfungsenthalpie ΔVH0 30,1 kJ·mol−1[11] beim Normaldrucksiedepunkt
Chemische Eigenschaften
Propylenoxid neigt weniger stark zur Selbstpolymerisation als Ethylenoxid, eine solche kann jedoch säurekatalysiert von Katalysatoren wie den Salzen Aluminium-, Eisen- oder Zinnchlorid, sowie allen Säuren und Alkalimetallen initiiert werden und explosionsartig erfolgen. Die Polymerisationswärme beträgt −76 kJ·mol−1 bzw. −1310 kJ·kg−1.[16] Mit Wasser erfolgt in der Kälte langsame, bei hohen Temperaturen von 200–220 °C rasche Hydrolyse zu 1,2-Propandiol (Propylenglycol).
Sicherheitstechnische Kenngrößen
Propylenoxid bildet leicht entzündliche Dampf-Luft-Gemische. Die Verbindung hat einen Flammpunkt von −38 °C.[1] Der Explosionsbereich liegt zwischen 1,9 Vol.‑% (45 g/m³) als untere Explosionsgrenze (UEG) und 38,8 Vol.‑% (938 g/m³) als obere Explosionsgrenze (OEG).[17][1] Eine Korrelation der Explosionsgrenzen mit der Dampfdruckfunktion ergibt einen unteren Explosionspunkt von −44 °C.[1] Der maximale Explosionsdruck beträgt 9,1 bar.[1][17] Die Grenzspaltweite wurde mit 0,7 mm (50 °C) bestimmt.[1][17] Es resultiert damit eine Zuordnung in die Explosionsgruppe IIB.[1] Mit einer Mindestzündenergie von 0,13 mJ sind Dampf-Luft-Gemische extrem zündfähig.[1] Die Zündtemperatur beträgt 430 °C.[1][17] Der Stoff fällt somit in die Temperaturklasse T2.
Toxizität
Propylenoxid hat sich in Tierversuchen als karzinogen (krebserzeugend) und mutagen (erbgutverändernd) erwiesen. Der auch akut gesundheitsschädliche Stoff reizt Haut, Augen und Atemwege, seine Dämpfe wirken narkotisch; zu einer gesundheitsschädlichen Kontamination der Luft kann es bereits bei Temperaturen um 20 °C kommen. Seine Aufnahme kann oral, pulmonal oder perkutan, also über die Haut, erfolgen. Bei kontinuierlicher oder wiederholter Exposition kann es zur Sensibilisierung kommen. Als Meeresschadstoff ist die Substanz in die Wassergefährdungsklasse 3 eingeordnet.
Tierversuche zeigen, dass das Einatmen von Propylenoxid bis zu einer Konzentration von 150 ppm keinerlei nachweisbare Auswirkung hat. Bei wiederholtem Kontakt der Tiere mit dem Stoff kam es zur Depression des ZNS und Augen- und Atemwegsreizung. Da die Geruchsschwelle in der Luft zwischen 100 und 350 ppm, die maximal zulässige Arbeitsplatzkonzentration jedoch bei nur 2,5 ppm liegt, ist der charakteristische Geruch des Stoffes kein ausreichender Indikator für Propylenoxid.
Weiteres
Propylenoxid ist das erste chirale Molekül, das außerhalb des Sonnensystems nachgewiesen wurde.[18][19][20]
Literatur
- Wolfgang Swodenk, Helmut Waldmann: Moderne Verfahren der Großchemie: Ethylenoxid und Propylenoxid. In: Chemie in unserer Zeit. 12. Jahrg. Nr. 3, 1978, S. 65–70. doi:10.1002/ciuz.19780120302
Weblinks
- www.petrochemistry.net: Richtlinien für die Distribution von Propylenoxid (PDF-Datei; 1,1 MB)
Einzelnachweise
- Eintrag zu Propylenoxid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- Eintrag zu Methyloxirane im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Eintrag in der SVHC-Liste der Europäischen Chemikalienagentur, abgerufen am 17. Juli 2014.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 75-56-9 bzw. 1,2-Epoxypropan), abgerufen am 15. September 2019.
- CRC-Handbook 90. Aufl. (2009–2010), S. 5–24 (Memento vom 26. April 2015 im Internet Archive). – siehe auch Eintrag zu Propylenoxid. In: P. J. Linstrom, W. G. Mallard (Hrsg.): NIST Chemistry WebBook, NIST Standard Reference Database Number 69. National Institute of Standards and Technology, Gaithersburg MD, abgerufen am 22. März 2010..
- CEH report Propylene Oxide
- Karl Hans Simmrock: Die Herstellungsverfahren für Propylenoxid und ihre elektrochemische Alternative. In: Chemie Ingenieur Technik. 48, 1976, S. 1085–1096. doi:10.1002/cite.330481203.
- Weltweit erste HPPO-Anlage nach Lizenz von Evonik und Uhde bei SKC, Korea, erfolgreich in Betrieb genommen. auf chemie.de, 29. Juli 2008.
- BASF, Dow und Solvay setzen neue innovative HPPO-Technologie in Antwerpen ein (PDF; 23 kB).
- V. Schurig, B. Koppenhofer, W. Bürkle: Korrelation der absoluten Konfiguration chiraler Epoxide durch Komplexierungschromatographie; Synthese und Enantiomerenreinheit von (+)-(R)- und (−)-(S)-1,2-Epoxypropan. In: Angew. Chem. 90, 1978, S. 993–995.
- R. A. McDonald, S. A. Shrader, D. R. Stull: Vapor Pressures and Freezing Points of Thirty Pure Organic Compounds. In: J. Chem. Eng. Data. 4, 1959, S. 311–313, doi:10.1021/je60004a009.
- G. C. Sinke, D. L. Hildenbrand: Heat of formation of propylene oxide. In: J. Chem. Eng. Data. 7, 1962, S. 74.
- R. H. Beaumont, B. Clegg, G. Gee, J. B. M. Herbert, D. J. Marks, R. C. Roberts, D. Sims: Heat capacities of propylene oxide and of some polymers of ethylene and propylene oxides. In: Polymer. 7, 1966, S. 401–416.
- J. Chao: Thermodynamic properties of key organic oxygen compounds in the carbon range C1 to C4. Part 2. Ideal gas properties. In: J. Phys. Chem. Ref. Data. 15, 1986, S. 1369–1436, doi:10.1063/1.555769.
- K. A. Kobe, A. E. Ravicz, S. P. Vohra: Critical Properties and Vapor Pressures of Some Ethers and Heterocyclic Compounds. In: J. Chem. Eng. Data. 1, 1956, 50.
- Berufsgenossenschaft Rohstoffe und chemische Industrie, Merkblatt R 008 Polyreaktionen und polymerisationsfähige Systeme. Ausgabe 05/2015, ISBN 978-3-86825-069-5.
- E. Brandes, W. Möller: Sicherheitstechnische Kenngrößen. Band 1: Brennbare Flüssigkeiten und Gase. Wirtschaftsverlag NW – Verlag für neue Wissenschaft, Bremerhaven 2003.
- Brett A. McGuire, P. Brandon Carroll, Ryan A. Loomis, Ian A. Finneran, Philip R. Jewell: Discovery of the interstellar chiral molecule propylene oxide (CH3CHCH2O). In: Science. 14. Juni 2016, S. aae0328, doi:10.1126/science.aae0328, PMID 27303055 (sciencemag.org [abgerufen am 15. Juni 2016]).
- Thorsten Dambeck: Milchstraße: Forscher entdecken erstes Spiegelmolekül im All. In: Spiegel online. Abgerufen am 15. Juni 2016.
- Harald Frater: Erstes chirales Molekül im All entdeckt: Propylenoxid kommt in galaktischer Molekülwolke zwei Varianten vor. In: www.scinexx.de. Abgerufen am 17. Juni 2016.


