Formamid
Formamid ist das Amid der Ameisensäure und das einfachste Carbonsäureamid.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
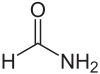 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Formamid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | CH3NO | |||||||||||||||
| Kurzbeschreibung |
farblose bis gelbliche Flüssigkeit mit ammoniakartigem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 45,04 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
1,13 g·cm−3 (20 °C)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
210 °C[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
vollständig mischbar mit Wasser[1] | |||||||||||||||
| Brechungsindex |
1,4472 (20 °C)[2] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Zulassungsverfahren unter REACH |
besonders besorgniserregend: fortpflanzungsgefährdend (CMR)[4] | |||||||||||||||
| MAK |
Schweiz: 10 ml·m−3 bzw. 18 mg·m−3[5] | |||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
−254,0 kJ/mol[6] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Herstellung
Großtechnisch wird Formamid durch Umsetzung von Kohlenmonoxid mit Ammoniak hergestellt.[7] Hierbei reagiert zunächst das Kohlenmonoxid mit Methanol zu Ameisensäuremethylester. Dieses wird anschließend mit Ammoniak umgesetzt, wobei das freiwerdende Methanol zur ersten Reaktionsstufe zurückgeführt wird.
Formamid kann in kleinen Mengen bei der Produktion von Amphetamin anfallen.
Eigenschaften
Physikalische Eigenschaften
Bei Raumtemperatur liegt die Substanz als farb- und geruchlose Flüssigkeit vor. Sie ist hygroskopisch und wirkt als Löse- und Reduktionsmittel.
Chemische Eigenschaften
Formamid ist bei Temperaturen oberhalb 185 °C instabil.[8] Bei 185 °C spaltet es rein thermisch (ohne Katalysatoren) in Kohlenmonoxid, Kohlendioxid und Ammoniak, ohne dass Blausäure nachgewiesen wird. Bei 220 °C ist die Bildung von Ammoniak verstärkt, während sich Blausäure ebenfalls bildet. Mit zunehmender Temperatur nimmt die Bildung von Ammoniumcarbonat, Ammoniumhydrogencarbonat und Ammoniumcarbamat zu, wobei Letzteres besonders leicht aus wasserfreiem Ammoniak mit Kohlendioxid gebildet wird. Bei längerer thermischer Belastung bildet sich ein schwarzer, unlöslicher Feststoff, der identisch mit polymerer Blausäure ist und aus dem Purin isoliert werden konnte.[8] Dieses Polymer (Rückstand) bildet ab 360 °C ebenfalls Blausäure sowie Isocyansäure. Außerdem bildet sich aus Formamid Isocyanursäure durch thermische Belastung.
Zur Herstellung von Blausäure aus Formamid durch Abspaltung von Wasser werden Katalysatoren verwendet, die die erwünschte Reaktion beschleunigen, während die thermische Spaltung, die zu unerwünschten Produkten führt, verdrängt wird. Hierfür sind geheizte Metalloberflächen – aus Messing oder Eisen – geeignet, die mit einer Metalloxidschicht, etwa aus Zink-, Aluminium-, Magnesium-, Chrom- oder Zinnoxiden überzogen sind, oder auch gesinterte Formkörper aus Aluminiumoxid und Siliciumdioxid oder solche aus Chrom-Nickel-Edelstahl.[9][10][11][12] Ab Temperaturen zwischen 300 und 600 °C und bei Verwendung von gasförmigem Formamid eignen sich auch dehydrierende Metallkatalysatoren aus Stahl (Basis: Eisen mit Anteilen von Chrom und Nickel, geeignete Stahlqualitäten sind unter anderem 1.4541, 1.4571, 1.4573, 1.4580, 1.4401, 1.4404, 1.4435, 2.4816, 1.3401, 1.4876, 1.4762) mit großer innerer Oberfläche für die katalytische Umsetzung und zeigen dabei hohe Selektivitäten und Umsätze (> 90 %) bei Standzeiten von 500 bis 8000 Stunden.[13]
Vorkommen
Formamid ist das einfachste Amid und überall (ubiquitär) im Universum vorhanden.[14] Es wurde in den Kometen Hale-Bopp und Hyakutake sowie im galaktischen Zentrum von Sagittarius A* und generell in der interstellaren Materie nachgewiesen.
Verwendung
Formamid wird hauptsächlich durch Reaktion mit Schwefelsäure zur industriellen Synthese von Ameisensäure und Ammoniumsulfat verwendet. Weiterhin wird es in der Formamid-Vakuum-Synthese durch Pyrolyse zu Cyanwasserstoff verarbeitet. Es wird zudem als Zwischenprodukt für die Herstellung von Arzneistoffen und Fungiziden, etwa von Theophyllin oder Theobromin oder als Katalysator in Carbonylierungs-Reaktionen eingesetzt.[15]
Formamid ist ein häufig verwendetes Lösungsmittel, etwa für Lacke, bestimmte Polymere und Beize sowie Tinte in Filzstiften.[15]
Wichtigster Produzent für Formamid ist die BASF mit einer Produktionskapazität von 100.000 Tonnen pro Jahr (Stand 1998), der Großteil des produzierten Formamides wird direkt am Ort der Herstellung weiterverarbeitet.[15]
Einzelnachweise
- Eintrag zu Formamid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-262.
- Eintrag zu Formamide im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. Februar 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Eintrag in der SVHC-Liste der Europäischen Chemikalienagentur, abgerufen am 16. Juli 2014.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 75-12-7 bzw. Formamid), abgerufen am 2. November 2015.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-20.
- Hans-Jürgen Arpe: Industrielle Organische Chemie: Bedeutende Vor- und Zwischenprodukte. ISBN 978-3-527-31540-6, S. 49.
- F. Cataldo, E. Lilla, O. Usrini, G. Angelini: TGA-FT-IR Study of pyrolysis of poly(hydrogen cyanide) synthesized from thermal decomposition of formamide. Implications in cometary emissions. In: Journal of Analysis and Applied Pyrolysis. 87, 2010, S. 34–44, doi:10.1016/j.jaap.2009.10.002.
- Patent US7294326: Dehydration of formamide to produce hydrocyanic acid. Veröffentlicht am 2. Juni 1936.
- Patent US2042451: Hydrocyanic acid consisting of formamide. Veröffentlicht am 25. Mai 2006.
- Patent WO2004050587A2: Blausäure aus Formamid. Angemeldet am 3. Dezember 2003, veröffentlicht am 17. Juni 2004.
- Patent EP1791787: Verfahren zur Herstellung von Blausäure. Veröffentlicht am 15. April 2010.
- Patent EP1575870B1: Blausäure aus Formamid. Veröffentlicht am 20. Oktober 2010.
- R. Saladino, C. Crestini, S. Pino, G. Costanzo, E. Di Mauro: Formamide and the origin of life. In: Physics of Life Reviews. 9, 2012, S. 84–104, doi:10.1016/j.plrev.2011.12.002, PMID 22196896.
- Hansjörg Bipp, Heinz Kieczka: Formamides. In: Ullmann’s Encyclopedia of Industrial Chemistry. Wiley-VCH, Weinheim 2012 doi:10.1002/14356007.a12_001.pub2.
