Solvay-Verfahren
Das Solvay-Verfahren oder auch Ammoniak-Soda-Verfahren ist ein chemischer Prozess zur Herstellung von Natriumcarbonat (Na2CO3). Es wurde 1860 von Ernest Solvay entwickelt und löste das bis dahin verwendete Leblanc-Verfahren ab.
Weltweit bedeutendster Produzent ist der Chemiekonzern Solvay mit sieben Millionen Tonnen pro Jahr Natriumcarbonat (2010)[1], die überwiegend zum wichtigsten Waschmittelbestandteil Natriumpercarbonat umgesetzt werden.[2]
Stoffbilanz
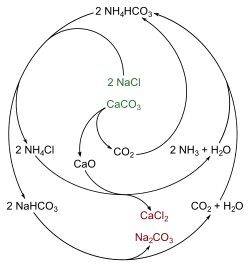
Der Prozess geht von den billigen und in großen Mengen vorhandenen Rohstoffen Kalk (Calciumcarbonat) und Kochsalz (Natriumchlorid) aus, deren Reaktion zu Soda und Calciumchlorid
jedoch nicht freiwillig abläuft, da die Rückreaktion zu den Ausgangsstoffen Calciumcarbonat und Natriumchlorid
die thermodynamisch bevorzugte ist. Zur Realisierung der Hinreaktion wird daher beim Solvay-Verfahren ein weiterer Stoff, Ammoniak, mit ins Spiel gebracht, der in der letztendlichen Stoffbilanz dann aber wieder fehlt: Denn das Solvay-Verfahren arbeitet als chemischer Kreisprozess, bei dem das zugesetzte Ammoniak in einem geschlossenen Kreislauf verbleibt und Umweltbelastungen der Größenordnung des Leblanc-Verfahrens vermieden werden können.
Das Solvay-Verfahren hat aber auch Nachteile: Es verbraucht große Mengen an Wasser und erzeugt pro Kilogramm Soda immer noch ca. 1 Kilogramm unverwendbares Calciumchlorid, das ins Abwasser, und damit in Flüsse und Meere, abgegeben wird. Zur Reduzierung der Wasserverschmutzung gibt es auch Absetzbecken (Kalkteiche), z. B. in Latdorf bei Bernburg[3], wo das Oberflächenwasser wieder in den Fluss Saale geleitet wird. Bei der Produktion von 1 Million Tonnen Soda jährlich entstehen also auch etwa 1 Million Tonnen Calciumchlorid. Diese Menge entspricht täglich drei 1000-Tonnen-Güterzügen.
Das Verfahren im Detail
Die einzelnen Schritte des Verfahrens sind:
1. Der Kalk wird gebrannt:
- Calciumcarbonat zersetzt sich in der Hitze zu Calciumoxid ("Gebrannter Kalk") und Kohlenstoffdioxid.
2. Kohlenstoffdioxid wird zusammen mit Ammoniak in eine konzentrierte Kochsalzlösung eingeleitet. Hierbei fällt Natriumhydrogencarbonat aus, das von der entstehenden Ammoniumchloridlösung getrennt wird.
- Kochsalz reagiert mit Kohlenstoffdioxid, Ammoniak und Wasser zu Natriumhydrogencarbonat ("Natron") und Ammoniumchlorid ("Salmiak").
- Die einzelnen Teilschritte:
- Kohlenstoffdioxid und Wasser reagieren zu Kohlensäure...
- ...die wiederum mit Ammoniak zu Ammoniumhydrogencarbonat...
- ...das wiederum reagiert dann mit Kochsalz zu Natriumhydrogencarbonat ("Natron") und Ammoniumchlorid ("Salmiak").
3. Das Natriumhydrogencarbonat wird auf ca. 200 °C erhitzt, wobei Wasser und Kohlenstoffdioxid entweichen. Übrig bleibt dann das Produkt Soda. Dieser Vorgang wird als Kalzinierung (kalzinieren) bezeichnet.
- Natriumhydrogencarbonat spaltet in der Hitze Wasser und Kohlenstoffdioxid ab, wodurch Soda entsteht.
4. Im vierten Schritt wird das Ammoniak wiedergewonnen und Schritt 2 zugeführt:
- Das Ammoniumchlorid aus Reaktion 2 wird mit dem gebrannten Kalk aus Reaktion 1 zu Ammoniak, Calciumchlorid und Wasser umgesetzt.
Einzelnachweise
Weblinks
- Prozessschema (PDF-Datei; 966 kB)