DIOP
DIOP ist eine Abkürzung für die chemische Verbindung O-Isopropyliden-2,3-dihydroxy-1,4-bis(diphenylphosphino)butan.
| Strukturformel | ||||||||||
|---|---|---|---|---|---|---|---|---|---|---|
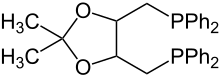 | ||||||||||
| Vereinfachte Strukturformel ohne Stereochemie | ||||||||||
| Allgemeines | ||||||||||
| Name | DIOP | |||||||||
| Andere Namen |
| |||||||||
| Summenformel | C31H32O2P2 | |||||||||
| Kurzbeschreibung |
weißer Feststoff[1] | |||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||
| ||||||||||
| Eigenschaften | ||||||||||
| Molare Masse | 498,53 g·mol−1 | |||||||||
| Aggregatzustand |
fest | |||||||||
| Schmelzpunkt | ||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser[1] | |||||||||
| Sicherheitshinweise | ||||||||||
| ||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||
Isomere
DIOP ist eine Verbindung, die in zwei verschieden optisch aktiven, chiralen Formen vorkommt, als (−)- und als (+)-Enantiomer. Bei Reaktionen mit ebenfalls chiralen Molekülen kann durch Einsatz eines der beiden Isomere eine hohe Selektivität erreicht werden.
| Enantiomere von DIOP | ||
| Name | (–)-DIOP | (+)-DIOP |
| Strukturformel | -(%E2%80%93)-DIOP_Structural_formula_V1.svg.png.webp) |
-(%252B)-DIOP_Structural_formula_V1.svg.png.webp) |
| CAS-Nummer | 32305-98-9 | 37002-48-5 |
| 53531-20-7 (unspez.) | ||
| EG-Nummer | 250-984-2 | 253-307-9 |
| – (unspez.) | ||
| ECHA-Infocard | 100.046.334 | 100.048.446 |
| – (unspez.) | ||
| PubChem | 395120 | 3084647 |
| 122582 (unspez.) | ||
| Wikidata | Q27277348 | Q27262677 |
| Q1153847 (unspez.) | ||
Daneben gibt es noch ein drittes Stereoisomer meso-DIOP, das aber nur eine geringe Bedeutung besitzt.
Geschichte und Bedeutung
DIOP war der bidentate Diphosphin-Ligand, der den Durchbruch bidentater Liganden in der homogenen asymmetrischen Hydrierung einleitete. Bis zum Beginn der 1970er-Jahre wurden hauptsächlich chirale monodentate Phosphine verwendet, die allerdings nur sehr geringe Enantioselektivitäten induzierten und synthetisch schwer zugänglich waren. Henri Kagan et al. entwickelten mit DIOP ein neues Konzept basierend auf bidentaten Liganden, die einfach zugänglich waren.[3] Der Grundkörper von DIOP ist Weinsäure, die aus dem chiralen Pool erhältlich ist. Der Einsatz von DIOP in der enantioselektiven Rhodium-katalysierten Hydrierung von Dehydroaminosäuren erwies sich als günstig, da Enantioselektivitäten von bis zu 83 % ee (Enantiomerenüberschuss) möglich waren.
Darstellung
Der chirale Phosphin-Ligand DIOP wird ausgehend von der in der Natur verfügbaren Weinsäure (im sogn. „Chiral Pool“) hergestellt. Dabei wird entweder (R,R)- oder (S,S)-Weinsäure genutzt und nicht die entsprechende meso-Verbindung [(R,S)- identisch mit (S,R)-Weinsäure]. Die Hydroxysäure wird im ersten Schritt an den Carboxygruppen mit Methanol im Sauren zum Dimethylester umgesetzt. Anschließend werden die beiden Hydroxygruppen mit Aceton säurekatalysiert in ein Acetal umgewandelt und so geschützt. Durch Lithiumaluminiumhydrid lassen sich die Methylestergruppen zum primären Alkohol reduzieren. Die beiden neuen freien Hydroxygruppen werden mit para-Toluolsulfonsäurechlorid in das reaktionsfreudige Tosylat überführt. Durch nucleophile Substitution mit Natriumdiphenylphosphan erfolgt dann im letzten Syntheseschritt unter Abspaltung der Tosylat-Anionen die Bildung des chiralen Phosphin-Liganden.[4]
Einzelnachweise
- Datenblatt (4R,5R)-(-)-4,5-Bis(diphenylphosphinomethyl)-2,2-dimethyl-1,3-dioxolan (PDF) bei Merck, abgerufen am 5. Februar 2018.
- Datenblatt (−)-2,3-O-Isopropylidene-2,3-dihydroxy-1,4-bis(diphenylphosphino)butane bei Sigma-Aldrich, abgerufen am 5. Februar 2018 (PDF).
- T. P. Dang, H. B. Kagan. The asymmetric synthesis of hydratropic acid and amino-acids by homogeneous catalytic hydrogenation, Chem. Commun. 1971, 481–482, doi:10.1039/C29710000481.
- H. B. Kagan, Dang-Tuan-Phat: Asymmetric catalytic reduction with transition metal complexes. I. Catalytic system of rhodium(I) with (–)-2,3-O-isopropylidene-2,3-dihydroxy-1,4-bis(diphenylphosphino)butane, a new chiral diphosphine in J. Am. Chem. Soc. 94 (1972) 6429–6433, doi:10.1021/ja00773a028.
