Heck-Reaktion
Die Heck-Reaktion zählt zu den bestuntersuchten metallorganischen Reaktionen und findet breite Anwendung in der organischen Synthese. Bei ihr handelt es sich um eine Palladium-katalysierte Kupplung. Sie ermöglicht die direkte Olefinierung von Arylhalogeniden, wobei das Halogenid durch die entsprechende Alkenylgruppe ersetzt wird. Es können einfache Alkene, arylsubstituierte Alkene oder elektrophile Alkene wie Acrylester eingesetzt werden. Die Heck-Reaktion ist mit der Suzuki-Kupplung verwandt und entsprechend mechanistisch ähnlich.
Entwickelt wurde diese Reaktion 1972 von den US-amerikanischen Chemikern Richard F. Heck, nach dem sie auch benannt wurde, sowie John Paul Nolley jr. der University of Delaware. Für seine Forschungsarbeiten auf dem Gebiet der Palladium-katalysierten Kreuzkupplungen in organischer Synthese erhielt Heck 2010 zusammen mit den beiden japanischen Chemikern Ei-ichi Negishi und Akira Suzuki den Nobelpreis für Chemie.
Mechanismus
Der Katalysezyklus beginnt mit der oxidativen Addition (A) des Halogenids an die Palladium(0)-Spezies (1), wobei formal ein Palladium(II)-Komplex (2) gebildet wird, der dann über einen π-Komplex (3) in die Alken-Komponente insertiert (B). Aus der Pd(II)-σ-Zwischenstufe (4) wird zunächst das Alken (5) unter β-Hydrid-Eliminierung (C) abgespalten, dann wird durch eine reduktive Eliminierung (D) von HX aus 6 die Pd(0) Spezies (1) zurückgebildet. Das freigesetzte HX wird durch die Base gebunden.
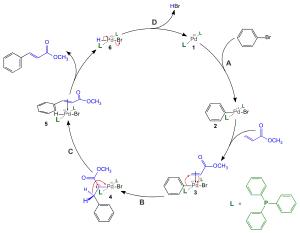
Bei der Heck-Reaktion wird selektiv die trans-substituierte Doppelbindung erhalten. Der Grund hierfür ist, dass zunächst eine syn-Addition abläuft, die abschließende β-Hydrid-Eliminierung (C) allerdings wiederum syn verläuft.

Aus diesem Grund muss zwischenzeitlich eine Rotation um die C-C-Einfachbindung ablaufen und man erhält letztendlich das trans-Produkt.
Je nachdem ob die Doppelbindung des eingesetzten Olefins Akzeptor- (EWG, electron withdrawing group) oder Donor-substituiert (EDG, electron donating group) ist, ergeben sich unterschiedliche Stereoisomere aus der Heck-Reaktion. Während Akzeptor-substituierte Olefine eher das trans-Produkt liefern, werden aus Donor-substituierten Olefinen eher Produkte mit terminaler Doppelbindung erhalten. Während diese Selektivität für Akzeptor-substituierte Olefine meist sehr hoch ist, werden im Falle von Donor-substituierten Olefinen starke Gemische aus terminaler Doppelbindung und trans-Produkt erhalten. Dies lässt sich über die Elektrophilie der kationischen Pd(II)-Spezies erklären, die im Insertionsschritt (B) selbst an die elektronreichere Position addiert. Die Pd(II)-Spezies wirkt als Lewis-Säure, die analog der Addition eines Protons an eine Doppelbindung erfolgt. Durch die Addition einer Lewis-Säure wird das benachbarte C-Atom stark positiviert. Die Addition findet so statt, dass das positivierte C-Atom besser stabilisiert wird, d. h. in α-Position zu einer EDG, aber terminal bei einer EWG. An diese Position wird dann der ans Pd gebundene Rest übertragen.
Literatur
- Richard Fred Heck, John Paul Nolley jr. (University of Delaware): Palladium-catalyzed vinylic hydrogen substitution reactions with aryl, benzyl, and styryl halides. In: J. Org. Chem. Band 37, Nr. 14, 1972, S. 2320–2322, doi:10.1021/jo00979a024 (eingegangen am 13. Januar 1972).