Prochiralität
Prochiralität ist ein von Kenneth R. Hanson im Jahr 1966 geprägter stereochemischer Begriff.[1] Er beschreibt die Eigenschaft eines planaren Moleküls, das drei verschiedene funktionelle Gruppen oder Substituenten trägt, oder eines nichtchiralen, tetraedrischen Moleküls mit höchstens zwei identischen Substituenten. Die planare Verbindung kann durch eine Additionsreaktion, die tetraedrische bei Substitution oder bei Isomerisierungsreaktion[2][3] eines der identischen Substituenten durch einen neuen Substituenten ein Chiralitätszentrum ausbilden.
Stereochemische Erklärung
Allgemeines
Eine prochirale Verbindung besitzt eine Symmetrieebene, welche die Verbindung in zwei Teile zerlegt. Die beiden Seiten werden als enantiotop bezeichnet. Je nachdem, von welcher Seite nun der Angriff erfolgt, entsteht das eine oder das andere der zwei Spiegelbilder. Wird bei der Reaktion keine der Seiten bevorzugt angegriffen, entsteht ein racemisches 1:1-Gemisch der jeweiligen Stereoisomere.
Ist zudem in einer prochiralen Verbindung noch ein Chiralitätszentrum vorhanden, wird die Verbindung in zwei diastereotope Teile zerlegt. Wieder entsteht das eine oder andere Diastereomer, je nachdem, von welcher Seite der Angriff erfolgt. Auch wenn ein prochirales Molekül an eine stereochemisch differenzierende Oberfläche oder ein Rezeptorprotein gebunden ist, sind die beiden Seiten eines planaren beziehungsweise die identischen Substituenten eines tetraedischen Moleküls nicht mehr stereochemisch gleichwertig.
Addition an ein planares Molekül mit einer Doppelbindung
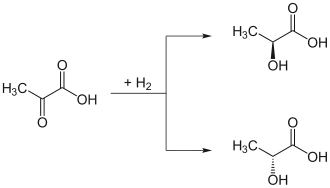
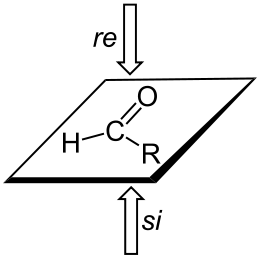
Das trigonal-planare sp2-hybridisierte Kohlenstoffatom einer organischen Verbindung kann durch Addition von HCl, Cl2, H2 etc. in ein chirales, nun sp3-hybridisiertes Kohlenstoffatom in einem Schritt überführt werden. Dabei kann der neue Substituent entweder oberhalb oder unterhalb der Molekül-Ebene eintreten. Das sp2-hybridisierte, planar substituierte Kohlenstoffatom nennt man dann prochiral. Diejenige Seite, von der aus die Verbindung (R)-konfiguriert erscheint, wird Re genannt; die andere Seite, von der aus die Verbindung (S)-konfiguriert erscheint, wird mit Si bezeichnet. Ein Angriff von der Re- bzw. Si-Seite bedeutet dabei aber nicht, dass das Produkt (R)- bzw. (S)-konfiguriert ist, vielmehr ist dies abhängig von der Priorität der vorhandenen Substituenten und der Priorität des addierten Stoffes. Ein Beispiel ist die Addition von Wasserstoff an Brenztraubensäure, wobei die chirale Milchsäure entsteht.[5]
Ersatz eines Substituenten (Stereodeskriptoren)
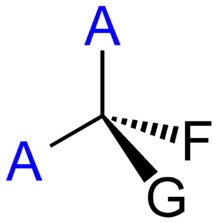
Es ist nicht notwendig, dass das prochirale Atom sp2-hybridisiert ist; es kann auch sp3-hybridisiert sein und zwei identische Substituenten (stereoheterotopen Gruppen) tragen, womit dieses Molekül ebenfalls nicht chiral ist. Im Falle solcher Verbindungen werden die Bezeichnungen pro-(R) und pro-(S) verwendet:
Demjenigen der beiden identischen Substituenten, welcher (zunächst nur in Gedanken) ersetzt wird, ordnet man willkürlich die höhere CIP-Priorität über seinen stereoheterotopen Partner zu. Alle anderen Prioritäten der Substituenten untereinander bleiben ansonsten unangetastet. Ergibt sich auf diese Weise (in Gedanken) ein (S)-konfiguriertes „Produkt“, wird der Substituent (oder die Gruppe) „pro-(S)“ genannt; und der andere mit „pro-(R)“ bezeichnet.
Aufgrund dieser Vorgehensweise ist es möglich, dass bei Substitution des pro-(S)-Substituenten ein (R)-Produkt entsteht.
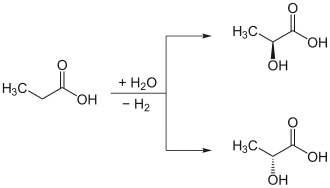
Beispielsweise entsteht aus Propionsäure durch Ersetzen eines der beiden stereoheterotopen α-Wasserstoffatome (Wasserstoffatome der Methylengruppe, –CH2–) durch eine OH-Gruppe die chirale Milchsäure.[5] Ersetzen des pro-(S)-Wasserstoffatoms der Propionsäure führt zur (S)-Milchsäure. In diesem Fall wird die oben genannte Regel, dass sich die Prioritäten der anderen Substituenten nicht ändern dürfen, verletzt. Dies geschieht jedoch gleich zweimal, da die eingeführte Hydroxygruppe nach CIP sowohl gegenüber der Carboxygruppe als auch gegenüber der Methylgruppe eine höhere Priorität hat, sodass sich die Verletzungen gegenseitig aufheben und durch Substitution des pro-(S)-Wasserstoffatoms das (S)-Produkt entsteht. Ersetzt man dasselbe Atom jedoch durch ein Ethylgruppe, so tritt nur eine Verletzung der Regel auf, und es entsteht das entsprechende (R)-Produkt (hier: 2-Methylbutansäure).
Literatur
- Klaus Schwetlick: Organikum, Wiley-VCH, 2004, 22., vollständig überarbeitet u. aktualisierte Auflage, ISBN 978-3-527-31148-4.
Einzelnachweise
- Kenneth R. Hanson: Applications of the Sequence Rule. I. Naming the Paired Ligands g,g at a Tetrahedral Atom Xggij. II. Naming the Two Faces of a Trigonal Atom Yghi in: J. Am. Chem. Soc. 88, 2731 (1966).
- Stuart Cantrill: A Photo Finish, Nature Chem., 4, 5 (2012).
- P. K. Hashim, Nobuyuki Tamaoki: Induction of Point Chirality by E/Z Photoisomerization, Angew. Chem. Int. Ed., 50, 11729 (2011).
- Hermann J. Roth, Christa E. Müller, Gerd Folkers: Stereochemie und Arzneistoffe, Wissenschaftliche Verlagsgesellschaft Stuttgart, 1998, S. 261–262, ISBN 3-8047-1485-4.
- Universität Erlangen: Prochiralität
Weblinks
- Eintrag zu prochirality. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.P04859 – Version: 2.3.