Morbus Crohn
Der Morbus Crohn oder die Crohn-Krankheit gehört zur Gruppe der chronisch-entzündlichen Darmerkrankungen.[1][2][3] Morbus Crohn wird als „komplexe Barriereerkrankung“ unklarer Ursache angesehen. Pathophysiologisch zeigen sich eine verminderte Fähigkeit bestimmter Zellen zur Bakterienerkennung und -bekämpfung, eine veränderte Schleimschicht auf der Darmschleimhaut sowie eine gesteigerte Durchlässigkeit des Darmepithels. Die Eingruppierung als klassische Autoimmunerkrankung gilt heute als obsolet.[4]
| Klassifikation nach ICD-10 | |
|---|---|
| K50.- | Crohn-Krankheit [Enteritis regionalis] [Morbus Crohn] |
| K50.0 | Crohn-Krankheit des Dünndarms I5642 |
| K50.1 | Crohn-Krankheit des Dickdarms I5646 |
| K50.8 | Sonstige Crohn-Krankheit |
| K50.9 | Crohn-Krankheit, nicht näher bezeichnet |
| ICD-10 online (WHO-Version 2019) | |
Der Morbus Crohn führt zu einer chronisch-granulomatösen Entzündung, die im gesamten Verdauungstrakt von der Mundhöhle bis zum After auftreten kann. Bevorzugt befallen von den charakteristischen Schwellungen und Entzündungen sind der untere Dünndarm (terminales Ileum) und der Dickdarm (Colon), seltener die Speiseröhre (Ösophagus) und der Mund. Typisch für die Crohn-Krankheit ist der diskontinuierliche, segmentale Befall (sogenannte skip lesions) der Darmschleimhaut: Gleichzeitig sind mehrere Bereiche betroffen, die durch gesunde Darmabschnitte voneinander getrennt sind.
Weitere Bezeichnungen für die Krankheit sind Ileitis terminalis, regionale Enteritis, Enteritis regionalis Crohn, Enterocolitis regionalis und sklerosierende chronische Enteritis; übliche Abkürzungen sind MC (Morbus Crohn) und CD (Crohn’s Disease).
Geschichte
Das Krankheitsbild wurde erstmals 1932 vom US-amerikanischen Magen- und Darmspezialisten Burrill Bernard Crohn (1884–1983) und seinen Kollegen Leon Ginzburg und Gordon Oppenheimer beschrieben, die die klinischen und pathologischen Details bei vierzehn Patienten zusammentrugen, die alle am Mount Sinai Hospital in New York operiert worden waren. Diese Erstveröffentlichung trug den Titel Regional ileitis: a pathological and clinical entity.[5]
Bereits zuvor waren die klinischen Symptome mehrfach beschrieben worden, so zuerst 1904 vom polnischen Chirurgen Antoni Leśniowski (1867–1940, engl.) und 1907 vom britischen Chirurgen und Gastroenterologen Berkeley G. A. Moynihan. Allerdings kann auch eine Krankheitsbeschreibung des italienischen Arztes Giovanni Battista Morgagni aus dem Jahr 1761 als Darstellung des M. Crohn interpretiert werden.[6]
Ursprünglich benannte B. Crohn die Krankheit als Ileitis terminalis nach der Lokalisation im terminalen Ileum, verzichtete auf den Begriff jedoch, um „Assoziationen zu Agonie und Tod zu vermeiden“[6] und benannte sie nachfolgend als Ileitis regionalis. Der Begriff Morbus Crohn wurde dann von britischen Ärzten auf einer Konferenz in Prag durchgesetzt, um den Studenten dadurch die Krankheit besser näherbringen zu können, trotz des Protestes von B. Crohn.[6]
Häufigkeit
In den westlichen Industriestaaten liegt die Inzidenz (die jährliche Anzahl von Neuerkrankungen) von Morbus Crohn bei etwa 7–8 auf 100.000 Einwohner, die Prävalenz (der Bestand an Erkrankten) bei etwa 150 auf 100.000.[7] Die Prävalenz in Deutschland liegt aktuell bei gut 300 auf 100.000.[8] Die Zahl der Erkrankungen hat in den letzten zwanzig Jahren zugenommen. Bis Ende des 20. Jahrhunderts kam sie vor allem in der westlichen Welt (Nordamerika, Europa, Ozeanien) vor, seit Ende des 20. Jahrhunderts sinkt bzw. stagniert die Inzidenz dort, steigt jedoch in Asien, Südamerika und Afrika an, möglicherweise im Zusammenhang mit Lebensstilveränderungen.[8]
In Nordamerika und Europa alleine leiden mehr als 3,5 Mio. Menschen an einer chronisch entzündlichen Darmerkrankung (M. Crohn, Colitis ulcerosa).[8]
Beide Geschlechter sind gleich häufig betroffen, meist erkranken junge Erwachsene zwischen dem 15. und 35. Lebensjahr sowie ältere Menschen ab einem Alter von 60 Jahren. Es ist eine familiäre Häufung zu beobachten. Deutschland hat eine der höchsten Prävalenzen weltweit zu verzeichnen.[9]
Entstehung des Morbus Crohn
Die Ursache, Entstehung und Entwicklung des Morbus Crohn sind nicht geklärt; es sind aber eine Reihe von Umständen bekannt, die bei der Entstehung der Erkrankung von Bedeutung sind. Burrill B. Crohn hielt den M. Crohn für eine durch intrazelluläre Bakterien oder Viren ausgelöste Erkrankung. Heute gilt der Morbus Crohn als Autoimmunerkrankung im weiteren Wortsinne, da die Darmschleimhaut durch eine Immunreaktion gegen die kommensale Darmflora geschädigt wird.[10]
Für diese Klassifikation spricht das gute Ansprechen der Krankheit auf Immunsystem-hemmende Medikamente wie Cortison und Azathioprin sowie der fehlende Nachweis eines spezifischen Erregers. Als Autoantikörper wurden bei Morbus Crohn gehäuft (bei rund 20 % der Patienten) perinukleäre anti-neutrophile cytoplasmatische Antikörper (p-ANCA) serologisch identifiziert. Wie bei vielen anderen Autoimmunerkrankungen ist die Entstehung des M. Crohn unzureichend verstanden, weshalb nicht kausal, sondern nur symptomatisch (immunsuppressiv oder immunmodulierend) therapiert werden kann.
Laut einem Forschungsbericht der Deutschen Morbus Crohn Vereinigung (DCCV e. V.) vom 15. September 2011 ist „Versagen der angeborenen Abwehr gegen Darmbakterien der Auslöser für die Krankheiten […]. Die chronische Entzündung ist folglich als Reaktion und Antwort auf diese Abwehrschwäche zu verstehen.“[11][12]
Genetik
Für die Krankheit besteht möglicherweise eine erbliche Veranlagung, denn mehrere Erbfaktoren erhöhen das Risiko ihres Auftretens. Für einige Gene wurde gezeigt, dass wahrscheinlich bestimmte Polymorphismen mit Morbus Crohn ursächlich in Verbindung stehen, so z. B. NOD2 (NOD2-Rezeptor), IL23R (Chromosom 1p31)[13] und ATG16L1, DLG5 und NELL1 (Chromosom 11p15.1).[14] Auch eine verminderte Anzahl der Genabschnitte, die für die Produktion von beta-Defensinen verantwortlich sind, scheint sich auszuwirken.[15] Defensine sind eine Art natürliche Antibiotika, die in Schleimhäuten Bakterien abwehren. Menschen mit Morbus Crohn im Dickdarm haben lediglich drei Defensin-produzierende Genabschnitte im Chromosom Nr. 8. Gesunde Menschen besitzen im Allgemeinen vier davon; dementsprechend ist auch der Defensin-Spiegel in deren Schleimhaut höher. Für den wesentlich häufigeren Morbus Crohn im Dünndarm gibt es diesen Zusammenhang allerdings nicht.[16][17]
Barrierestörung
Vieles deutet darauf hin, dass zumindest bei einem Teil der Morbus-Crohn-Patienten die Barriere zwischen dem Darmlumen und dem Organismus defekt ist. Konkrete Hinweise auf diesen Barrieredefekt zeigen sich z. B. im Mangel an anti-infektiös wirksamen Peptiden (Defensinen) im Mucus (Schleim), der der Darmschleimhaut aufgelagert ist. Zudem sind häufig die abdichtenden Verbindungen zwischen den Epithelzellen der Darmschleimhaut „undicht“, d. h. nicht mehr funktionell und in ihrer Zahl vermindert. Ob der kontrollierte Zelltod (Apoptose) vieler Epithelzellen ein primäres oder sekundäres Phänomen ist und damit dem Krankheitsbild ursächlich zugrunde liegt oder nur zur Chronifizierung der Entzündung beiträgt, ist unklar. Durch den Defekt der Barrierefunktion gelangen – im Gegensatz zur Situation beim Gesunden – Bakterien der normalen Darmflora in großer Zahl direkt auf das Epithel der Darmschleimhaut und dringen teilweise auch in die Darmwand ein, wo sie Entzündungen im Rahmen der Abwehr durch den Körper auslösen, die die Barriere noch weiter schädigen, sodass im Sinne eines Teufelskreises weitere Bakterien der Darmflora in die Darmwand eindringen und die Entzündung weiter anfachen. Der primäre Defekt der Barrierestörung kann zumindest teilweise genetisch bedingt sein. So ist die Produktion bestimmter alpha-Defensine bei Morbus-Crohn-Patienten mit für Morbus Crohn charakteristischen Mutationen in einem Gen (NOD2/CARD15), das einen intrazellulären Sensor für bakterielle Strukturen codiert, gegenüber Morbus-Crohn-Patienten ohne diesen Gendefekt noch stärker vermindert, obwohl die Defensinproduktion auch bei Morbus-Crohn-Patienten ohne diesen Gendefekt bereits drastisch gegenüber Gesunden reduziert ist. Dieses gilt für den Dünndarmbefall, bei Lokalisation im Dickdarm ist offenbar die Zahl der beta-Defensin-Gene und dementsprechend die beta-Defensinsynthese vermindert. Somit erklären die verschiedenen Defensindefekte die unterschiedlichen Lokalisationen der Erkrankung.
Eisenaufnahmestörung und Blutarmut (Anämie)
Es besteht eine Überproduktion eines Faktors Hepcidin,[18][19][20][21][22] welcher ein funktioneller Inhibitor des intestinalen Eisenaufnahmetransportproteins Ferroportin[23] ist, wodurch der Darm daran gehindert ist, Eisen aus der Nahrung aufnehmen zu können. Gemäß aktuellen klinischen Erkenntnissen ist es möglich, dieses System mit einer gegen TNF-alpha gerichteten Behandlung mit Infliximab – nicht aber mit einer konventionellen Basistherapie z. B. mit Azathioprin – zu beeinflussen.[24] Eine systemnahe Therapie, die am BMP6 ansetzt, wurde im Mausmodell entwickelt.[25]
Mycobacterium avium subsp. paratuberculosis
Es gibt einige Indizien, dass das Mycobacterium avium subsp. paratuberculosis (MAP) zusammen mit speziellen Varianten des CARD15/NOD2-Gens chronisch-entzündliche Darmerkrankungen beim Menschen wie Paratuberkulose bei Tieren verursachen kann. An Paratuberkulose erkrankte Rinder und Morbus-Crohn-Patienten haben eine identische Besonderheit im CARD15/NOD2-Gen, die einen negativen Einfluss auf die Defensinproduktion (Produktion natürlicher Antibiotika) hat.[26] Das MAP löst bei Rindern und anderen Tieren chronische Darmentzündungen aus und verursacht an sterilen menschlichen Darmabschnitten Entzündungsreaktionen und Gewebeschäden. Mycobacterium avium paratuberculosis induziert beim Menschen spezifische Antikörper. Diese Antikörper werden im Blut von bis zu zwei Dritteln aller Morbus-Crohn-Patienten gefunden.
Zurzeit laufen Untersuchungen, ob Patienten erfolgreich mit einer Antibiotikakombination behandelt werden können.[27] Eine Multi-Antibiotika-Therapie hat zu ersten Behandlungserfolgen in USA und Australien geführt.[26] MAP wurde mehrfach in verschiedenen Milchprodukten nachgewiesen. Ein Prozentsatz überlebt die Bedingungen der Pasteurisierung, des Verfahrens, mit dem der überwiegende Teil der Milch für Milchprodukte behandelt wird.
Übermäßige Hygiene
Welche Faktoren der Umwelt zur verbreiteten Entwicklung des Morbus Crohn in Gesellschaften mit hohem hygienischen Standard führen, ist unklar. Möglicherweise führt ein Befall mit bestimmten Parasiten – beispielsweise Würmern – zu einer spezifischen Modulation der Immunantwort, die verhindert, dass die Entzündungsreaktion chronisch wiederkehrt. Es existieren andere Hypothesen, wie die Schädigung der Darmbarriere durch die zunehmende Exposition gegenüber Detergentien, wie Seifen, Weichmachern oder Emulgatoren, die dazu beitragen könnten, die Barrierefunktion der Darmwand zu schädigen und so dem Eindringen von Bakterien der normalen Darmflora Vorschub zu leisten. Wahrscheinlich sekundär ist, dass die Darmflora bei Morbus-Crohn-Patienten verändert ist: Im Vergleich zu Gesunden findet man eine deutliche Reduktion der Anzahl verschiedener Bakterienspezies.
Rauchen
Das Risiko der Entwicklung eines Morbus Crohn ist bei Rauchern doppelt so hoch wie bei Nichtrauchern. Eine Beendigung des Rauchens wirkt sich in der Regel günstig auf den Krankheitsverlauf oder auf die Rezidivrate nach einer Operation aus.[28]
Ernährung
Früher vermutete Zusammenhänge mit einer spezifischen Ernährung wie vermehrter Gebrauch von raffinierten Zuckersorten bei MC-Patienten werden heute als sekundär erachtet, da viele Morbus-Crohn-Patienten aufgrund der Entzündungen im Dünndarm eine generell verminderte Resorption und damit eine schlechtere Nahrungsverwertung aufweisen.
Psychosomatik
Laut der Leitlinie Morbus Crohn handelt es sich um keine psychosomatische Erkrankung. Belastende Lebensereignisse, Stress und psychische Störungen seien demnach nicht die Ursache für die Entstehung dieser chronisch entzündlichen Darmerkrankung. Psychosozialer Stress kann allerdings in erheblichem Maße zur Symptomauslösung oder -verstärkung führen. Es wird angenommen, dass bei den chronisch-entzündlichen Darmerkrankungen psychosozialer Stress auch zu einer Fehlregulation der Immunantwort und – bei entsprechender Veranlagung – zur Krankheitsaktivierung führt. Dieser Stress kann bei Morbus-Crohn-Patienten zum Auftreten erneuter Entzündungen führen.
Ausführlich und mit zahlreichen weiterführenden Literaturstellen setzt sich Feiereis mit der Bedeutung psychischer Faktoren für Ätiologie und Pathogenese in dem von Uexküll und anderen veröffentlichten Standardwerk Psychosomatische Medizin auseinander.[29] Er schlägt vor, die psychischen Befunde in ihren verschiedenen Bestandteilen zu beachten und als zugehörig zur prämorbiden Persönlichkeitsstruktur, zur Psychodynamik, zu den einen Schub auslösenden Faktoren und/oder den krankheitsabhängigen Merkmalen zu unterscheiden.
Symptomatik
Typische Symptome des Morbus Crohn sind Bauchschmerzen und Durchfall, manchmal blutig, was auf Schleimhautdefekte (Ulcera) hinweist.[30] Die Schmerzen treten besonders oft im rechten Unterbauch und oft nach dem Essen oder vor dem Stuhlgang auf. Auch Fieber, Gewichtsverlust, Appetitlosigkeit, Übelkeit und Erbrechen können entstehen. Gerade bei Kindern kann eine Wachstumsverzögerung das einzige Symptom sein. Fisteln oder Abszesse am After können ebenfalls von einem Morbus Crohn kommen. Bei vielen Patienten jedoch ist die Art und das Empfinden der Symptome unterschiedlich. In den Laboruntersuchungen sieht man meistens eine Entzündung mit einem Anstieg der weißen Blutkörperchen und einer Anämie. Die Beschwerden treten für gewöhnlich in Schüben auf. Ein derartiger Schub dauert meist mehrere Wochen an. Beschwerden, die nur wenige Tage andauern, sind in den wenigsten Fällen Schübe des Morbus Crohn.
Bei bis zu 50 Prozent der Morbus-Crohn-Patienten treten zudem extraintestinale Manifestationen auf. Am häufigsten sind hierbei die Gelenke betroffen; es kann zu Arthralgien und Arthritiden kommen. Im Rahmen des Morbus Crohn sind ferner Hautveränderungen in Form des Erythema nodosum oder des Pyoderma gangraenosum möglich. Ebenso kann es zur Begünstigung einer Rosazea kommen sowie zu Entzündungen des Auges (etwa als Uveitis). Die Manifestationen außerhalb des Darmtrakts (extraintestinale Symptome) können selten auch Monate bis Jahre vor der Darm-Symptomatik auftreten. Normalerweise verschwinden die extraintestinalen Symptome, wenn der Morbus Crohn als Grunderkrankung behandelt wird. Neben der Erkrankung selbst kommen auch Nebenwirkungen der Medikation als Auslöser für extraintestinale Manifestationen in Frage.
Komplikationen
- Mechanischer Darmverschluss (Ileus): Anfangs häufig durch Einengung des betroffenen Darmsegments während des entzündlichen Prozesses bedingt, im späteren Stadium durch fibröse Strikturen. Ein Ileus tritt bei rund 20 bis 30 Prozent der Patienten im Verlauf der Erkrankung auf.
- Fistel (Verbindung des Darms mit anderen Organen oder der Körperoberfläche): Fisteln treten im chronischen Verlauf recht häufig auf und können recht verschieden sein: Verbindung des Darms mit der Körperoberfläche (kutan), Verlauf zwischen Darm und Geschlechtsorganen (enteroenteritisch/enterovaginal), Verlauf zwischen Darm und Harnblase (enterovesikal), Ausgang der Fistel im Bereich des Afters (peranal), rektal. Seltener hingegen sind Fisteln in die freie Bauchhöhle hinein, da die Umgebung des Darms meist stark verwachsen ist.
- Abszess (umkapselte Eiteransammlung): intra- und retroperitoneale Abszesse kommen vor.
- intestinale Blutungen
- Toxisches Megakolon: (= durch „Gift“ bedingte abnorme Weitstellung des Dickdarms) eher selten bei Morbus Crohn, dafür häufiger bei Colitis ulcerosa
- Karzinom: Vor allem für Dickdarmkarzinome besteht ein erhöhtes Risiko (jedoch auch hier eher bei Colitis ulcerosa).
- Osteoporose oder Osteopenie: Veränderungen der Knochendichte treten häufig als Folgeerscheinungen von Malabsorption sowie als Nebenwirkung einer Cortisontherapie auf.
- Gallensteine (durch den gestörten Leber-Darm-Kreislauf)
- Urolithiasis (Harnsteinleiden): hervorgerufen durch eine vermehrte Aufnahme von Oxalat aus dem Darm. Ursache hierfür ist ein Gallensäureverlustsyndrom aufgrund des verkürzten und entzündlich alterierten terminalen Ileums, so dass Calcium, welches normalerweise Oxalat im Darm bindet, nunmehr an die Gallensäuren gebunden wird.
- Exsudative Gastroenteropathie
Problembelastung und Versorgungsoptionen
Krankheitsspezifische Symptome (z. B. Durchfälle) können stark in den Alltag der betroffenen Personen eingreifen.[31] Häufig entwickeln sich zudem Ängste und Depressionen. Entsprechend ist die Lebensqualität der Betroffenen oft verringert.[32] Auch psychischer Stress kann den Krankheitsverlauf negativ beeinflussen.[33] Hinsichtlich dieser unterschiedlichen Problemlagen ist es bei der Krankheitsbewältigung wichtig, die gesamte Lebenssituation in den Blick zu nehmen.[31]
Zu diesem Zweck wurde an der Universität Lübeck ein Online-Fragebogen entwickelt,[34] der 22 krankheitsbezogene Problembereiche bewertet und so den Patienten eine Übersicht über ihre aktuelle Gesundheitssituation und ihr persönliches Problemprofil gibt, mit computergenerierten Vorschlägen für mögliche Unterstützungsangebote. Der Nutzen des Fragebogens und die Wirksamkeit auf die Lebensqualität von Betroffenen wurden in einer randomisierten kontrollierten Studie bestätigt.[35]
Diagnostik
- Abdomensonographie (Ultraschall-Untersuchung des Bauches): Typisch ist die segmentale Verdickung der Darmmucosa (Schleimhautoberfläche).
- Labor: Entzündungsparameter sind erhöht (BSG und CRP), Veränderung der Parameter durch Malabsorption, Anämie (verursacht durch Blutverlust oder Vitamin-B12-Mangel/Perniziöse Anämie), Leukozytose, Antikörper gegen Saccharomyces cerevisiae (ASCA).
- Röntgenuntersuchung oder Magnetresonanztomographie mit Kontrastmittel: Pflastersteinrelief, Fisteln, segmentale Stenosen
- Ileo-Koloskopie: Frühstadium: Schleimhautläsionen, fleckige Rötungen. Während eines aktiven Schubs: Ulzerationen, Pflastersteinrelief, Fissuren, Fisteln. Spätstadium: Stenosen.
- Biopsie: siehe Pathologie/Morphologie weiter unten
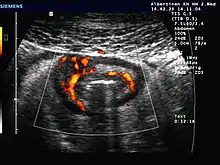 Ultraschallbild bei M. Crohn mit Wandverdickung und verstärkter Durchblutung einer Dünndarmschlinge |
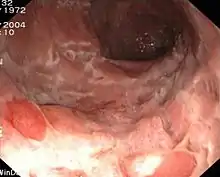 Endoskopiebild bei M. Crohn Pflastersteinrelief im terminalen Ileum |
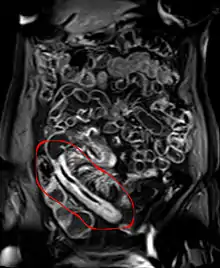 MR-Enteroklysma bei M. Crohn im terminalen Ileum: Deutliche Wandverdickung und Kontrastmittelaufnahme in dem befallenen Darmabschnitt. Dieser ist durch die Veränderungen auch atypisch gestreckt. |
Pathologie/Morphologie
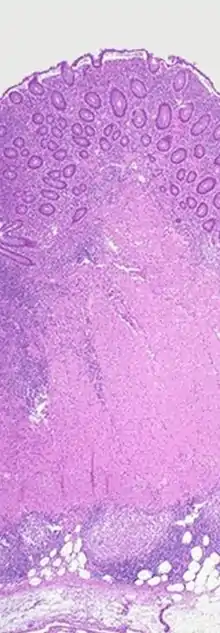
Makroskopisch sind folgende Veränderungen charakteristisch:
- Gartenschlauchphänomen: Durch Fibrosierung verursachte Segmentstenosen
- Pflastersteinphänomen: Entzündlich verdickte Schleimhautareale wechseln sich mit tief ulzerierten Schleimhautarealen ab, wodurch ein pflastersteinartiges Aussehen entsteht.
- Entzündlicher Konglomerattumor: Verschiedene Darmabschnitte verkleben miteinander.
Histologisch (feingeweblich) erkennt man vor allem eine Häufung von Lymphozyten, (eosinophilen) Granulozyten und Histiozyten in der Biopsie des entzündeten Darmgewebes. Angrenzende Lymphknoten sind meist vergrößert. Häufig bilden sich Granulome (inkonstant und keineswegs pathognomonisch), die sich in zwei Typen unterscheiden lassen: Epitheloidzellgranulome und Mikrogranulome (kleiner und ohne zentrale Nekrose).
Differentialdiagnostik
Der Morbus Crohn ist manchmal schwer von der Colitis ulcerosa abzugrenzen, in manchen Fällen gelingt es gar nicht (zu den Unterschieden siehe auch die Tabelle unter chronisch-entzündliche Darmerkrankungen).
Darüber hinaus muss eine Reihe anderer Krankheiten ausgeschlossen werden, was mit Hilfe von Bildgebung (Sonografie, CT) und zusätzlichen Untersuchungen geschieht:
- Appendizitis: meist ein sich rasch entwickelnder Schmerz im rechten Unterbauch. Häufig eine Temperaturdifferenz >1 °C zwischen rektaler und axillärer Messung.
- Divertikulitis: tastbare Resistenzen bei meist linksseitigem Unterbauchschmerz.
- Yersiniose: Erregernachweis aus dem Stuhl oder aus dem Biopsiematerial, Anstieg des Antikörpertiters.
- Darmtuberkulose: In Mitteleuropa mittlerweile sehr selten. Die Darmtuberkulose geht häufig mit Beteiligung der Lunge einher. Es finden sich „verkäsende“ epitheloidzellige Granulome im Biopsiematerial.
- jede andere invasive infektiöse Colitis (Salmonellenenteritis, pseudomembranöse Colitis etc.)
Aktivitätsindex
Der Crohn’s Disease Activity Index (CDAI) kann verwendet werden, um die Krankheitsaktivität zu quantifizieren. Der CDAI wurde von W.R. Best und Kollegen 1976 entwickelt.[36] Der Index setzt sich aus acht Variablen zusammen, die jeweils mit einem Faktor multipliziert und dann summiert werden. Die Komponenten des CDAI und ihre Wichtungsfaktoren sind wie folgt:
| Klinische oder laborchemische Variable | Wichtungsfaktor |
|---|---|
| Anzahl der ungeformten Stuhlgänge in den letzten sieben Tagen | x 2 |
| Bauchschmerzen (0 = keine, 1 = leicht, 2 = mittel, 3 = stark) als Summe der letzten sieben Tage | x 5 |
| Allgemeinbefinden (0 = gut, 1 = beeinträchtigt, 2 = schlecht, 3 = sehr schlecht, 4 = unerträglich) als Summe der letzten sieben Tage | x 7 |
| Anwesenheit von Komplikationen* | x 20 |
| Symptomatische Durchfallbehandlung (Loperamid o. ä.) | x 30 |
| Abdominelle Resistenz (0 = nein, 2 = fraglich, 5 = sicher) | x 10 |
| Abweichung des Hämatokrit von 47 % bei Männern und 42 % bei Frauen | x 6 |
| Prozentuale Abweichung vom Standardgewicht | x 1 |
*Je ein Punkt wird addiert für jede der folgenden Komplikationen:
- Gelenkbeteiligung (Gelenkschmerzen oder Arthritis)
- Augenbeteiligung (Iritis oder Uveitis)
- Hautbeteiligung (Erythema nodosum, Pyoderma gangraenosum oder orale Aphthen)
- perianaler Befall (Analfissur, perianale Fistel oder perianale Abszesse)
- Andere Fisteln
- Erhöhte Körpertemperatur (>37,7 °C) während der letzten sieben Tage.
Remission bei Morbus Crohn ist definiert als ein CDAI kleiner 150. Ab 220 Punkten ist ein Schub definiert und bei einem CDAI größer 450 besteht ein schwerer Schub. In der täglichen Praxis wird dieser Index allerdings weniger verwendet, da er kompliziert ist und oft zu unflexibel für eine individuelle Behandlung. Seine hauptsächliche Anwendung findet er in wissenschaftlichen Untersuchungen.
Der Harvey-Bradshaw-Index wurde 1980 als vereinfachte Version des CDAI entwickelt.[37] Er besteht nur aus klinischen Parametern:
- Allgemeinbefinden (0 = gut, 1 = beeinträchtigt, 2 = schlecht, 3 = sehr schlecht, 4 = unerträglich)
- Bauchschmerzen (0 = keine, 1 = leicht, 2 = mittel, 3 = stark)
- Anzahl der flüssigen Stuhlgänge
- Abdominelle Resistenz (0 = nein, 1 = fraglich, 2 = sicher, 3 = sicher und schmerzhaft)
- Komplikationen: Arthralgie, Uveitis, Erythema nodosum, orale Aphthen, Pyoderma gangraenosum, Analfissur, neue Fistel, Abszess (je 1 Punkt)
Die ersten drei Punkte beziehen sich auf den vorangegangenen Tag.
Nach Addition entsprechen < 5 Punkte einer Remission, 5–7 einem milden Schub, 8–16 mäßiger Aktivität und > 16 einem schweren Schub.[38]
Therapie
Grundsätzlich unterscheidet man bei der Therapie des Morbus Crohn zwischen der Schubtherapie und der Remissionserhaltung. Ziel der Schubtherapie ist bei Verschlechterung, das heißt bei Vorliegen eines Schubs, die Linderung der akuten Symptome. Mit der remissionserhaltenden Therapie soll die Zahl der Schübe verringert werden, das heißt, es soll die Zeit der Remission verlängert werden. Die konservativen (Medikamente) und operativen Therapieansätze ergänzen sich dabei. Grundsätzlich versucht man, Resektionen des Darms zu vermeiden, aber in einigen Situationen ist die Chirurgie der inneren Medizin überlegen. Dies ist vor allem bei Fisteln, Stenosen (narbigen Engen) und lebensgefährlichen Komplikationen der Fall.
Derzeit wird eine wissenschaftliche Debatte geführt, ob das Ziel der Therapie die Beschwerdefreiheit des Patienten oder die komplette Abwesenheit von Entzündung (so genanntes Mucosal Healing) sein sollte. Befürworter des Mucosal Healing argumentieren, dass so sowohl einem Funktionsverlust des Darms als auch häufigen Schüben und der Entstehung von Krebserkrankungen vorgebeugt werden könnte.[39] Beweise für diese Hypothesen stehen noch aus.
Für Diagnose und Therapie gibt es evidenzbasierte Leitlinien der deutschen Gesellschaft für Verdauungs- und Stoffwechselkrankheiten[40] und auch auf europäischer Ebene den European evidence based consensus on the diagnosis and management of Crohn’s disease für die Diagnose,[41] die allgemeine Therapie[42] und für Spezialfälle.[43]
Feiereis hält einen mehrdimensionalen Ansatz für erforderlich, der, je nach Fallkonstruktion, aus „medikamentösen, diätetischen, entspannungs- und psychotherapeutischen, operativen, rehabilitativen und nachsorgenden Verfahren besteht“ und die Koordination einer „eng konsiliarisch miteinander arbeitende[n] Gruppe“ von Ärzten voraussetze.[44]
Akuter Schub
In der Schubtherapie unterscheidet man zwischen leicht- bis mittelgradigen Schüben und mittelgradigen bis schweren Schüben. Außerdem spielt die Lokalisation der Erkrankung gerade beim Morbus Crohn, der den gesamten Magen-Darm-Trakt befallen kann, für die Therapieentscheidung eine wichtige Rolle. Bei perianalem Befall mit Fisteln oder Abszessen kommen wieder andere Therapien zum Einsatz.
- Eine Diät, eventuell mit parenteraler Ernährung oder voll resorbierbarer, ballaststoffarmer Flüssignahrung, kann Symptome während eines schweren Schubs lindern. Insbesondere bei Kindern lässt sich ein Schub allein mit einer enteralen Sondennahrung behandeln. Bei Erwachsenen gibt es ebenfalls Studien, die zeigen, dass eine enterale Sondennahrung zur Behandlung eingesetzt werden kann. Der Vorteil dieser Behandlungsform ist, dass man die Nebenwirkungen von Glukokortikoiden vermeidet. Allerdings muss man bei dieser Therapieform täglich eine Ernährungssonde über die Nase einführen, was die meisten Patienten als sehr unangenehm empfinden.
- Glukokortikoide sind die wichtigsten Medikamente bei der Behandlung des Morbus Crohn. Sie führen selbst in schwersten Fällen noch bei der Hälfte aller Patienten zu einer Remission. Bei einem leichten bis mittelgradigen Schub verbessern sich die Beschwerden bei rund 90 Prozent aller Patienten. Bei einem Befall der rechten Hälfte des Dickdarms und des terminalen Ileums kann auch Budesonid verwendet werden, ein Cortisonpräparat, das vor allem dort wirkt und wenig Nebenwirkungen im Rest des Körpers verursacht. Bei einem Befall des Mastdarms kann auch Cortison als Klysma eingesetzt werden, das ebenfalls weniger Nebenwirkungen hervorruft. Patienten, die mehr als drei Monate im Jahr Glukokortikoide einnehmen, werden meist mit einer remissionserhaltenden Therapie behandelt.

- Salazosulfapyridin kann im Gegensatz zu Mesalazin (5-Aminosalicylsäure) bei einem leicht- bis mittelgradigen Schub des linken Dickdarms durchaus zu einer Verbesserung führen. Obwohl etwa die Hälfte aller Crohn-Patienten eines dieser beiden Medikamente verschrieben bekommen, hat sich mittlerweile gezeigt, dass die Wirksamkeit nur gering ist. Allerdings stehen Untersuchungen, ob Teilgruppen von Patienten nicht doch von Mesalazin profitieren, noch aus.
- Metronidazol und Ciprofloxacin können vor allem zur Behandlung von Fisteln eingesetzt werden.
- Bei schweren oder therapierefraktären Schüben werden insbesondere TNF-Blocker wie Infliximab und Adalimumab eingesetzt.
- Eine chirurgische Therapie mit Resektion betroffener Darmabschnitte führt zu keiner definitiven Heilung, ist aber bei schwereren Fällen unter Umständen unerlässlich, um schwere Komplikationen wie Stenosen, Fisteln, Abszesse oder Perforationen zu vermeiden oder zu behandeln.
Remissionserhaltung
Derzeit gibt es kein Mittel, das bei jedem Patienten mit Morbus Crohn eingesetzt würde und Schübe verhinderte. Während bei der Colitis ulcerosa Mesalazin gut wirksam ist, hat es beim M. Crohn nur bei operierten Patienten eine schubunterdrückende Wirkung.
Patienten, die schwere Schübe haben, bei denen häufige Schübe auftreten, aber auch Patienten, bei denen beim Versuch, Cortison abzusetzen, die Krankheit immer wieder aufflammt, sollen nach den derzeitigen Leitlinien eine remissionserhaltende Therapie bekommen. Dazu kommen derzeit drei Medikamentengruppen in Frage:
- Immunsuppressiva: Die Immunsuppressiva, für die eine Wirkung beim M. Crohn bewiesen ist, sind Azathioprin, 6-Mercaptopurin und Methotrexat. Diese Medikamente können in Einzelfällen schwere Nebenwirkungen verursachen, so dass zu Beginn der Therapie eine regelmäßige Kontrolle unerwünschter Effekte erfolgen muss. Wenn diese Kontrollen durchgeführt werden, können die Immunsuppressiva von Betroffenen über mehrere Jahre oder gar Jahrzehnte eingenommen werden. Die Behandlung mit Azathioprin muss unter ständiger ärztlicher Kontrolle und Überwachung des Blutbildes erfolgen, da es auf das blutbildende System wirkt.[45]
- TNF-α-Blocker: in der EU sind Infliximab und Adalimumab zur Therapie des M. Crohn zugelassen, in der Schweiz auch Certolizumab. Unter einer Therapie mit TNF-α-Blockern kann eine Tuberkulose reaktiviert werden, so dass vor einer Therapie mit diesen Medikamenten eine Infektion mit Tuberkelbakterien ausgeschlossen oder behandelt werden muss.
- Integrin-Antagonisten: Vedolizumab
Ustekinumab: IL12/IL23 Antagonist
Begleitende Therapien
Durch die Darmerkrankung leiden manche Patienten mit Morbus Crohn an Fehl- und Mangelernährung. Dies kann verschiedene Ursachen haben. Einerseits führt die Erkrankung in schweren Fällen dazu, dass der Darm Nährstoffe unzureichend resorbiert (Malassimilation). Daneben haben Patienten im Schub durch die Entzündung einen erhöhten Energiebedarf oder sie verlieren durch Darmblutung Eisen. Der Eisenstoffwechsel ist ebenfalls durch die Entzündung beeinträchtigt. Darüber hinaus vermeiden manche Patienten bestimmte Nahrungsmittel, von denen sie das Gefühl haben, sie verschlimmerten die Erkrankung. Auch dies kann zu Unterernährung und Nährstoffmängeln führen. Somit müssen neben der eigentlichen Erkrankung oft noch Nährstoffmängel (Eisen, Vitamin-B12, Zink) und Unterernährung (z. B. mit zusätzlicher Trinknahrung) behandelt werden. Die Entzündung und die Einnahme von Glukokortikoiden kann beim Morbus Crohn zu Osteoporose führen. Auch diese Komplikation wird oft begleitend behandelt.
Ob Psychotherapie und Entspannungsmethoden (beispielsweise Verhaltenstherapie, Mind Body Therapie, progressive Muskelentspannung, autogenes Training, Feldenkrais-Methode) hilfreich sind, ist derzeit nicht ganz klar. Sie scheinen nicht zur Verbesserung der Erkrankung beizutragen, können aber eingesetzt werden, wenn Angststörungen, Depression oder übermäßiger Stress als Folge der Erkrankung auftreten.
Alternative und komplementäre Therapien
Die Spezielle Kohlenhydratdiät hat immer wieder anekdotisch große Erfolge bei der Behandlung erzielt und soll bis zur völligen Remission geführt haben. Hierbei wird die Gruppe der Poly- und Disaccharide völlig aus der Ernährung entfernt. Mittlerweile wurde ihre Wirksamkeit in einigen Studien belegt.[46][47][48][49] Zuletzt wurde an der University of Massachusetts Medical School eine Weiterentwicklung der Speziellen Kohlenhydratdiät entwickelt und mit Erfolg in einer Studie mit Patienten, die an Morbus Crohn und Colitis ulcerosa leiden, getestet.[50]
Für die folgenden alternativen oder komplementären Therapiemöglichkeiten gibt es keine ausreichenden wissenschaftlichen Belege, dass sie in der Therapie des Morbus Crohn von Nutzen sind:
- Lutz-Diät, eine kohlenhydratarme und fettreiche Diät nach Wolfgang Lutz
- Nach einer Beobachtungsstudie von 2011 hat Cannabis eine positive Wirkung[51] Der „Cannabis-Report“ (2018) von Gerd Glaeske und Kristin Sauer kommt zu dem Ergebnis, dass „Cannabinoide möglicherweise Morbus Crohn-assoziierte Beschwerden wie Schmerzen, Übelkeit und Appetitlosigkeit lindern können“. Es liegen jedoch nur wenige Studien vor.[52]
- Eine Pilotstudie ergab, dass die Verabreichung von Mastix, dem Harz des Mastix-Baums, einen positiven Effekt hat[53]
- Eine Therapie mit Eiern des Schweine-Peitschenwurms (Trichuris suis) wurde in Erwägung gezogen.[54][55] Es gab dazu zunächst eine kleine wissenschaftliche Studie.[56] Eine große Studie[57] lief zwischen 2010 und 2013. Es wurde eine unzureichende Wirkung festgestellt.[58]
Prognose
Es handelt sich um eine chronische Erkrankung mit hoher Rezidiv-, also Wiederauftrittsrate. Komplikationen machen in den meisten Fällen eine operative Therapie erforderlich, die aber auch zu keiner definitiven Heilung führt. Bei fast der Hälfte der Patienten nimmt die Stärke der Erkrankung im Laufe der Zeit jedoch deutlich ab. Während jeder Dritte immer wieder Schübe mit dazwischenliegender Beschwerdefreiheit erlebt, berichtet etwa ein Fünftel aller Patienten über eine dauerhafte Aktivität ohne Phasen der Beschwerdefreiheit. Patienten mit Morbus Crohn haben im Vergleich zur Normalbevölkerung eine rechnerisch leicht erhöhte Sterblichkeit.[59]
Literatur
- Daniel C. Baumgart, B. Wiedenmann, A. Dignass: Biologische Therapie chronisch-entzündlicher Darmerkrankungen. In: Zeitschrift für Gastroenterologie. Stuttgart 41.2003, 1017–1032. (Online-Ztschr.) PMID 14562200
- Daniel C. Baumgart: Diagnostik und Therapie von Morbus Crohn und Colitis ulcerosa. In: Deutsches Ärzteblatt. Nr. 106(8). Köln 2009, S. 123–133 (PDF).
- W. Burgdorf: Cutaneous manifestations of Crohn’s disease. In: Journal of the American Academy of Dermatology. 1981, 5, S. 689, PMID 6459345.
- A. Cheifetz u. a.: The incidence and management of infusion reactions to infliximab – a large center experience. In: Journal of the American Academy of Dermatology. (J Am Acad Dermatol). New York 98.2003, S. 1315–1324, PMID 12818276.
- G. d'Haens u. a.: Endoscopic and histological healing with Infliximab antibodies in Crohn’s disease – a European multicenter trial. In: Gastroenterology. London 116.1999, S. 1029–1034, PMID 10220494.
- S. Ghosh, E. Goldin, F. H. Gordon u. a.: Natalizumab for active Crohn’s disease. In: The New England journal of medicine. (N Engl J Med). Waltham Mass 348.2003, S. 24–32, PMID 12510039.
- Hubert Feiereis: Morbus Crohn. In: Thure von Uexküll u. a. (Hrsg.): Psychosomatische Medizin. 3. Auflage. Urban & Fischer, Elsevier 1986, ISBN 3-541-08843-5, S. 798–814.
- F. Grange, F. Djialali-Bouzina, A. M. Weiss, A. Polette, J. C. Guillaume: Corticosteroid-resistant pyoderma gangraenosum associated with Crohn’s disease: rapid cure with infliximab. In: Dermatology. 2002; 205, S. 278–280, PMID 12399677.
- H. Herfarth, F. Obermeier, T. Andus, G. Rogler, S. Nikolaus, T. Kuehbacher, Stefan Schreiber: Improvement of arthritis and arthralgia after treatment with infliximab (Remicade) in a German prospective, open-label, multicenter trial in refractory Crohn’s disease. In: Am J Gastroenterol. 2002; 97, S. 2688–2690, PMID 12385472.
- J. R. Korzenik, B. K. Dieckgraefe: Is Crohn’s disease an immunodeficiency? A hypothesis suggesting possible early events in the pathogenesis of Crohn s disease. In: Dig Dis Sci. 2000 Jun;45(6), S. 1121–1129, PMID 10877227.
- A. Menozzi, C. Pozzoli, E. Poli, M. Lazzaretti, A. Cantoni, D. Grandi, E. Giovannini, G. Coruzzi: Effect of the macrolide antibacterial drug, Tylosin, on TNBS-induced colitis in the rat. In: Pharmacology. 2005;74, S. 135–142, doi:10.1159/000084324.
- E. A. Petrelli, M. McKinley, F. J. Troncale: Ocular manifestations of inflammatory bowel disease. In: Ann Ophthalmol. 1982; 14, S. 356, PMID 6125121.
- D. K. Podolsky: Inflammatory Bowel Disease. In: N Engl J Med. 2002; 347, S. 417–429, PMID 12167685.
- D. H Present, P. Rutgeerts, S. Targan, S. B. Hanauer, L. Mayer, R. A. van Hogezand, D. K. Podolsky, B. E. Sands, T. Braakman, K. L. DeWoody, T. F. Schaible, S. J. van Deventer: Infliximab for the treatment of fistulas in patients with Crohn’s disease. In: N Engl J Med. 1999; 340, S. 1398–1405, PMID 10228190.
- B. E. Sands, F. H. Anderson, C. N. Bernstein, W. Y. Chey, B. G. Feagan, R. N. Fedorak, M. A. Kamm, J. R. Korzenik, B. A. Lashner, J. E. Onken, D. Rachmilewitz, P. Rutgeerts, G. Wild, D. C. Wolf, P. A. Marsters, S. B. Travers, M. A. Blank, S. J. van Deventer: Infliximab maintenance therapy for fistulizing Crohn’s disease. In: N Engl J Med. 2004; 350, S. 876–885, PMID 14985485.
- M. Stoll, S. Schreiber: Morbus Crohn: Zweites krankheitsassoziiertes Gen entdeckt. In: Biologie in unserer Zeit. 34(4), 2004, S. 208–209.
- S. R. Targan, S. B. Hanauer, S. J. van Deventer, L. Mayer, D. H. Present, T. Braakman, K. L. DeWoody, T. F. Schaible, P. J. Rutgeerts: A short-term study of chimeric monoclonal antibody cA2 to tumor necrosis factor alpha for Crohn’s disease. Crohn’s Disease cA2 Study Group. In: N Engl J Med. 1997; 337, S. 1029–1035, PMID 9321530.
- J. Wehkamp, J. Harder, M. Weichenthal, M. Schwab, E. Schaffeler, M. Schlee, K. R. Herrlinger, A. Stallmach, F. Noack, P. Fritz, J. M. Schroder, C. L. Bevins, K. Fellermann, E. F. Stange: NOD2 (CARD15) mutations in Crohn’s disease are associated with diminished mucosal a-defensin expression. In: Gut. 2004 Nov;53, S. 1658–1664, PMID 15479689.
- J. Wehkamp, N. H. Salzman, E. Porter, S. Nuding, M. Weichenthal, R. E. Petras, B. Shen, E. Schaeffeler, M. Schwab, R. Linzmeier, R. W. Feathers, H. Chu, H. Lima Jr, K. Fellermann, T. Ganz, E. F. Stange, C. L. Bevins: Reduced Paneth cell {alpha}-defensins in ileal Crohn’s disease. In: Proc Natl Acad Sci U S A. 2005 Dec 13;102, S. 18129–18134, PMID 16330776.
- S. R. Weiner, J. Clarke, N. Taggart, P. D. Utsinger: Rheumatic manifestations of inflammatory bowel disease. In: Semin Arthritis Rheum. 1991; 20, S. 353.
Weblinks
Allgemein
- Kompetenznetz-CED – Netzwerk Deutscher Unikliniken zum Thema Chronisch entzündliche Darmerkrankungen
- Endoskopiebilder bei M. Crohn
- Sonographiebilder bei M. Crohn
- Der UltraschallAtlas Qualitativ hochwertige Ultraschallbilder aus dem Bereich der Medizin
- S3-Leitlinie „Diagnostik und Therapie des Morbus Crohn“ (PDF-Datei; 647 kB) der DGVS (Stand 2008)
- Ernährung: Mangelerscheinungen bei Morbus Crohn
- Morbus Crohn – Bildergalerie
- Aktuelle Therapie von Morbus Crohn & Colitis ulcerosa
- Zusammenwirkung von genetischen Faktoren und Viren
- Online-Fragebogen für Betroffene mit chronisch entzündlicher Darmerkrankung
Vereinigungen
- Deutsche Morbus Crohn/Colitis ulcerosa Vereinigung (DCCV e. V.)
- Österreichische Morbus Crohn/Colitis ulcerosa Vereinigung (ÖMCCV)
- SMCCV (Schweizerische Morbus Crohn/Colitis ulcerosa Vereinigung)
- European Federation of Crohn’s and Ulcerative Colitis Associations (EFCCA) – Dachverband der europäischen Patientenvereinigungen
Einzelnachweise
- D. C. Baumgart, S. R. Carding: Inflammatory bowel disease: cause and immunobiology. In: The Lancet. Band 369, Nr. 9573, 2007, S. 1627–1640, doi:10.1016/S0140-6736(07)60750-8, PMID 17499605.
- D. C. Baumgart, W. J. Sandborn: Crohn’s disease. In: The Lancet. 2012, doi:10.1016/S0140-6736(12)60026-9, PMID 22914295.
- R. J. Xavier, D. K. Podolsky: Unravelling the pathogenesis of inflammatory bowel disease. In: Nature. Band 448, Nr. 7152, 2007, S. 427–434, doi:10.1038/nature06005, PMID 17653185.
- Amboss: Morbus Crohn. In: Amboss Medizinwissen. Amboss, 4. Oktober 2020, abgerufen am 4. Oktober 2020.
- Burrill B. Crohn, Leon Ginzburg, Gordon D. Oppenheimer: Regional ileitis: a pathological and clinical entity. In: Journal of the American Medical Association Band 99, 1932: Seiten 1323–1329.
- Sabine Schuchardt: Burrill B. Crohn blieb seiner Passion ein Leben lang treu. In: Deutsches Ärzteblatt Band 114, Ausgabe 15 vom 14. April 2017, Seite [52].
- B. A. Jacobsen u. a.: Increase in incidence and prevalence of inflammatory bowel disease in northern Denmark: a population-based study, 1978–2002. In: Eur J Gastroenterol Hepatol. 2006 Jun;18(6), S. 601–606, PMID 16702848.
- Gilaad G. Kaplan, Joseph J. Y. Sung, Francis K. L. Chan, Justin C. Y. Wu, Subrata Ghosh: Worldwide incidence and prevalence of inflammatory bowel disease in the 21st century: a systematic review of population-based studies. In: The Lancet. Band 390, Nr. 10114, 23. Dezember 2017, S. 2769–2778, doi:10.1016/S0140-6736(17)32448-0, PMID 29050646.
- ernaehrung.de: Morbus Crohn – Krankheitsbild
- Kenneth Murphy, Casey Weaver: Janeway’s Immunobiology. 9. Auflage. Garland Science, 2017, ISBN 978-0-8153-4551-0, Kapitel 15 Autoimmunity and Transplantation.
- Schwäche in der Abwehr: Neue Erkenntnisse zur Ursache von chronisch entzündlichen Darmerkrankungen (Memento vom 24. November 2011 im Internet Archive); dccv.de, Pressekonferenz zum Crohn & Colitis-Tag 2011, am 15. September 2011 in Leipzig.
- Darmflora: Dysbakterie markiert Beginn des Morbus Crohn aerzteblatt.de, 13. März 2014
- Genvariante schützt vor Morbus Crohn. (Nicht mehr online verfügbar.) aerzteblatt.de, 27. Oktober 2006, archiviert vom Original am 12. Februar 2007; abgerufen am 1. August 2010. Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- Andre Franke, Jochen Hampe, Philip Rosenstiel, Christian Becker, Florian Wagner, Robert Häsler, Randall D. Little, Klaus Huse, Andreas Ruether, Tobias Balschun, Michael Wittig, Abdou ElSharawy, Gabriele Mayr, Mario Albrecht, Natalie J. Prescott, Clive M. Onnie, Helene Fournier, Tim Keith, Uwe Radelof, Matthias Platzer, Christopher G. Mathew, Monika Stoll, Michael Krawczak, Peter Nürnberg, Stefan Schreiber, Greg Gibson: Systematic Association Mapping Identifies NELL1 as a Novel IBD Disease Gene. In: PLoS ONE. 2, 2007, S. e691, doi:10.1371/journal.pone.0000691, PMC 1933598 (freier Volltext).
- K. Fellermann, D. E. Stange, E. Schaeffeler, H. Schmalzl, J. Wehkamp, C. L. Bevins, W. Reinisch, A. Teml, M. Schwab, P. Lichter, B. Radlwimmer, E. F. Stange: A chromosome 8 gene cluster polymorphism with low human beta-defensin 2 gene copy number predisposes to Crohn’s disease of the colon. In: Am. J. Hum. Genet. 79 (2006), S. 439–448.
- Morbus Crohn: Eine Genkopie zuwenig schwächt die Verteidigung. dkfz.de, 17. Juli 2006, abgerufen am 1. August 2010 (Pressemitteilung Nr. 59 des Deutschen Krebsforschungszentrums).
- K. Fellermann, D. E. Stange, E. Schaeffeler, H. Schmalzl, J. Wehkamp, C. L. Bevins, W. Reinisch, A. Teml, M. Schwab, P. Lichter, B. Radlwimmer, E. F. Stange: A chromosome 8 gene cluster polymorphism with low human beta-defensin 2 gene copy number predisposes to Crohn’s disease of the colon. In: Am. J. Hum. Genet. 79(2006), S. 439–448.
- V. N. Drozdov, A. I. Parfenov, A. A. Lishchinskaia, K. K. Noskova, E. V. Tkachenko, G. G. Varvanina: [Clinical and diagnostic significance of gepsidin level in the regulation of iron metabolism in patients with inflammatory bowel disease]. In: Ėksperimental’nai͡a i klinicheskai͡a gastroėnterologii͡a (= Experimental & clinical gastroenterology). Nr. 10, 2011, S. 18–22, PMID 22629694.
- Zühre Kaya u. a.: Serum prohepcidin levels in children with solid tumors, inflammatory bowel disease and iron deficiency anemia. In: Journal of tropical pediatrics. Band 57, Nr. 2, April 2011, S. 120–125, doi:10.1093/tropej/fmq058, PMID 20601378.
- Gaith Semrin u. a.: Impaired intestinal iron absorption in Crohn’s disease correlates with disease activity and markers of inflammation. In: Inflammatory Bowel Diseases. Band 12, Nr. 12, Dezember 2006, S. 1101–1106, doi:10.1097/01.mib.0000235097.86360.04, PMID 17119383.
- Pantelis Oustamanolakis, Ioannis E. Koutroubakis, Ippokratis Messaritakis, Niki Malliaraki, Aekaterini Sfiridaki, Elias A. Kouroumalis: Serum hepcidin and prohepcidin concentrations in inflammatory bowel disease. In: European journal of gastroenterology & hepatology. Band 23, Nr. 3, März 2011, S. 262–268, doi:10.1097/MEG.0b013e328343b885, PMID 21285884.
- Robert J. Basseri u. a.: Hepcidin is a key mediator of anemia of inflammation in Crohn’s disease. In: Journal of Crohn’s and Colitis. Band 7, Nr. 8, 1. September 2013, S. e286–e291, doi:10.1016/j.crohns.2012.10.013, PMID 23219355.
- Tyler Burpee u. a.: Intestinal ferroportin expression in pediatric Crohn’s disease. In: Inflammatory bowel diseases. Band 17, Nr. 2, Februar 2011, S. 524–531, doi:10.1002/ibd.21367, PMID 20564534.
- K. K. Noskova, A. A. Lishchinskaia, A. I. Parfenov, O. V. Kniazev, G. G. Varvanina, V. N. Drozdov: [Risk of development of clinical and pathogenetic features of anemia on the background of basic therapy of inflammatory bowel disease]. In: Ėksperimental’nai͡a i klinicheskai͡a gastroėnterologii͡a = Experimental & clinical gastroenterology. Nr. 10, 2011, S. 12–17, PMID 22629693.
- Lijian Wang u. a.: The bone morphogenetic protein-hepcidin axis as a therapeutic target in inflammatory bowel disease. In: Inflammatory bowel diseases. Band 18, Nr. 1, Januar 2012, S. 112–119, doi:10.1002/ibd.21675, PMID 21351217.
- Morbus Crohn durch Mykobakterien: Ein Verdacht wird zur Gewissheit. Europäisches Institut für Lebensmittel- und Ernährungswissenschaften, 2/2009, S. 21–24.
- Mpofu u. a.: Microbial mannan inhibits bacterial killing by macrophages: a possible pathogenic mechanism for Crohn’s disease. In: Gastroenterology. 2007 Nov;133(5), S. 1487–1498.
- Crohn-Patienten sollten mit dem Rauchen aufhören. (Memento vom 28. Februar 2014 im Internet Archive) DCCV, 15. Mai 2001, abgerufen am 24. Februar 2014.
- Hubert Feiereis: Morbus Crohn. In: Thure von Uexküll u. a. (Hrsg.): Psychosomatische Medizin. 3. Auflage. Urban & Fischer, Elsevier 1986, ISBN 3-541-08843-5, S. 803–805.
- K.-M. Keller, D. Weitzel, U. Lörcher: Diagnostik der chronisch-entzündlichen Darmerkrankungen. In: Monatsschrift Kinderheilkunde. Band 152, Nr. 2, 2004, S. 122–132.
- K. Kemp, J. Griffiths, K. Lovell: Understanding the health and social care needs of people living with IBD: a meta-synthesis of the evidence. In: World journal of gastroenterology. 2012; 18 (43), S. 6240–6249, PMID 23180944.
- L. A. Graff, J. R. Walker, L. Lix, I. Clara, P. Rawsthorne, L. Rogala, N. Miller, L. Jakul, C. McPhail, J. Ediger, C. N. Bernstein: The relationship of inflammatory bowel disease type and activity to psychological functioning and quality of life. In: Clinical gastroenterology and hepatology. 2006; 4 (12), S. 1491–1501, PMID 17162241.
L. A. Graff, J.R. Walker, C. N. Bernstein: Depression and anxiety in inflammatory bowel disease: a review of comorbidity and management. In: Inflammatory bowel diseases. 2009; 15 (7), S. 1105–1118, PMID 19161177. - M. S. Sajadinejad, K. Asgari, K. Molavi, M. Kalantari, P. Adibi: Psychological issues in inflammatory bowel disease: an overview. In: Gastroenterology research and practice. 2012; doi:10.1155/2012/106502, PMID 22778720.
- Online-Fragebogen für Betroffene mit chronisch entzündlicher Darmerkrankung. Herausgeber: Seniorprofessur für Bevölkerungsmedizin; Universität zu Lübeck. Abgerufen am 10. Januar 2015.
- A. Hueppe, J. Langbrandtner, H. Raspe: Inviting patients with inflammatory bowel disease to active involvement in their own care: a randomized controlled trial. In: Inflammatory bowel diseases. 2014; 20 (6), S. 1057–1069, PMID 24788217.
- W. R. Best, J. M. Becktel, J. W. Singleton, F. Kern Jr.: Development of a Crohn’s disease activity index. National Cooperative Crohn’s Disease Study. In: Gastroenterology. Band 70, Nr. 3, März 1976, S. 439–444, PMID 1248701.
- R. Harvey, J. Bradshaw: A simple index of Crohn’s-disease activity. In: Lancet. Band 1, Nr. 8167, 1980, S. 514, doi:10.1016/S0140-6736(80)92767-1, PMID 6102236.
- janssenmedicalinformation.ca (Memento des Originals vom 2. Januar 2015 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- G. Pineton de Chambrun, L. Peyrin-Biroulet, M. Lémann, J. F. Colombel: Clinical implications of mucosal healing for the management of IBD. In: Nat Rev Gastroenterol Hepatol Band 7, Nummer 1, Januar 2010, S. 15–29, doi:10.1038/nrgastro.2009.203, PMID 19949430. (Review).
- S3-Leitlinie Morbus Crohn, Diagnostik und Therapie der Deutschen Gesellschaft für Gastroenterologie, Verdauungs- und Stoffwechselkrankheiten. In: AWMF online (Stand 01/2014)
- G. Van Assche, A. Dignass, J. Panes, L. Beaugerie, J. Karagiannis, M. Allez, T. Ochsenkühn, T. Orchard, G. Rogler, E. Louis, L. Kupcinskas, G. Mantzaris, S. Travis, E. Stange: The second European evidence-based Consensus on the diagnosis and management of Crohn’s disease: Definitions and diagnosis. In: J Crohns Colitis. Band 4, Nummer 1, Februar 2010, S. 7–27, doi:10.1016/j.crohns.2009.12.003, PMID 21122488.
- A. Dignass, G. Van Assche, J. O. Lindsay, M. Lémann, J. Söderholm, J. F. Colombel, S. Danese, A. D'Hoore, M. Gassull, F. Gomollón, D. W. Hommes, P. Michetti, C. O'Morain, T. Oresland, A. Windsor, E. F. Stange, S. P. Travis: The second European evidence-based Consensus on the diagnosis and management of Crohn’s disease: Current management. In: J Crohns Colitis. Band 4, Nummer 1, Februar 2010, S. 28–62, doi:10.1016/j.crohns.2009.12.002, PMID 21122489.
- G. Van Assche, A. Dignass, W. Reinisch, C. J. van der Woude, A. Sturm, M. De Vos, M. Guslandi, B. Oldenburg, I. Dotan, P. Marteau, A. Ardizzone, D. C. Baumgart, G. D'Haens, P. Gionchetti, F. Portela, B. Vucelic, J. Söderholm, J. Escher, S. Koletzko, K. L. Kolho, M. Lukas, C. Mottet, H. Tilg, S. Vermeire, F. Carbonnel, A. Cole, G. Novacek, M. Reinshagen, E. Tsianos, K. Herrlinger, B. Oldenburg, Y. Bouhnik, R. Kiesslich, E. Stange, S. Travis, J. Lindsay: The second European evidence-based Consensus on the diagnosis and management of Crohn’s disease: Special situations. In: J Crohns Colitis. Band 4, Nummer 1, Februar 2010, S. 63–101, doi:10.1016/j.crohns.2009.09.009, PMID 21122490.
- Hubert Feiereis: Morbus Crohn. In: Thure von Uexküll u. a. (Hrsg.): Psychosomatische Medizin. 3. Auflage. Urban & Fischer, Elsevier 1986, ISBN 3-541-08843-5, S. 806.
- Azathioprin#Klinische Angaben
- Kakodkar, S.; Farooqui, A. J.; Mikolaitis, S. L.; Mutlu, E. A.: The Specific Carbohydrate Diet for Inflammatory Bowel Disease: A Case Series In: Journal of the Academy of Nutrition and Dietetics 2015; 115/8 p1226-1232
- Cohen, S. A.; Gold, B.D.; Oliva, S.; Lewis, J.; Stallworth, A.; Koch, B.; Eshee, L.; Mason, D.: Clinical and Mucosal Improvement With Specific Carbohydrate Diet in Pediatric Crohn Disease In: Journal of Pediatric Gastroenterology & Nutrition 2014;59/4 p516-521
- Suskind, D. L.; Wahbeh, G., Gregory, N.; Vendettuoli, H.; Christie, D.: Nutritional Therapy in Pediatric Crohn Disease: The Specific Carbohydrate Diet In: Journal of Pediatric Gastroenterology & Nutrition 2014; 58/1, p87-91
- Fridge, J. L.; Kerner, J.; Cox, K.: The Specific Carbohydrate Diet – A Treatment for Crohn’s Disease? In: Journal of Pediatric Gastroenterology & Nutrition 2004; 39 p299-300
- B. C. Olendzki, T. D. Silverstein, G. M. Persuitte, Y. Ma, K. R. Baldwin, D. Cave: An anti-inflammatory diet as treatment for inflammatory bowel disease: a case series report. In: Nutrition journal. Band 13, 2014, S. 5, doi:10.1186/1475-2891-13-5, PMID 24428901, PMC 3896778 (freier Volltext).
- T. Naftali, L. B. Lev, D. Yablekovitz, E. Half, F. M. Konikoff: Treatment of Crohn’s disease with cannabis: an observational study. In: Isr Med Assoc J. 2011;13(8), S. 455–458.
- Gerd Glaeske, Kristin Sauer: „Cannabis-Report“ 2018, hrsg.: SOCIUM und Universität Bremen, pdf S. 46
- A. C. Kaliora, M. G. Stathopoulou, J. K. Triantafillidis, G. V. Dedoussis, N. K. Andrikopoulos: Chios mastic treatment of patients with active Crohn’s disease. In: World J Gastroenterol. 2007;13(5), S. 748–753.
- PTA-FORUM. Darmerkrankungen Behandlung mit Parasiten
- Der Arzneimittelbrief. Intestinale Mikroflora und das Immunsystem AMB 2011, 45, 32a
- R. W. Summers, D. E. Elliott, K. Qadir, J. F. Urban, R. Thompson, J. V. Weinstock: Trichuris suis seems to be safe and possibly effective in the treatment of inflammatory bowel disease. In: Am. J. Gastroenterol. Band 98, Nummer 9, September 2003, S. 2034–2041, doi:10.1111/j.1572-0241.2003.07660.x, PMID 14499784.
- Doppelblinde, randomisierte, placebokontrollierte, multizentrische Phase II-Studie zur Untersuchung der Wirksamkeit und Sicherheit von drei unterschiedlichen Dosierungen oral einzunehmender Trichuris suis ova (TSO)-Suspension bei aktivem M. Crohn (Memento vom 1. März 2011 im Internet Archive)
- Therapie mit Trichuris suis ova (TSO) Suspension (Wurmeiern)
- D. Duricova, N. Pedersen, M. Elkjaer, M. Gamborg, P. Munkholm, T. Jess: Overall and cause-specific mortality in Crohn’s disease: a meta-analysis of population-based studies. In: Inflamm. Bowel Dis. Band 16, Nummer 2, Februar 2010, S. 347–353, doi:10.1002/ibd.21007, PMID 19572377.