Multiple Sklerose
Die Multiple Sklerose (MS) oder Encephalomyelitis disseminata (ED) ist eine chronisch-entzündliche neurologische Autoimmunerkrankung mit sehr unterschiedlichen Verlaufsformen, weshalb sie auch als die „Krankheit mit tausend Gesichtern“ bezeichnet wurde.[1] Bei ihr werden die Markscheiden, die elektrisch isolierende äußere Schicht der Nervenfasern im Zentralnervensystem (ZNS), angegriffen.
| Klassifikation nach ICD-10 | |
|---|---|
| G35 | Multiple Sklerose (Encephalomyelitis disseminata) |
| ICD-10 online (WHO-Version 2019) | |
Die genauen Ursachen dieser Entmarkungserkrankung sind trotz großer Forschungsanstrengungen noch nicht geklärt. Bei der Multiplen Sklerose entstehen in der weißen Substanz von Gehirn und Rückenmark verstreut viele (multiple) entzündliche Entmarkungsherde, die vermutlich durch den Angriff körpereigener Immunzellen auf die Myelinscheiden der Nervenzellfortsätze verursacht werden. Da die Entmarkungsherde im gesamten ZNS auftreten können, kann die Multiple Sklerose fast jedes neurologische Symptom verursachen. Sehstörungen mit Minderung der Sehschärfe bis hin zur Blindheit und Störungen der Augenbewegungen (internukleäre Ophthalmoplegie) sind typisch, aber nicht spezifisch für die Multiple Sklerose. Der Schweregrad der Behinderungen des Patienten wird häufig anhand einer Skala (EDSS) angegeben.[2][3][4]
Die MS ist neben der Epilepsie eine der häufigsten neurologischen Krankheiten bei jungen Erwachsenen und von erheblicher sozialmedizinischer Bedeutung. Die Krankheit ist nicht heilbar, jedoch kann der Verlauf durch verschiedene Maßnahmen oft günstig beeinflusst werden. Entgegen der landläufigen Meinung führt die Multiple Sklerose nicht zwangsläufig zu schweren Behinderungen. Auch viele Jahre nach Beginn der Erkrankung bleibt die Mehrzahl der Patienten noch gehfähig.
Medizingeschichte der Multiplen Sklerose
Es gibt Beschreibungen aus dem 13. und 14. Jahrhundert, die auf MS hinweisen, beispielsweise bei Lidwina von Schiedam.[5] Eine erstmals genauere Darstellung der Krankheit steht im Tagebuch des Augustus Frederick d’Este (1794–1848),[6] eines Enkels des britischen Königs Georg III. Die Aufzeichnungen über seine Krankheit erstreckten sich von 1822 bis 1846.[7][8][9]
D’Este beschreibt zunächst eine bei ihm im Alter von 28 Jahren erstmals vorübergehend geminderte Sehschärfe:[10]
„Im Dezember des Jahres 1822 reiste ich von Ramsgate in die schottischen Highlands, um einige Tage mit einem Verwandten zu verbringen, für den ich die Gefühle eines Sohnes hegte. Bei meiner Ankunft war er verstorben … Kurz nach der Beerdigung war ich gezwungen, mir die empfangenen Briefe vorlesen und meine Antwortbriefe schreiben zu lassen, da meine Augen so angegriffen waren, dass das Sehen undeutlich wurde, wenn ich kleine Dinge fixierte. Solange ich jedoch nicht versuchte zu lesen oder zu schreiben, war mir nicht im Geringsten gegenwärtig, dass meine Sehkraft eingeschränkt war. Kurz darauf reiste ich nach Irland und meine Augen erholten sich ohne jegliche Behandlung und gewannen ihre Stärke und klare Sicht zurück.“
In der Folge traten schubförmig weitere typische Symptome der Krankheit wie Doppelbilder, eine Schwäche der Beine und Taubheitsgefühle auf:
„17. Oktober 1827. Zu meiner Überraschung bemerkte ich (in Venedig) eine Erstarrung oder Undeutlichkeit der Empfindung in der Gegend der Schläfe über meinem linken Auge. In Florenz begann ich an einer Störung des Sehvermögens zu leiden: Um den 6. November herum nahm das Übel so weit zu, dass ich alle Dinge doppelt sah. Jedes Auge hatte sein eigenes Bild. Dr. Kissock nahm an, dass ein Übermaß an Galle die Ursache sei: Zweimal wurden Blutegel im Bereich der Schläfe angesetzt, Einläufe wurden verabreicht, Erbrechen wurde ausgelöst und zweimal wurde ich zur Ader gelassen, was mit Schwierigkeiten verbunden war. Die Erkrankung meiner Augen klang ab, ich sah alle Dinge wieder natürlich in ihrem einzelnen Zustand. Ich war in der Lage, auszugehen und zu spazieren. Nun begann sich eine neue Krankheit zu zeigen: Mit jedem Tag stellte ich fest, dass mich schrittweise meine Kraft verließ. Eine Taubheit und Empfindungstörungen traten an Steißbein und Damm auf. Schließlich hatte mich die Kraft der Beine um den 4. Dezember herum fast ganz verlassen. Ich verblieb in diesem außergewöhnlichen Zustande der Schwäche für etwa 21 Tage …“
Eine der ersten medizinischen Beschreibungen der Multiplen Sklerose wird William MacKenzie (1791–1886) zugeschrieben. Der schottische Augenarzt berichtete 1840 die Krankengeschichte eines 23-jährigen Mannes, der, nachdem zunächst Sehstörungen aufgetreten waren, wegen zunehmender Lähmungen in das Londoner St Bartholomew’s Hospital aufgenommen worden war. Zusätzlich entwickelten sich eine Sprechstörung (Dysarthrie) und eine Harninkontinenz. Alle Symptome waren jedoch nach zwei Monaten wieder weitestgehend verschwunden.[11]
Der deutsche Arzt Friedrich Theodor von Frerichs diagnostizierte die Krankheit 1849 erstmals an einem lebenden Patienten.[5]
Im Jahre 1868 beschrieb Jean-Martin Charcot die Krankheit nicht nur umfassend klinisch, sondern auch detailliert pathologisch: etwa das Verteilungsmuster multipler sklerosierender Herde in der Nachbarschaft der Hirnventrikel und im Hirnstamm sowie mikroskopisch den Verlust der Markscheiden im Bereich dieser Herde. Er bezeichnete die Krankheit als la sclérose en plaques disséminées.[12]
Bereits 1877 schlug der Neurologe Julius Althaus (1833–1900) vor, die Krankheit nach Charcot zu benennen; das Deonym Morbus Charcot ist jedoch für die Multiple Sklerose außerhalb Frankreichs ungebräuchlich geworden, es wird heute vor allem für die amyotrophe Lateralsklerose verwendet.
Im Jahre 1960 begann man, mit Kortikoiden zu behandeln, 1961 mit ACTH, 1995 mit Beta-Interferon, 2001 mit Glatirameracetat.[5]
Trotz der damals schon umfassenden Beweislage wurde von einzelnen Forschern noch in den 1960er Jahren eine psychische Ursache der Multiplen Sklerose vertreten[13]: Es handele sich aufgrund der vielgestaltigen Symptome, einer typischen Persönlichkeitsstruktur lange vor dem Auftreten der ersten Symptome und eines hohen Anteils von Frauen an den Erkrankungsfällen um eine Konversionshysterie.
Epidemiologie
Krankheitshäufigkeit
Die Multiple Sklerose ist in Mitteleuropa die häufigste chronisch-entzündliche Erkrankung des Zentralnervensystems. Frauen sind ungefähr doppelt so häufig betroffen wie Männer (Gynäkotropie). Noch im Jahr 2000 ging man von einer Krankheitshäufigkeit (Prävalenz) in Deutschland von 149 Erkrankten pro 100.000 Einwohnern aus, woraus sich eine Gesamtzahl von etwa 122.000 Erkrankten ergäbe.[14] Die Auswertung der den Gesetzlichen Krankenkassen vorliegenden Daten durch das Bundesversicherungsamt (2014) ergibt jedoch eine Zahl von mindestens 200.000–220.000 MS-Diagnostizierten.[15]
Für Österreich werden vergleichbare Zahlen angegeben, woraus eine Gesamtzahl von etwa 8150 Erkrankten resultiert.[16] Für die Gesamtschweiz liegen keine epidemiologischen Untersuchungen vor, für den Kanton Bern wurde jedoch mit 110 Erkrankten pro 100.000 Einwohner eine vergleichbare Prävalenz ermittelt.[17] Weltweit sind etwa 2,5 Millionen Menschen an der MS erkrankt.
Die Erkrankung tritt typischerweise im jungen Erwachsenenalter auf, aber 3–5 % erkranken in der Kindheit oder als Heranwachsende[18][19]. Für eine kindliche Multiple Sklerose ist der schubweise Verlauf mit Remissionen typisch[20]. Die Rezidive (Rückfälle) sind bei Kindern in den ersten sechs Jahren der Erkrankung mehr als doppelt so häufig wie bei Erwachsenen. Die Rezidive sind schwerer als bei Erwachsenen, die Remission aber besser[21].
Sterblichkeit
Insbesondere bei Patienten, die keine höhergradigen Behinderungen aufweisen, ist die Mortalität (Sterblichkeit) nicht wesentlich erhöht.[22] Die Lebenserwartung von MS-Patienten liegt in Gegenden, für die ein vollerhebendes MS-Register existiert (wie zum Beispiel Dänemark und Teile Kanadas), unter der von Nichterkrankten vergleichbaren Alters.[23] In den letzten Jahrzehnten ist in Dänemark jedoch ein deutlicher Rückgang der Sterblichkeit zu verzeichnen.[24]
Eine Ausnahme ist hier die maligne Form der MS, die sogenannte Marburg-Variante (nach Otto Marburg), von der vor allem junge Patienten betroffen sind: Diese akute schwere Verlaufsform der Erkrankung ist sehr selten. Schon zu Beginn treten bei diesem MS-Typ schwere Schübe auf. Der schnelle Verlauf führt innerhalb von Wochen oder wenigen Monaten zu einer hochgradigen Behinderung und häufig auch zum Tod des betroffenen Menschen, letzteres insbesondere in den Fällen, in denen Herde im Hirnstamm auftreten.[25] Die Abgrenzung der malignen Sonderform der MS von der akuten disseminierten Enzephalomyelitis (ADEM) ist schwierig, jedoch fehlt im Gegensatz zur ADEM bei der Marburg-Variante oft eine vorausgegangene Virusinfektion.
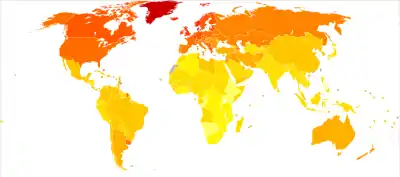
Geografische Verteilung

In der Markscheidenfärbung nach Klüver-Barrera ist eine deutliche Abblassung der (hier blau gefärbten) Markscheiden im Bereich der Läsion erkennbar
(Originalvergrößerung 1:100).
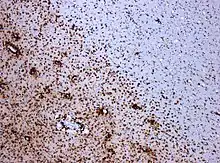
In der immunhistochemischen Färbung für CD68 markieren sich (braungefärbt) zahlreiche Makrophagen im Bereich der Läsion.
(Originalvergrößerung 1:100)
In der äquatorialen Zone ist die Erkrankungshäufigkeit geringer als in den nördlichen und südlichen Breiten. Menschen, die als Kinder oder Jugendliche aus MS-reichen Zonen in MS-arme Zonen übersiedeln (zum Beispiel von Europa nach Südafrika oder von Amerika oder Europa nach Israel), übernehmen das Erkrankungsrisiko des Ziellandes, während ältere Personen die Krankheitshäufigkeit ihres Herkunftslandes behalten. Dieser Befund stellt ein wichtiges Argument für die Beteiligung eines Umweltfaktors im Kinder- und Jugendlichenalter an der späteren Entstehung der Erkrankung dar (Infektionshypothese).[27]
Neuropathologie
Neuropathologisch ist die MS durch herdförmige (fokale), entzündlich-entmarkende Läsionen im ZNS mit unterschiedlich ausgeprägtem Verlust an Axonen und reaktiver Gliose gekennzeichnet. Möglicherweise führen verschiedene immunologische Mechanismen zum Verlust der Markscheiden: Histologisch definierten Lassmann und Mitarbeiter vier verschiedene Subtypen, wobei Patienten mit einer primär immunologisch induzierten Entmarkung (Subtypen I und II) und solche mit einer primären Erkrankung der Oligodendrogliazellen (Subtyp III und IV) unterschieden werden.[28] Ob sich im Laufe der Chronifizierung der Erkrankung die Ausprägung der Subtypen ändert, bleibt unklar. Jedoch spricht der Nachweis signifikanter Unterschiede im Liquorprofil zwischen Subtyp I einerseits und den Subtypen II und III andererseits – und dabei v. a. das Fehlen oder nur temporäre Vorliegen liquorspezifischer oligoklonaler Banden in den beiden letztgenannten Gruppen – dafür, dass es sich tatsächlich um unterschiedliche immunopathogenetische Entitäten handelt.[29] Der Nachweis von Autoantikörpern gegen humanes Volllängen-Myelin-Oligodendrozyten-Glykoprotein bei einigen Patienten mit Subtyp-II-Läsionen, nicht aber bei Patienten mit anderen Subtypen, stützt diese Hypothese, legt aber auch eine Heterogenität innerhalb der histologischen Subgruppe II nahe.[30][31] Neue bildgebende Verfahren, wie etwa die Diffusions-Tensor-Bildgebung, aber auch neuropathologische Untersuchungen haben seit einigen Jahren die Schädigung von Axonen bei der MS wieder zunehmend in den Vordergrund gerückt. Die Mechanismen, die zu dieser Art von Schäden führen, sind noch nicht vollständig geklärt. Inzwischen ist man zu dem Ergebnis gelangt, dass es bereits bei noch intakter Myelinhülle zu Schädigungen der Axonen kommen kann. Diese Schäden sind in frühen Stadien noch reversibel.[32][33]
Klinische Beobachtungen haben gezeigt, dass die individuellen, entzündlich-demyelinisierenden Läsionen, welche die Schub-bezogenen neurologischen Störungen verursachen, nicht in unmittelbarem Zusammenhang mit der chronisch-progressiven Behinderung stehen.[34] In weit höherem Maß führt offenbar die Atrophie der grauen Substanz zur zunehmenden Behinderung.[35] Aus Obduktionen weiß man, dass die sogenannte normal erscheinende weiße oder graue Substanz diffuse pathologische Veränderungen aufweist.[36] Bei Patienten mit ausgedehnter Demyelinisierung zeigt die graue Substanz eine im Vergleich zu gesundem Kortexgewebe um etwa 20 % verminderte neuronale Dichte. Der Volumenverlust im Nervengewebe kann noch vor anderen MS-Symptomen auftreten und auch dann fortschreiten, wenn sich die Krankheit klinisch bessert. Mit den neuen Kernspintechniken wie der Magnetisations-Transfer-Bildgebung (MTR) wurden letzte Zweifel ausgeräumt, dass sich die neurale Zerstörung nicht auf einzelne Läsionen der weißen Substanz beschränkt, sondern diffus im ganzen ZNS vorkommt, auch in der grauen Substanz.[37] Die Störungen, die bei der Multiplen Sklerose die fortschreitende Behinderung verursachen, sind also nicht nur die Folge eines Oligodendrozyten-Mangels, sondern wesentlich komplexer.
Ursachen und Entstehung
Die Ätiologie (Ursache) der MS ist unbekannt. Hinsichtlich der Pathogenese (Entstehung) existieren zahlreiche Theorien. Die vorliegenden Befunde deuten auf eine multifaktorielle Krankheitsentstehung mit Beteiligung von genetischen Faktoren und Umwelteinflüssen als Auslöser einer immunvermittelten Schädigung hin.[38]
Genetische Prädisposition
Die MS ist keine Erbkrankheit im klassischen Sinne, d. h., sie ist keine monogene Erkrankung und folgt keinem Mendelschen Erbgang. Seit dem Jahr 2010 wurden in genomweiten Assoziationsstudien (GWAS) über 110 häufige genetische Variationen (single nucleotige Polymorphismen, SNP) identifiziert, die bei Erkrankten häufiger als in der Gesamtbevölkerung auftreten und möglicherweise zu einer Prädisposition einer Multiplen Sklerose beitragen. Obwohl jede dieser Varianten alleine nur ein sehr geringes Risiko für die Entwicklung Multipler Sklerose bedeutet, machen diese zusammen etwa 20 Prozent der genetischen Komponenten der Krankheit aus. Unter anderem Polymorphismen von am Interleukin-Signalweg beteiligten Genen sind von wissenschaftlichem Interesse.[39][40][41][42] Viele der gefundenen Genvarianten stehen in direkter Verbindung zum Immunsystem (z. B. die TNFR1-Variante rs1800693,[43] der HLA-Typ HLA-DRB1*15:01[44]) einige von ihnen konnten auch bei Autoimmunkrankheiten wie Diabetes Typ 1 oder Morbus Crohn als genetische Risikofaktoren identifiziert werden.[45][46] Die Genvariante HLA-DR15 erhöht das Risiko für MS um das dreifache.[47] Für den ATP-sensitiven Kaliumkanal KIR4.1 auf der Zellmembran von Gliazellen konnten bei einigen Patienten (46,9 %) auch IgG-Autoantikörper nachgewiesen werden.[48][49]
Das Erkrankungsrisiko ist auch abhängig von der ethnischen Zugehörigkeit.[50] Epidemiologische Studien aus den Vereinigten Staaten weisen darauf hin, dass dort die Multiple Sklerose bei Hispanics und Afroamerikanern seltener auftritt.[51]
Bei eineiigen Zwillingen von MS-Patienten beträgt das Erkrankungsrisiko etwa 35 %, während die Wahrscheinlichkeit, an einer Multiplen Sklerose zu erkranken, bei Geschwistern (etwa 4 %) sowie Verwandten ersten Grades (etwa 3 %), zweiten Grades (etwa 1 %) oder dritten Grades (etwa 0,9 %) deutlich niedriger ist.[52][53] Das Risiko in der Allgemeinbevölkerung beträgt ca. 0,1 %.[54]
Eine Untersuchung dreier eineiiger Zwillingspaare, von denen jeweils nur ein Zwilling an Multipler Sklerose erkrankt war, ergab keine Unterschiede auf genetischer oder epigenetischer Ebene; auch Unterschiede des Transkriptoms fanden sich nicht.[55][56]
Infektionshypothese
Als auslösender Faktor wurde schon früh eine Infektion in der Kindheit mit einem Erreger, der Kreuzreaktivität mit Proteinbestandteilen des Myelins aufweist, vermutet. Ein überzeugender Nachweis eines spezifischen Erregers konnte nicht erbracht werden. Gegen die Möglichkeit einer direkten Übertragung der MS sprechen Studien an Adoptiv- und Stiefkindern von MS-Patienten, bei denen keine erhöhte Erkrankungswahrscheinlichkeit nachgewiesen werden konnte.[57]
Zahlreichen Viren (unter anderem Epstein-Barr-Virus und Humanes Herpesvirus 6) ist eine mögliche Bedeutung bei der Krankheitsentstehung zugeschrieben worden. Tatsächlich ist insbesondere bei Kindern mit Multipler Sklerose eine Immunreaktion gegen das Epstein-Barr-Virus häufiger als bei nicht erkrankten Kindern nachweisbar.[58][59] Auch bakterielle Erreger (unter anderem Chlamydien, Spirochaeten, Rickettsien und Streptococcus mutans) sind mit der Entstehung der Multiplen Sklerose in Zusammenhang gebracht worden.
Die Zunahme der Erkrankungsfälle auf den Färöer-Inseln, die mit der Stationierung britischer Truppen im Jahre 1943 begann und in vier Wellen erfolgte, wird als Beleg für eine mögliche infektiöse Ursache angeführt.[60][61]
Erhöhtes Risiko durch Infektion mit Epstein-Barr-Virus
Eine Längsschnittstudie kam im Januar 2022 zu dem Ergebnis, dass das Epstein-Barr-Virus (EBV) eine Entstehung von MS begünstigen könne. Das Team um den Epidemiologen Alberto Ascherio von der Harvard University prüfte Blutproben von mehr als 10 Millionen US-Militärangehörigen. Diese wurden im Rahmen regulärer HIV-Proben zwischen 1993 und 2013 regelmäßig auf HIV untersucht.[62][63] Bei 801 Personen wurde im Untersuchungszeitraum MS diagnostiziert, hiervon zeigten 800 einen positiven EBV-Status. Zudem konnte gezeigt werden, dass sich an MS erkrankte Personen vor Ausbruch der Erkrankung tatsächlich mit EBV infizierten. Die Studie kommt zu dem Ergebnis, dass eine Infektion mit EBV das Risiko für eine MS um Faktor 32 erhöht. Bei einer Infektion mit dem Cytomegalievirus konnte hingegen kein Zusammenhang für ein erhöhtes Risiko einer MS festgestellt werden.[64]
Zwar sind die Studienergebnisse ein starkes Indiz dafür, dass eine EBV-Infektion Voraussetzung für MS ist.[63] Dennoch ist dadurch nicht gezeigt, dass EBV die (alleinige) Ursache für die Erkrankung ist.
Hygienehypothese
Vermutet wird ein Zusammenhang zwischen der Auseinandersetzung des Immunsystems mit Infektionskrankheiten und einer dadurch verminderten Anfälligkeit für die Multiple Sklerose. Gemäß Hypothese soll eine Verzögerung bestimmter Infektionen (hauptsächlich im Kindesalter), für die Zunahme von allergischen und Autoimmunerkrankungen in modernen Gesellschaften verantwortlich sein.[65] So reduziert das Zusammenleben mit Geschwistern in den ersten sechs Lebensjahren das Risiko, an MS zu erkranken, signifikant, was durch eine vermehrte gegenseitige Ansteckung von Geschwisterkindern mit Infektionskrankheiten erklärt wird.[66]
In modernen Gesellschaften treten auch Endoparasiten wie Darmparasiten selten auf, wodurch eine gegen die Parasiten gerichtete Immunantwort in Form von IgEs nicht mehr stattfinden kann. Eine kleine randomisierte, doppelverblindete klinische Prüfung konnte aber keinen signifikanten Vorteil bei Patienten mit schubförmig remittierender MS sehen, die im Rahmen der Studie mit dem amerikanischen Hakenwurm Necator americanus infiziert wurden.[65]
Vitamin-D-Stoffwechselhypothese
Die in der Äquatorialzone seltener auftretenden Krankheitsfälle werden auch mit dem Vitamin-D-Stoffwechsel zu erklären versucht: Vitamin D entsteht beim Menschen hauptsächlich durch Sonneneinstrahlung in der Haut. Im Kindesalter der Sonne ausgesetzt zu sein sowie ausreichende Vitamin-D-Spiegel im Blut sollen das Risiko senken können, später eine MS zu bekommen.[67] Die niedrige Inzidenz der MS bei traditionell lebenden grönländischen Inuit[68] wurde mit deren Vitamin-D-reicher Ernährung erklärt.[69] Zwei der bekannten Gen-Varianten sind am Vitamin-D-Stoffwechsel beteiligt.[45]
Es gibt Studien, die vermuten lassen, dass durch die Supplementation von Vitamin D das Risiko, an Multipler Sklerose zu erkranken, gemindert werden könnte.[38][70][71] Ein kausaler Zusammenhang konnte daher bisher nicht etabliert werden, es könnte sich auch um eine zufällige Assoziation handeln. Ein therapeutischer Nutzen einer Supplementation von Vitamin D bei MS-Patienten konnte bislang nicht gezeigt werden.[72]
Umweltgifte
Für den häufig behaupteten kausalen Zusammenhang der Krankheit mit Umweltgiften gibt es wenig Nachweise. Auch ergab eine Meta-Analyse keinen deutlichen Zusammenhang zwischen Amalgamfüllungen und der Wahrscheinlichkeit zu erkranken.[73]
Rauchen
Ob Zigarettenrauchen das Risiko für MS erhöht, wird seit Jahren erforscht. Mittlerweile zeichnet sich klar ab, dass Rauchen vor Erkrankungsbeginn das Risiko steigert. Eine Meta-Analyse ergab eine 1,2- bis 1,5-fache Erhöhung des Erkrankungsrisikos.[74] In einer norwegischen Studie ergab sich eine Steigerung des Risikos um den Faktor 1,81.[75]
Auch auf die Entwicklung eines klinisch isolierten Syndroms (CIS) zur sicheren MS scheint sich Rauchen negativ auszuwirken. So ergab sich bei 129 CIS-Patienten, die über 36 Monate beobachtet wurden, bei 75 % der Raucher, aber nur bei 51 % der Nichtraucher im weiteren Verlauf die Diagnose einer MS.[76] Weiter wurde untersucht, wie sich der Konsum von Zigaretten mittelfristig auf das Voranschreiten der Behinderung auswirkt, und ob es mit den Verlaufsformen zusammenhängen könnte. Dabei zeigten sich die größten Unterschiede zwischen Patienten, die nie geraucht haben, und denen, die schon sehr früh damit begonnen haben. Frühe Raucher tendieren häufiger und nach kürzerer Erkrankungsdauer zu chronischen Verlaufsformen, und das Risiko eines Voranschreitens der Behinderung ist deutlich erhöht.[77]
Welche durch das Rauchen ausgelösten pathologischen Veränderungen die Entwicklung und das Voranschreiten der MS beeinflussen können, ist bisher nicht bekannt.
Übergewicht
Vor allem Übergewicht in der Kindheit scheint ein weiterer Faktor bei der Entstehung von Multipler Sklerose im Erwachsenenalter zu sein.[38]
Flammer-Syndrom
In einer Studie mit 58 Multiple Sklerose-Patienten und 259 gesunden Kontrollpersonen wurden sechs von fünfzehn Symptomen des Flammer-Syndroms von den MS-Patienten statistisch signifikant häufiger angegeben, nämlich gestörte Wärmeregulation, kalte Hände oder/und Füße, Schwindel, reduziertes Durstempfinden, Hang zum Perfektionismus, niedriger Body-Mass-Index.[78]
Impfungen
Ein ursächlicher Zusammenhang von Impfungen – und hier insbesondere der Hepatitis-B-Impfung[79] – und dem Auftreten einer MS ist nicht nachweisbar. Zahlreiche Studien mit großen Patientenkollektiven konnten einen aufgrund von Einzelfallberichten und Studien mit kleinen Patientenkollektiven[80] vermuteten Zusammenhang nicht bestätigen.[81][82][83][84][85][86][87] Eine Auswertung von Versichertendaten aus Bayern hat im Gegenteil ergeben, dass Personen, die an MS erkrankt sind, fünf Jahre vor dieser Diagnose seltener geimpft wurden als eine Vergleichsgruppe ohne MS.[88]
Chronische cerebrospinale venöse Insuffizienz
In den 1930er Jahren kam erstmals eine Hypothese auf, der zufolge MS durch eine chronische Blutabflussstörung im Bereich der Hals- und Brustvenen verursacht würde.[89][90][91][92] Diese Hypothese einer chronischen cerebrospinalen venösen Insuffizienz (CCSVI) als Ursache der MS konnte nicht bestätigt werden. In den 1980er Jahren wurde darüber kurze Zeit erneut diskutiert, wiederum ohne zu eindeutigen Ergebnissen zu gelangen.[93] Seit 2008 wird der Hypothese wieder viel Beachtung zuteil anlässlich neuer Studien, die von einem Zusammenhang zwischen MS und dem Auftreten einer dopplersonographisch nachgewiesenen venösen Insuffizienz berichten, welche über einen nachfolgend erhöhten Hirndruck die typischen Entzündungsherde entstehen ließe.[94][95] Die Reaktionen aus Fachkreisen darauf blieb zunächst verhalten,[96] zumal die Ergebnisse von anderen Forschungsgruppen nicht reproduziert werden konnten[97][98] und weitere Studien erneut erhebliche Zweifel an der Qualität der dieser Theorie zugrunde liegenden Studien aufkommen ließen.[99] Die Deutsche Gesellschaft für Neurologie (DGN) warnte darum bereits 2010 „… vor sinnlosen und gefährlichen Gefäßeingriffen bei Multiple-Sklerose-Patienten […]“[100]
Diese Einschätzungen wurden 2013 von einer in der Lancet veröffentlichten Studie untermauert, die zusätzlich zu den bisher verwendeten Ultraschalluntersuchungen der Venen die als Goldstandard der bildgebenden Diagnostik venöser Stenosen angesehene Katheter-Venographie einsetzte. Eine CCSVI wurde in dieser Studie durchgehend bei zwei bis drei Prozent der untersuchten Probanden gefunden – ohne Unterschiede zwischen MS-Patienten, deren Geschwistern und einer gesunden Kontrollgruppe.[101] Auch die in Deutschland durchgeführten Studien ergaben laut einer 2013 veröffentlichten Übersichtsarbeit keine Hinweise auf eine venöse Ursache für MS, weshalb weiterhin davon abgeraten wird, außerhalb von kontrollierten klinischen Studien Venenerweiterungen als Therapieversuch von MS einzusetzen.[102]
Experimentelle Tiermodelle der Multiplen Sklerose
Experimentelle Tiermodelle werden in der Multiple-Sklerose-Forschung eingesetzt, um Mechanismen der Krankheitsentstehung zu untersuchen. Durch gezielte Variation der Experimente kann der Einfluss einzelner Faktoren (beispielsweise Gene und Proteine, die im Immunsystem eine wichtige Rolle spielen) auf die Krankheitsentstehung studiert werden. Auch neue Wirkstoffe mit therapeutischem Ansatz werden zunächst im Tiermodell getestet. Das wichtigste Tiermodell zur MS ist die experimentelle autoimmune Enzephalomyelitis (EAE). Die Krankheit wird vor allem bei spezifischen Stämmen von Mäusen und Ratten untersucht. Die EAE weist neben vielen pathologischen und immunpathogenetischen Ähnlichkeiten auch wichtige Unterschiede zur MS auf, so dass sie mit dieser nicht gleichgesetzt werden darf. So wurde festgestellt, dass die EAE nicht die komplexe Pathologie der MS abbildet. Jedoch spiegeln unterschiedliche Varianten der EAE einzelne immunpathogenetische Aspekte der Multiplen Sklerose wider und können gezielt zur Untersuchung spezifischer Fragen eingesetzt werden.[103][104]
Einfluss des Mikrobioms
In verschiedenen Studien wurde gezeigt, dass das Mikrobiom des Darms einen Einfluss auf das Immunsystem und auf Autoimmunerkrankungen hat.[105] Es gibt Darmbakterien, die das Immunsystem dämpfen, und solche, die es aktivieren. Eine Veröffentlichung stellt fest, dass die Abbauprodukte von bestimmten Darmbakterien für das Nervensystem wichtig sind und weiter geforscht werden müsse.[106]
Erste Ergebnisse einer Studie der Max-Planck-Gesellschaft zeigen, dass sich durch die Übertragung der Darmflora von MS-Patienten an keimfrei aufgezogene Mäuse in fast allen Fällen eine MS-ähnliche Hirnentzündung auslösen läßt.[107]
Eine Studie will bei an MS Erkrankten eine ungünstige Zusammensetzung des Mikrobioms festgestellt haben. Sie vermutete, dass das ursächlich für die Krankheit ist.[108]
Der Einsatz von Antibiotika wird von einigen Forschern als Risikofaktor betrachtet.[109][110]
Mikrobiom und kurzkettige Fettsäuren: Bei nicht vorbehandelten MS-Patienten wurde (besonders nach dem ersten Schub) eine deutliche Verminderung von kurzkettigen Fettsäuren (zum Beispiel Propionsäure) im Blut und im Stuhl festgestellt. In einer neuen Studie[111] wurde diesen Patienten zusätzlich zu einer Immuntherapie oral Propionat gegeben. Hierauf stellte man eine günstige Veränderung der Zelltypen des Darm-Immunsystems fest, die mit einem genetischen Wandel des Mikrobioms zusammenhing. Dies führte offensichtlich zu einer positiven Beeinflussung des gesamten Immunsystems der Kranken, die in der Weiterbehandlung mit zusätzlichem Propionat insgesamt einen milderen Krankheitsverlauf zeigten (Verringerung der Schubanzahl, Verbesserung des gesamten klinischen Bildes).
Verlaufsformen
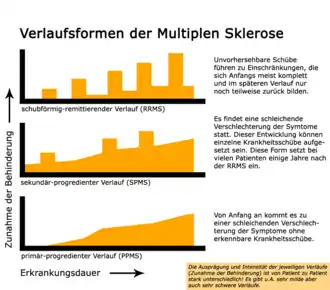
Die Multiple Sklerose hat unterschiedliche Verlaufsformen. Wichtig für das Verständnis der Erkrankung und der Verlaufsformen ist der Begriff des Schubes. Ein Schub ist definiert als das Auftreten neuer oder das Wiederaufflammen bereits bekannter klinischer Symptome, die länger als 24 Stunden anhalten und denen eine entzündlich-entmarkende Schädigung des ZNS zugrunde liegt. Typischerweise treten neue Symptome bei der MS subakut, also innerhalb von Stunden bis Tagen, auf. Um einen neuen Schub von einem vorangegangenen abgrenzen zu können, müssen definitionsgemäß mindestens 30 Tage zwischen beiden klinischen Ereignissen liegen. Die Dauer eines Schubes beträgt meist einige Tage bis wenige Wochen. Je nachdem, ob sich die aufgetretenen Symptome vollständig oder nur unvollständig zurückbilden, spricht man von einer kompletten oder inkompletten Remission. Von echten Schüben sind sogenannte Pseudoschübe abzugrenzen, die im Rahmen einer Temperaturerhöhung (Uhthoff-Phänomen) oder infektassoziiert auftreten und zu einer vorübergehenden Verschlechterung klinischer Symptome führen können.
Unterschieden werden folgende Verlaufsformen:[112]
Schubförmig remittierende MS (RRMS) und sekundär progrediente MS (SPMS)
Bei der schubförmig remittierenden Multiplen Sklerose (englisch relapsing remitting MS, kurz RRMS oder RR-MS) lassen sich einzelne Schübe abgrenzen, die sich vollständig oder unvollständig zurückbilden. Die schubförmig remittierende MS betrifft 85 % bis 90 % der MS-Patienten und beginnt im Durchschnitt im Alter von circa 30 Jahren. 75 % der Betroffenen sind weiblich.[113] Die RRMS kann im weiteren Krankheitsverlauf (ca. 50 % der Fälle nach 10 bis 15 Jahren[114]) in eine sekundär progrediente MS (englisch secondary progressive MS, kurz SPMS oder SP-MS) übergehen, die durch eine langsame Zunahme neurologischer Dysfunktionen gekennzeichnet ist. Zusätzlich können aber auch hier noch Schübe den langsam fortschreitenden Verlauf negativ beeinflussen.
Für einige Faktoren konnte nachgewiesen werden, dass sie die Wahrscheinlichkeit einzelner Schübe erhöhen – diese werden als Triggerfaktoren bezeichnet. Als gesichert gilt, dass im unmittelbaren Zeitraum nach einer Infektion (wie der Grippe oder der durch Viren verursachten Infektionen des Magen-Darm-Traktes) die Schubwahrscheinlichkeit erhöht ist.[115][116]
Während der Schwangerschaft ist das Schubrisiko (insbesondere im dritten Trimenon) im Vergleich zur Krankheitsaktivität des vorausgegangenen Jahres deutlich reduziert. In den drei auf die Entbindung folgenden Monaten ist es hingegen erhöht. Im Verlauf der folgenden 21 Monate unterscheidet sich die Krankheitsaktivität nicht von der Situation vor der Schwangerschaft.[117]
Kontrovers diskutiert wird der Einfluss psychischen Stresses (wie Beziehungs- und Eheprobleme, Stress am Arbeitsplatz, Verlust eines nahen Angehörigen) auf das Schubrisiko. Vielen früher durchgeführten Studien zu diesem Thema werden methodische Mängel vorgeworfen.[118] Neuere Studien deuten auf einen geringen bis moderaten Einfluss psychischen Stresses auf die Schubwahrscheinlichkeit hin.[119][120]
Primär progrediente MS (PPMS)
Im Gegensatz zu den anderen Formen der MS beginnt die primär progrediente MS (englisch primary progressive, PPMS oder PP-MS) nicht mit Schüben, sondern mit einer schleichenden Progression der neurologischen Defizite ohne Rückbildung. Selten können im weiteren Verlauf jedoch überlagerte Schübe auftreten. Die PPMS betrifft 10 % bis 15 % der Patienten und beginnt im Durchschnitt im Alter von circa 40 Jahren. Im Unterschied zur RRMS sind Männer und Frauen etwa gleich häufig von PPMS betroffen.[121]
Symptome
Die ersten Symptome treten meist zwischen dem 15. und 40. Lebensjahr im Rahmen eines Schubes auf. Einige Patienten sind auch etwas jünger. Während sich die Schübe bei Erkrankungsbeginn meist völlig zurückbilden, bleiben im späteren Krankheitsverlauf nach Schüben vermehrt neurologische Defizite zurück. Zu Beginn der Erkrankung werden Seh- und Sensibilitätsstörungen häufig beobachtet. Nicht selten beginnt die Erkrankung zunächst mit einem isolierten Symptom, wofür sich der englische Begriff des klinisch isolierten Syndroms (CIS) eingebürgert hat.
Welches Symptom in einem Schub entsteht, ist abhängig von der jeweiligen Lokalisation des aktiven Entmarkungsherdes im zentralen Nervensystem: So bewirken Entzündungen im Bereich des Sehnervs (Retrobulbärneuritis) Sehstörungen, die sich als Sehunschärfe oder milchiger Schleier bemerkbar machen und auch mit Augenschmerzen (typisches Erstsymptom)[122] einhergehen können. Durch Entzündungsherde im Bereich sensibler Bahnsysteme können Sensibilitätsstörungen wie Missempfindungen (Parästhesien), Taubheitsgefühle und Schmerzen auftreten. Häufig sind hierbei die Hände und Beine (Füße und Unterschenkel) betroffen. Schmerzen können auch durch eine Trigeminusneuralgie, Krämpfe der Muskulatur sowie durch das Lhermitte-Symptom verursacht sein.[123] Das Lhermitte-Zeichen gilt als typisch für die MS und kann ein Hinweis auf Herde im Bereich des Halsteils des Rückenmarks sein. Ist das motorische System betroffen, treten Lähmungserscheinungen (Paresen) der Extremitäten auf, wobei durch eine abnorme unwillkürliche Erhöhung des Muskeltonus (spastische Tonuserhöhung) die Bewegungsfähigkeit des Patienten zusätzlich eingeschränkt sein kann. Herde in Hirnstamm und Kleinhirn können zu Störungen der Augenbewegungen (Doppeltsehen und Nystagmen), Schluckstörungen (Dysphagie), Schwindel sowie Störungen der Bewegungskoordination (Ataxie) und Sprechstörungen (Dysarthrie) führen. Als Charcot-Trias wird der bei Entmarkungsherden im Bereich des oberen Kleinhirnstiels auftretende Symptomenkomplex von Intentionstremor, Nystagmus und skandierender (abgehackter) Sprache bezeichnet. Eine temporale Abblassung der Sehnervenpapillen, das Vorliegen einer Paraspastik und das Fehlen der Bauchhautreflexe wird als Marburg-Trias bezeichnet. Sind vegetative Zentren und Bahnen betroffen, kann es zu Störungen der Kontrolle der Blasen- und Darmfunktion und zu sexuellen Funktionsstörungen kommen.
Bei vielen der Patienten tritt im Verlauf gesteigerte physische oder kognitive Ermüdbarkeit (Fatigue) auf. Diese Ermüdbarkeit tritt unabhängig von körperlicher und psychischer Belastung auf und nimmt im Laufe des Tages zu. Wie auch die anderen Symptome kann sich die Fatigue im Rahmen des Uhthoff-Phänomens (deutlicheres Hervortreten der Symptome durch Temperaturerhöhung) verstärken. Physische Fatigue betrifft über 65 % der Patienten und kann jegliche physische Aktivität beeinträchtigen oder aber nur bestimmte Muskelgruppen (lokale Fatigue). Kognitive Fatigue zeigt sich in Form von abfallenden Leistungen bei anhaltender kognitiver Anstrengung, wobei dann Leistungssteigerungen durch Übungseffekte nicht greifen.[124]
Unterschiedliche muskuläre Defizite können sich in Bewegungseinschränkungen manifestieren. Beispielsweise kann die Kniestabilität in der Standphase durch eine Fehlfunktion der Plantarflexoren und der ischiocrualen Muskulatur herabgesetzt werden. In der Schwungphase kann eine zu geringe Aktivierung der Zehenflexoren eine unzureichende Knieflexion verursachen. Dadurch können in Kombination mit einer gestörten Plantarflexion Probleme beim push off entstehen.[125]
Zudem können kognitive und affektive Störungen auftreten. Kognitive Störungen betreffen über 40 % der Patienten mit MS.[126] Häufig ist die allgemeine kognitive Geschwindigkeit herabgesetzt, was sich in Form erhöhter Reaktionszeiten in kognitiven Tests zeigt. Die allgemeine Intelligenz sowie sprachliche Fähigkeiten gelten als weitgehend unbeeinträchtigt.[127] Etwa 20 % der Patienten mit Multipler Sklerose erfüllen im vollen Umfang die Diagnose-Kriterien für eine depressive Erkrankung und mindestens 30 % zeigten depressive Symptome in potentiell klinisch relevantem Ausmaß.[128] Patienten mit MS seien damit disproportional häufig von Depressivität betroffen, insbesondere auch im Vergleich zu Patienten mit anderen schwerwiegenden chronischen Erkrankungen wie z. B. ALS.[129] Angst-Störungen treten ebenfalls häufig bei Patienten mit MS auf.[130]
Im späten Stadium kann auch eine subkortikale Demenz auftreten.[131] Die Klassifizierbarkeit als Demenz wurde jedoch aufgrund der vergleichsweise milderen und weniger umfangreichen Symptomatik von MS in Frage gestellt.[132]
Ein Mittel zur Quantifizierung der Beeinträchtigungen des Patienten ist die Verwendung der Expanded Disability Status Scale (EDSS). Anhand dieser Skala wird der aktuelle Schweregrad der Behinderungen des Betroffenen eingestuft, wobei zuvor die Beeinträchtigungen in sieben neurologischen Systemen bestimmt werden. Betrachtet man den gesamten Krankheitsverlauf, sind es die Fatigue, Störungen der Blasenfunktion sowie Störungen des motorischen Systems wie Lähmungen und spastische Tonuserhöhungen, die das Leben der Betroffenen häufig am meisten beeinträchtigen. Obwohl EDSS eine gängige Methode ist, wurde sie für einige ihrer Probleme kritisiert.[133][2]
Diagnostik
Vor der Ära der bildgebenden Verfahren war die Diagnose der Multiplen Sklerose vor allem auf die klinische Einschätzung von Symptomen und Anamnese gestützt. Heute wird die Diagnose nach einheitlichen Diagnosekriterien der Multiplen Sklerose gestellt. Als Grundlage für die Diagnosestellung dient die zuletzt 2017 überarbeitete Fassung der McDonald-Kriterien.[134][135][136][137][138]
Klinische Diagnosekriterien
Klinisches Hauptkriterium der Multiple-Sklerose-Diagnose ist der Nachweis einer räumlichen und zeitlichen Streuung (Dissemination) von Entzündungsherden. Mit räumlicher Dissemination ist das Vorliegen von Entzündungsherden an mehr als einem Ort im zentralen Nervensystem gemeint. Zeitliche Dissemination bedeutet, dass im Verlauf der Erkrankung neue Herde hinzukommen, die zu klinischen Symptomen führen können. Sind weder in der Anamnese noch in der neurologischen Untersuchung Symptome für in der Bildgebung nachweisbare Herde vorhanden, wird von klinisch stummen Läsionen gesprochen. Eine räumliche und zeitliche Dissemination von Krankheitsherden ist zwar typisch für die MS, diese kann jedoch auch durch andere Erkrankungen verursacht werden. Daher wird in den Diagnosekriterien ausdrücklich betont, dass die Diagnose einer MS nicht gestellt werden darf, wenn die Symptome und pathologischen Befunde von einer anderen Erkrankung besser erklärt werden können. Neben Anamnese und klinisch-neurologischer Untersuchung werden eine Reihe von Zusatzuntersuchungen zur Diagnose einer Multiplen Sklerose durchgeführt:
Bildgebende Untersuchungen
In den mittels Magnetresonanztomografie (MRT) gewonnenen Schichtbildern des Gehirns und des Rückenmarks können entzündete und vernarbte Gewebebereiche dargestellt werden. Mithilfe eines gadoliniumhaltigen Kontrastmittels, wie beispielsweise Gadopentetat-Dimeglumin oder Gadotersäure, können akute Krankheitsherde nachgewiesen werden, da in ihrem Bereich im Unterschied zu intaktem Gewebe die Blut-Hirn-Schranke durchlässig für Kontrastmittel ist. Typisch für die MS sind periventrikulär (um die Seitenventrikel) gelegene Entzündungsherde im Marklager des Gehirns und sogenannte Balkenherde.
Die MRT-Untersuchung kann wesentlich zur Diagnose beitragen. Zwar ist nach den McDonald-Kriterien eine Diagnosestellung auch ohne MRT-Bildgebung möglich (bei zwei Schüben und objektivierbaren Funktionsausfällen in mindestens zwei neurologischen Systemen), bei vielen Patienten mit klinischem Erstereignis ist jedoch zur frühen Diagnosestellung eine MRT notwendig. Mit der MRT-Untersuchung können sowohl die räumliche als auch die zeitliche Dissemination der Entzündungsherde in Gehirn und Rückenmark nachgewiesen werden. Die McDonald-Kriterien geben genau an, wie viele Entzündungsherde in welcher Region des ZNS nachweisbar sein müssen, um hinsichtlich der räumlichen Streuung von einem positiven MRT-Befund sprechen zu können. Der Nachweis einer zeitlichen Dissemination mittels MRT gelingt nach der letzten Revision der McDonald-Kriterien jetzt auch bereits mit einer einmaligen MRT, sofern gleichzeitig frische und alte Läsionen zu erkennen sind, die bestimmte zusätzliche Kriterien erfüllen. Die Diagnose einer MS erfolgt üblicherweise nicht allein aufgrund bildgebender Befunde.[135]
Blutuntersuchungen
Ein für die Multiple Sklerose spezifischer Biomarker im Blut ist nicht bekannt. Gängige Entzündungsparameter wie die Anzahl der weißen Blutkörperchen, die Blutsenkungsgeschwindigkeit oder das C-reaktive Protein sind bei der MS auch während eines Schubereignisses nicht zwangsläufig erhöht.[139] Ob die Serumbestimmung von Antikörpern, die gegen das basische Myelinprotein (MBP) oder das Myelin-Oligodendrozyten-Glykoprotein (MOG) gerichtet sind, zur Diagnosestellung beitragen kann, bleibt umstritten.[140][141]
Liquordiagnostik
Im Liquor cerebrospinalis hingegen ergibt sich bei über 95 % der Patienten ein pathologischer Befund. Daher ist bei Krankheitsverdacht eine Lumbalpunktion empfehlenswert. Bei 50 % der Patienten findet sich eine leichte Vermehrung lymphozytärer Zellen im Liquor (lymphozytäre Pleozytose). Eine intrathekale Antikörpersynthese mit Nachweis oligoklonaler Banden (OKB) in der isoelektrischen Fokussierung als Hinweis auf einen chronisch-entzündlichen Prozess im zentralen Nervensystem ist bei über 95 % der Patienten nachweisbar. Die genaue Sensitivität des Tests ist allerdings abhängig vom untersuchenden Labor.[142] Eine intrathekale Synthese von Antikörpern gegen Masern, Röteln und Varizella-Zoster-Viren (MRZ-Reaktion) findet sich bei 89 % der Patienten;[143] eine sogenannte 'bi- oder trispezifische Reaktion', d. h. eine intrathekale Synthese von Antikörpern gegen mindestens zwei der drei genannten Erreger, findet sich bei ca. 67 % aller erwachsenen MS-Patienten[144]. Für die bi- oder trispezifische MRZ-Reaktion wurde ein positives Wahrscheinlichkeitsverhältnis von 25,1 berichtet, d. h. ein positiver Befund erhöht die Prä-Test-Odds für die Diagnose MS um den genannten Faktor;[144] die Spezifität wird mit 97,5 % angegeben.[144] Die hier angeführten Befunde (lymphozytäre Pleozytose, OKB, MRZ-Reaktion) gelten als typisch für die MS, beweisen für sich alleine genommen das Vorliegen einer MS aber nicht.
Neurophysiologische Untersuchungen
Eine Verlängerung der Latenzzeiten bei der Untersuchung der evozierten Potentiale (insbesondere der visuell und somatosensorisch evozierten Potentiale) kann auf die durch die Demyelinisierung gestörte Erregungsleitung hinweisen. Bei fortgeschrittener Erkrankung kann, bedingt durch die axonale Schädigung, auch eine Reduktion der Amplitude auftreten.
Differenzialdiagnose
Die Differenzialdiagnose, also die Abgrenzung der MS gegenüber anderen Krankheitsbildern, umfasst eine Vielzahl von Erkrankungen. Neben Infektionskrankheiten (insbesondere die Neurosyphilis, die Neuroborreliose oder die HIV-Infektion) müssen auch andere chronisch-entzündliche Krankheiten (wie Kollagenosen, Vaskulitiden) ausgeschlossen werden. Auch andere entzündlich-demyelinisierende Erkrankungen (zum Beispiel die Neuromyelitis optica, die Tropische Spastische Paraparese oder die Akute disseminierte Enzephalomyelitis (ADEM)) sind zu bedenken. Krankheiten des Stoffwechsels (wie Leukodystrophien) können ebenso zu ähnlichen Symptomen und insbesondere bildgebenden Befunden wie bei einer MS führen. Ein Mangel an Vitamin B12 kann im Rahmen einer Funikulären Myelose Symptome einer MS imitieren. Auch die Möglichkeit, dass den Beschwerden psychiatrische Erkrankungen zugrunde liegen, muss bedacht werden.[145]
Die Diagnose „unklarer Schlaganfall“ bei jungen Patienten kann eine Verlegenheitsdiagnose sein, hier muss man differentialdiagnostisch auch an MS denken.
Obligate Laboruntersuchungen in der diagnostischen Phase umfassen C-reaktives Protein (CRP), großes Blutbild, Blutzucker, Vitamin-B12, Rheumafaktor, Antinukleärer Antikörper (ANA), Antiphospholipid-Antikörper, Lupus-Antikoagulans, Angiotensin-konvertierendes Enzym (ACE), Borrelienserologie und Urinstatus. Fakultativ werden bei klinisch möglicher Differenzialdiagnose durchgeführt: Anti-Neutrophile cytoplasmatische Antikörper (ANCA), Extractable Nuclear Antigens (ENA), HIV-Serologie, Humanes T-lymphotropes Virus 1- (HTLV-1)-Serologie, Treponema-Pallidum-Hämagglutinations-Assay (TPHA), langkettige Fettsäuren, Mykoplasmen-Serologie.
Therapie
Multiple Sklerose ist bislang nicht heilbar. Ziel aller therapeutischen Maßnahmen ist es, die Unabhängigkeit des Patienten im Alltag zu erhalten und die beste erreichbare Lebensqualität zu gewährleisten. Die bestehenden therapeutischen Möglichkeiten lassen sich in die Schubtherapie, die immunmodulierende Langzeittherapie und die Behandlung symptomatischer Beschwerden unterteilen. Ein Schwerpunkt liegt auch auf der Verhinderung von Komplikationen der MS, die beispielsweise infolge der Immobilität des Patienten auftreten können. Das Erreichen dieser Therapieziele setzt eine gute Zusammenarbeit von Patient, Pflegenden, Umfeld des Patienten, Neurologen, Hausarzt, Physiotherapeuten, Ergotherapeuten und Vertretern weiterer Disziplinen voraus. Die Auswahl der therapeutischen Maßnahmen berücksichtigt immer den individuellen Fall des Patienten.
Schubtherapie
Eine Schubtherapie ist bei funktioneller Beeinträchtigung des Patienten angezeigt. Bei rein sensiblen Schüben ist eine Schubtherapie meist nicht notwendig. Die Gabe von hochdosierten therapeutischen Glucocorticoiden kann während eines Schubes die Rückbildung von Symptomen initiieren und beschleunigen. Glucocorticoide wirken entzündungshemmend. Unter anderem vermindern sie die Durchlässigkeit der Blut-Hirn-Schranke, so dass weniger weiße Blutkörperchen in die Entzündungsherde im ZNS einwandern können. Es gibt bis heute keine studiengestützten Hinweise, dass therapeutische Glucocorticoide den Langzeitverlauf der Krankheit positiv beeinflussen.
Üblich ist die intravenöse Therapie mit 1000 mg Methylprednisolon über drei (bis fünf) Tage. Sind nach der ersten Pulstherapie die Auswirkungen eines Schubes nach mindestens zwei Wochen noch immer relevant, soll nach Empfehlung der Deutschen Multiple Sklerose Gesellschaft eine zweite Pulstherapie mit erhöhter Dosierung bis zu fünf Tage je 2000 mg stattfinden. Häufige Nebenwirkungen der Glucocorticoidtherapie sind Schlafstörungen und Stimmungsschwankungen. Da die Glucocorticoidgabe nur über eine kurze Zeit erfolgt, treten keine Nebenwirkungen auf, die für eine Langzeittherapie mit Glucocorticoiden typisch sind (beispielsweise Cushing-Syndrom).
Sollte auch die zweite Pulstherapie nicht befriedigend wirken, kann zur Beendigung eines akuten Schubes eine Plasmapherese erwogen werden. Die Anwendung der Plasmapherese wird hauptsächlich bei Schüben erwogen, die den Patienten funktionell stark beeinträchtigen (beispielsweise bei Lähmungen). Bei etwa 40 % der Patienten kann durch die Plasmapherese eine Besserung der Beschwerden erreicht werden.[146] Ihre Durchführung bleibt spezialisierten Zentren vorbehalten, da als mögliche Komplikationen Störungen des Herz-Kreislauf-Systems und Infektionen auftreten, die in seltenen Fällen einen schwerwiegenden Verlauf nehmen können.[147][148]
Immunmodulation und Immunsuppression
Die Begriffe Immunmodulation und Immunsuppression werden in der Literatur nicht immer klar abgegrenzt. Immunmodulierende Therapien, die nicht immunsuppressiv wirken, sind Betainterferone und Glatirameracetat. Immunmodulierende Therapien, die immunsuppressiv wirken, sind Alemtuzumab, Cladribin, Fingolimod, Fumarsäuredimethylester, Natalizumab und Teriflunomid (s. a. Leflunomid).[149]
Zur Reservetherapie bei der Multiplen Sklerose kommen klassische Immunsuppressiva wie Azathioprin, Cyclophosphamid, Methotrexat und Mitoxantron in Frage.[150] Ziel der Langzeittherapie mit diesen Substanzen ist es, neue neurologische Defizite zu verhindern und die Verschlechterung bestehender Defizite zu verzögern. Auf pathophysiologischer Ebene sollen die eingesetzten Wirkstoffe axonale Schäden verhindern, indem sie die Entzündungsreaktion im ZNS dämpfen. Die Immunsuppressiva erreichen dies, indem sie die Vermehrung von weißen Blutkörperchen hemmen. Die Wirkprinzipien der immunmodulierenden Substanzen sind vielfältig und nicht vollständig verstanden. Der Monoklonale Antikörper Natalizumab wurde gezielt als ein Wirkstoff entwickelt, der das Einwandern von weißen Blutkörperchen in das ZNS verhindern soll. Medikamente, die immunsuppressiv wirken, können das Risiko für Infektionen (in seltenen Fällen auch schwerwiegende Infektionen wie PML sowie opportunistische Infektionen) und Krebserkrankungen erhöhen. Dies wurde bei MS-Therapien, die nicht immunsuppressiv wirken, bisher nicht gezeigt.[151][152][153] Allgemein unterscheiden sich die verschiedenen MS-Medikamente ebenfalls in ihrem Sicherheitsprofil beim Einsatz während der Schwangerschaft.[154]
Grundlage der Behandlung im deutschsprachigen Raum ist die Therapieempfehlung der „Deutschen Gesellschaft für Neurologie“, der führende Forscher und spezialisierte Ärzte aus Deutschland, Österreich und der Schweiz angehören.[155] Die Wahl der Therapie richtet sich zunächst danach, ob es sich um eine schubförmig verlaufende oder primär progrediente Form (PPMS) resp. sekundär progrediente Form (SPMS) der Erkrankung handelt.[156]
Als Zusatz zur Immuntherapie wird neuerdings[111] die Gabe von kurzkettigen Fettsäuren diskutiert, die einen günstigeren Krankheitsverlauf bewirken soll.
Für Personen mit Autoimmunkrankheiten oder chronisch-entzündlichen Erkrankungen wird ein umfassender Impfschutz empfohlen. Im Idealfall sollte die Immunisierung vor Beginn einer immunsuppressiven Therapie abgeschlossen sein. Die Beobachtung, dass Infektionskrankheiten (z. B. Influenza) bei Personen mit MS das Risiko für einen Schub erhöhen können, unterstreicht die Bedeutung eines umfassenden Impfschutzes.[157]
Schubförmiger Verlauf (RRMS)
| Wirkstoff | Markenname | Remissionsrate ggü.
Placebogruppe |
Publikationen |
|---|---|---|---|
| Basistherapie (nach den Leitlinien der MSTKG) | |||
| Beta-Interferone | Avonex, Betaferon, Extavia, Rebif | 10 % | [159][160] |
| Fumarsäuredimethylester | Tecfidera | 9 % | [161][162] |
| Glatirameracetat | Copaxone | 7 % | [163] |
| Alternativtherapie (bei Kontraindikationen zur Basistherapie) | |||
| Azathioprin | Imurek | [164] | |
| Immunglobuline | Gamunex 10 %, Octagam | [165] | |
| Eskalationstherapie | |||
| Alemtuzumab | Lemtrada | n. a. | |
| Cladribin (Tabletten) | Mavenclad | n. a. | |
| Fingolimod | Gilenya | 7 % | [166][167] |
| Natalizumab | Tysabri | 12 % | [168] |
| Ocrelizumab | Ocrevus | n. a. | |
| Mitoxantron | Ralenova | 14 % | [169] |
| Cyclophosphamid | Endoxan | [170] | |
Grundsätzlich wird bei der RRMS eine frühestmögliche Therapie empfohlen, um bereits im Frühstadium der Erkrankung axonale Schäden zu begrenzen. Für diesen Ansatz spricht auch, dass die frühe Phase der MS meist durch eine besonders hohe entzündliche Aktivität im ZNS gekennzeichnet ist.
Basistherapie: Gleichberechtigte Therapeutika der ersten Wahl sind das Beta-Interferon-Präparate, Fumarsäuredimethylester, Glatirameracetat und Teriflunomid (in der Schweiz ebenfalls Fingolimod). Diese Therapien werden als Basistherapien bezeichnet – bei milden / moderaten Verlaufsformen. Kommt es unter einer dieser Therapien zu einem raschen Fortschreiten der neurologischen Defizite, kann auf eine andere Basistherapie oder eine Eskalationstherapie (Zweitlinientherapie) gewechselt werden.
Seit Herbst 2019 sind die Beta-Interferone (z. B. Rebif) auch zugelassen, wenn eine Schwangerschaft oder Kinderwunsch besteht. Wenn aus klinischer Sicht notwendig, muss die Therapie nicht wegen einer Schwangerschaft unterbrochen oder verschoben werden. Da keine gesundheitsschädlichen Auswirkungen für das Kind zu erwarten sind, ist Stillen uneingeschränkt unter Interferon beta möglich.[171][172]
Eskalationstherapie: Wirkstoffe der 1. Wahl, die in der Eskalationstherapie eingesetzt werden, sind Alemtuzumab, Cladribin, Fingolimod, Natalizumab und Ocrelizumab. Wirkstoffe der 2. Wahl sind Mitoxantron und in seltenen Fällen Cyclophosphamid. Nicht für alle Präparate konnte in Meta-Analysen ein überzeugender Wirksamkeitsnachweis geführt werden.[173]
Im August 2017 wurde Cladribin (Markenname: Mavenclad, Merck KGaA) in der EU – als orale Impulstherapie mit lang anhaltender Wirkung (Tabletten) – zur Behandlung der RMS (RRMS und SPMS) bei Patienten mit hoher Krankheitsaktivität zugelassen.[174] Die Zulassung in den USA erfolgte im März 2019[175].
Nebenwirkungen: Die Therapie wird im Allgemeinen fortgeführt, solange ein positiver Effekt auf die Entwicklung der MS festzustellen ist und keine schwerwiegenden Nebenwirkungen auftreten. Deswegen wurde im März 2018 (das in der EU im Juli 2016 zugelassene[176]) Daclizumab vom Markt genommen. Wenn Kontraindikationen gegen diese Mittel bestehen, können Azathioprin und intravenöse Immunglobuline als Mittel zum Einsatz kommen. Für Mitoxantron gibt es aufgrund schwerer dosisabhängiger Nebenwirkungen (Mitoxantron ist kardiotoxisch) eine begrenzte Lebensdosis, die etwa nach zwei bis fünf Jahren erreicht wird. Bei der Behandlung mit Beta-Interferonen und Natalizumab kann es zur Entstehung von neutralisierenden Antikörpern (nAb) kommen. Während ein möglicher Wirkverlust durch nAbs für die Beta-Interferone umstritten ist, scheinen nAbs die Wirksamkeit von Natalizumab tatsächlich zu verringern.
Eine schwerwiegende Nebenwirkung von Natalizumab und Fingolimod, für die die immunsuppressive Wirkung verantwortlich gemacht wird, ist die durch das JC-Virus ausgelöste progressive multifokale Leukenzephalopathie (PML).[177][178][179] Im November 2017 veröffentlichte der Hersteller von Fingolimod (Novartis) in einem so genannten Rote-Hand-Brief (RHB) zahlreiche kardiale Kontraindikationen, bei denen Fingolimod bzw. das Novartis-Produkt Gilenya nicht verordnet werden darf.[180] Im September 2019 veröffentlichte Novartis einen weiteren RHB zu einer neuen Kontraindikation bei Anwendung während der Schwangerschaft und bei Frauen im gebärfähigen Alter, die keine wirksame Verhütungsmethode anwenden.[181]
Die Europäische Arzneimittelagentur (EMA) untersucht seit April 2019 mehrere Fälle von schweren, teilweise tödlichen Nebenwirkungen unter Alemtuzumab.[182][183] Zwischenzeitlich wurden dazu auch seitens des pharmazeutischen Unternehmens (Sanofi Genzyme) verschiedene Rote-Hand-Briefe (RHB) für Alemtuzumab, u. a. im April 2019 und im Januar 2020 veröffentlicht.[184][185]
Zu Cladribin-Tabletten gab es seit der Zulassung im September 2017 für die Behandlung der MS keinen Rote Hand-Brief. Auf dem weltweit größten jährlichen internationalen Kongress, der der Grundlagen- und klinischen Forschung bei Multipler Sklerose gewidmet ist, ECTRIMS, hieß es 2019, dass bis dahin keine relevanten Nebenwirkungen gefunden worden seien, auch sind keine PML-Fälle aufgetreten.[186]
Die Beta-Interferon-Präparate und Glatirameracetat sind unter bestimmten Voraussetzungen auch zur Behandlung des Klinisch isolierten Syndroms (CIS) zugelassen.
Chronisch progrediente Verlaufsformen
Für die Behandlung der sekundär progredienten MS (SPMS) können das subkutan verabreichte Betainterferon 1a (bei vorhandener Schubaktivität) sowie Betainterferon 1b zum Einsatz kommen. Zudem kann der für diese Indikation seit 2002 zugelassene Arzneistoff Mitoxantron eingesetzt werden. Nach Erreichen der Höchstdosis von Mitoxantron und fortbestehender Krankheitsaktivität können Therapieversuche mit vierteljährlichen hochdosierten intravenösen Glucocorticoidstößen (üblicherweise Methylprednisolon) oder Cyclophosphamid versucht werden.
Zur Behandlung der primär chronisch-progredienten MS (PPMS), aber auch der schubförmigen MS, wurde im März 2017 durch die FDA in den USA Ocrelizumab zugelassen[187][188] mit der Auflage, einige Phase-IV-Studien durchzuführen[189], sowie im September 2017 durch Swissmedic auch in der Schweiz.[190] Die EU-Zulassung erfolgte im Januar 2018.[191]
Hit-hard-and-early-Strategie
Da die Wirksamkeit der Basistherapie (s. o.) mit nur ca. 30–40 % Schubreduktion verbunden ist – im Vergleich zu den (hoch-)aktiven Therapien der Eskalationstherapie (s. o.) in Höhe von ca. 50–70 % Schubratenreduktion, setzt sich die so genannte Hit-hard-and-early-Strategie mehr und mehr durch: Experten empfehlen, gleich zu Beginn mit den Medikamenten der Eskalationstherapie zu beginnen.[192][193][194]
Pipeline
Es befinden sich zahlreiche Substanzen in der klinischen Entwicklung (Phase III), z. B. die sogenannten small molecules Ozanimod (seit Mai 2020 unter anderem in der EU zugelassen[195]) von Bristol-Myers Squibb respektive Celgene[196][197] und Siponimod (von Novartis).[198] Auch Siponimod wurde inzwischen zugelassen.[199] Ein Brutontyrosinkinase-Inhibitor (BTKi) Evobrutinib befand sich 2019 noch in der klinischen Entwicklung.[200]
Symptomatische Therapie
Im Verlauf der MS können viele Symptome zu einer Verminderung der Lebensqualität führen. Die jeweiligen Funktionsstörungen und ihr Ausmaß sind dabei bei jedem Patienten unterschiedlich ausgeprägt. Besonders häufig und einschränkend sind Gehbehinderung, Spastik, Schmerzen, Blasenfunktionsstörungen, Sprech- und Schluckstörungen, eine schnellere psychische und physische Ermüdbarkeit (Fatigue) sowie depressive Störungen. Zur Behandlung dieser Symptome eignen sich neben Änderungen der Lebensführung physiotherapeutische,[201] logopädische, ergotherapeutische, psychotherapeutische, medikamentöse und operative Maßnahmen.[202] Besonders wichtig ist die Prophylaxe schwerwiegender Komplikationen wie Aspirationspneumonien, Lungenembolien, Thrombosen, Osteoporose, Dekubitalgeschwüren, Gelenkkontrakturen, Harnwegsinfektionen und der Exsikkose (Austrocknung). Diese Komplikationen sind mit für die im Vergleich zur Gesamtbevölkerung verminderte Lebenserwartung bei MS-Patienten verantwortlich.
Behandlung der Gehbehinderung
Wenn eine Multiple Sklerose weiter fortgeschritten ist, können die Betroffenen eine Gehbehinderung entwickeln, die durch Krankengymnastik und bestimmte, z. B. krampflösende Medikamente behandelt werden kann. Hat die Gehbehinderung einen bestimmten Schweregrad, kommt eine Behandlung mit Fampridin infrage. Fampridin ist (als Fampyra) in Deutschland seit 2011 für Patienten zugelassen, die als Folge einer multiplen Sklerose eine Gehbehinderung höheren Grades haben (Grad 4–7 auf der EDSS-Behinderungsskala). Fampridin ist ein Kaliumkanalblocker. Er wirkt auf geschädigte Nerven, wo er verhindert, dass geladene Kaliumteilchen aus den Nervenzellen entweichen. Es wird angenommen, dass dadurch die elektrischen Impulse weiter an den Nerven entlang wandern können, um die Muskeln zu stimulieren. Dadurch wird das Gehen erleichtert.[203]
Die Gehbehinderung kann auch durch muskuläre oder kognitive Ermüdbarkeit, die Fatigue, mehr oder weniger stark ausgeprägt sein und je nach Ausprägung zu deutlichen Einschränkungen im Alltag führen. Mit der Zunahme muskulärer Defizite und der Abnahme der Gehfähigkeit steigt auch die Sturzgefahr.[204] Therapiebegleitend kann zur Verbesserung der Gehfähigkeit und zur Erleichterung des Alltags eine Hilfsmittelversorgung mit Orthesen erfolgen. Mit Hilfe einer Orthese soll physiologisches Stehen und Gehen ermöglicht oder wieder erlernt werden. Zudem können Folgeerscheinungen durch ein falsches Gangbild verhindert werden und das Sturzrisiko wird verringert.[205][206]
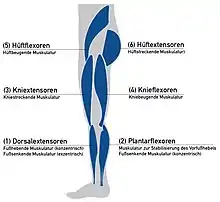 Beschreibung der Funktionen der großen Muskelgruppen zur Festlegung der Funktionselemente einer Lähmungsorthese, die eingeschränkte Muskelfunktionen ausgleichen sollen.
Beschreibung der Funktionen der großen Muskelgruppen zur Festlegung der Funktionselemente einer Lähmungsorthese, die eingeschränkte Muskelfunktionen ausgleichen sollen.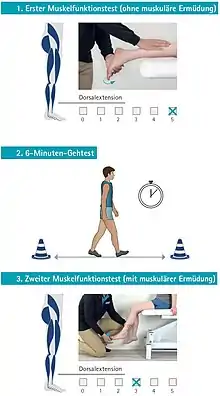 Integration des 6-Minuten-Gehtests
Integration des 6-Minuten-Gehtests Knöchel-Fuß-Orthese
Knöchel-Fuß-Orthese
Zur Festlegung der notwendigen Funktionen einer Orthese werden im Rahmen der Befundung des Patienten die Kraftgrade der sechs großen Muskelgruppen des zu versorgenden Beins bestimmt. Dafür wird ein Muskelfunktionstest nach Vladimir Janda durchgeführt. Der Grad der Lähmung wird für jede Muskelgruppe auf einer Skala von 0 bis 5 angegeben, wobei der Wert 0 eine komplette Lähmung (0 %) und der Wert 5 eine normale Kraftentfaltung (100 %) angibt. Die Werte zwischen 0 und 5 geben eine prozentuale Reduzierung der Muskelfunktion an.
Bei einer Multiplen Sklerose muss beim Muskelfunktionstest die Fatigue berücksichtigt werden. Dieses erfolgt durch die Anwendung eines standardisierten Gehtests. Hierfür eignet sich der 6-Minuten-Gehtest.[207] Durch diesen Gehtest wird die Ermüdung kontrolliert herbeigeführt. Der Muskelfunktionstest nach Vladimir Janda wird bei Multipler Sklerose doppelt in Kombination mit dem 6-Minuten-Gehtest in folgenden Schritten durchgeführt:
- erster Muskelfunktionstest (ohne muskuläre Ermüdung)
- 6-Minuten Gehtest und direkt im Anschluss
- zweiter Muskelfunktionstest (mit muskulärer Ermüdung)
Behandlung der Spastik
Spastische Tonuserhöhungen der Muskulatur kommen durch Herde in der Pyramidenbahn zustande. Sie können direkt Schmerzen oder ein Spannungsgefühl verursachen oder über Folgeerkrankungen wie Muskel- und Gelenkkontrakturen, Fehlstellungen und Immobilität zu Schmerzen führen. Eine Physiotherapie ist bei pathologischen Tonuserhöhungen immer geboten. Mittels des Bobath-Konzepts lässt sich dabei die tonisch erhöhte Muskulatur inhibieren (hemmen) und detonisierte Muskulatur und Bewegungskoordination aktivieren bzw. fazilitieren (bahnen). Medikamentös kann oral beispielsweise mit Baclofen oder Tizanidin behandelt werden. Umschriebene spastische Tonuserhöhungen können auch mit Injektionen von Botulinumtoxin behandelt werden. Eine weitere Option besteht in der Gabe von Baclofen oder Triamcinolon direkt in den Subarachnoidalraum im Bereich der Lendenwirbelsäule (intrathekale Applikation).[208] Seit 2011 ist in Deutschland ein Präparat mit den Wirkstoffen Tetrahydrocannabinol (THC) und Cannabidiol als Add-on-Therapie bei mittelschweren und schweren Formen der Spastik zugelassen.[209]
Im Rahmen von „off-label use“ (also außerhalb des in der Zulassung genehmigten Gebrauchs) kann Gabapentin bei Spastik eingesetzt werden, wenn mit den dafür zugelassenen Substanzen bei angemessener Dosierung und Anwendungsdauer keine ausreichende Linderung erzielt werden konnte oder Unverträglichkeit vorliegt. Ein Beschluss des Gemeinsamen Bundesausschuss (G-BA) zur Verordnungsfähigkeit in nicht zugelassenem Anwendungsgebiet ist im März 2014 in Kraft getreten.[210]
Schmerzbehandlung
Schmerzen können bei MS-Patienten vielfältige Ursachen haben. Die direkt durch Entzündungsherde verursachte Trigeminusneuralgie, die anfallsweise auftritt, kann medikamentös mit Carbamazepin, Gabapentin oder Pregabalin behandelt werden. Auch chronische Schmerzen meist der Extremitäten, die vermutlich durch Herde im Rückenmark entstehen, werden durch die MS selbst verursacht und können beispielsweise mit Amitriptylin behandelt werden. Schmerzen können auch indirekt durch Folgen der MS wie eine spastische Tonuserhöhung der Extremitäten oder Harnwegsinfekte verursacht sein. Die Therapie richtet sich in diesen Fällen nach der jeweiligen Ursache.[211]
Behandlung von Blasenfunktionsstörungen
Blasenfunktionsstörungen manifestieren sich in Harnwegsinfekten, imperativem Harndrang, Pollakisurie und Inkontinenz. Den Störungen zugrunde liegen kann eine Speicherstörung, Entleerungsstörung oder eine Detrusor-Sphinkter-Dyssynergie der Harnblase. Nach spezifischer urologischer Diagnostik kann eine entsprechende Therapie mit einer Einteilung der Flüssigkeitszufuhr, Beckenbodengymnastik, Katheterisierung und Medikamenten erfolgen. Harnwegsinfekte müssen antibiotisch behandelt werden. Exsikkosen, die dadurch entstehen, dass die Patienten weniger trinken, um die Blasenstörungen zu minimieren, müssen vermieden werden.[212]
Behandlung von Sprech- und Schluckstörungen
Sprech- und Schluckstörungen können zu einer erheblichen Belastung der Patienten führen. Akut im Rahmen eines Schubes entstandene Störungen werden mittels der Schubtherapie behandelt. Bleiben die Beschwerden bestehen, kommen hauptsächlich logopädische Maßnahmen zum Einsatz. Bei ausgeprägten Schluckstörungen können auch eine parenterale Ernährung und die Anlage einer PEG notwendig werden. Ziele hierbei sind eine ausreichende Nahrungszufuhr und das Vermeiden von Aspirationspneumonien.[213]
Behandlung der Fatigue und depressiver Störungen
Die Diagnosekriterien einer Fatigue und einer Depression enthalten ähnliche Elemente. Bei vielen Patienten liegt beides vor. Eine depressive Störung kann medikamentös mit Antidepressiva beispielsweise aus der Gruppe der sogenannten selektiven Serotonin-Wiederaufnahmehemmer (SSRI) behandelt werden. Eine psychologische Betreuung kann auch mit dazu beitragen, sekundär aufgetretene depressive Störungen zu behandeln und Krankheitsfolgen besser zu bewältigen.[214] Zur medikamentösen Behandlung des Fatigue-Syndroms können neben Antidepressiva auch Amantadin, Acetyl-L-Carnitin,[215] Acetylsalicylsäure,[216] und Modafinil[217] eingesetzt werden. Die Wirksamkeit einiger dieser Präparate für diese Indikation ist jedoch nicht unumstritten.[218][219]
Behandlung von Störungen der Sexualität
50 bis 90 % der MS-Patienten geben im Verlauf Störungen der Sexualität an, wobei Männer häufiger betroffen zu sein scheinen.[220][221] Entzündliche Herde können unmittelbar organische Ursache der Störungen sein, indem sie zu Gefühlsstörungen im Genitalbereich führen oder Reflexbögen der Sexualfunktionen (beispielsweise für die Erektion) beeinträchtigen. Auch eine in der Folge der MS eingetretene Spastik der Oberschenkelmuskulatur der Beine oder der Muskulatur des Beckenbodens kann den Geschlechtsverkehr erschweren oder unmöglich machen. Eine verminderte Lubrikation kann zu Schmerzen beim Verkehr führen. Weiterhin können alle Einflüsse, die den Patienten aufgrund seiner Erkrankung in seinem sozialen, psychischen und existenziellen Gefüge betreffen, zu Störungen der Sexualität führen. So kann eine Fatigue oder eine depressive Episode mit einem Libidoverlust einhergehen. Soziale Konflikte, Isolierung und Scham können ebenso die Sexualität beeinträchtigen. Ziel der therapeutischen Sexualberatung ist es, den Patienten (und seinen Partner) über mögliche Gründe der Störungen aufzuklären und mögliche Lösungen im Gespräch zu entwickeln und aufzuzeigen. Organische Ursachen können durch eine Optimierung der entsprechenden symptomatischen Therapie behandelt werden. Erektionsstörungen können – sofern sie nicht hauptsächlich psychischer Genese sind – mit Phosphodiesterasehemmern wie Sildenafil, Tadalafil oder Vardenafil behandelt werden. Weiterhin können Hilfsmittel wie Gleitmittel bei geringer Lubrikation und Vibratoren zur sexuellen Stimulation benutzt werden. Zudem können viele Medikamente, die im Rahmen der symptomatischen Therapie eingesetzt werden, zu Libidoverlust und sexuellen Funktionsstörungen führen.[222][223]
Ernährung
Eine Meta-Analyse durch Cochrane ergab keinen Hinweis auf einen wesentlichen Effekt von erhöhtem Konsum mehrfach ungesättigter Fettsäuren (z. B. Omega-6-Fettsäuren wie Linolsäure oder Omega-3-Fettsäuren) auf den Krankheitsverlauf.[224]
2017 hat ein weiteres Cochrane-Review keinen überzeugenden Nutzen einer Vitamin-D-Supplementation gefunden.[225]
Therapien außerhalb der evidenzbasierten Medizin
Viele MS-Patienten nehmen neben oder anstelle der evidenzbasierten medizinischen Therapie komplementär- oder alternativmedizinische Behandlungen in Anspruch.[226][227] Der Gebrauch unkonventioneller Therapien ist häufiger bei Patienten anzutreffen, die stärker durch die MS eingeschränkt sind. Es besteht eine sehr große Zahl von Angeboten (wie beispielsweise spezielle Diäten, Akupunktur, Homöopathie). Für keines der unkonventionellen Therapieangebote ist ein belastbarer Wirksamkeitsbeleg erbracht worden.[228]
Ausblick
Neben den für die Behandlung der Multiplen Sklerose in Deutschland zugelassenen Medikamenten (Interferon beta-1b, Interferon beta-1a s.c., Interferon beta-1a i.m., Fumarsäuredimethylester, Glatirameracetat, Mitoxantron, Azathioprin, Fingolimod, Natalizumab, Alemtuzumab und Teriflunomid) gibt es eine Vielzahl von Wirkstoffen, die sich in verschiedenen Phasen der Prüfung befinden. In Deutschland werden derzeit (Stand 2019) für mindestens 25 laufende klinische Studien Patienten rekrutiert.[229]
Einen wichtigen Schwerpunkt der klinischen Forschung stellt die Weiterentwicklung von immunmodulatorischen Wirkstoffen dar, die ein Voranschreiten der Behinderung effektiver unterbinden. Andere Studien zielen darauf ab, den Anwendungskomfort durch längere Anwendungsintervalle oder eine orale Verabreichung zu erhöhen.[230][231][232] Die Wirksamkeit und Sicherheit aggressiverer Behandlungsformen, die darauf abzielen, das gestörte Immunsystem zu eliminieren, um dann (durch entweder im Knochenmark verbliebene Stammzellen oder durch Reinfusion autologer Stammzellen) ein neues, tolerantes Immunsystem zu etablieren, bleibt im Rahmen randomisierter klinischer Studien zu klären,[233][234] wird aber sicherlich wenigen spezialisierten Zentren vorbehalten bleiben. Laut einer am Ottawa Hospital Research Institute durchgeführten klinischen Studie konnte die Autoimmunreaktion durch ein Verfahren der Reinfusion autologer Stammzellen für bislang bis zu 13 Jahre gestoppt werden.[235]
Einen noch experimentellen Ansatz stellen Versuche dar, durch den Einsatz von Wachstumsfaktoren[236] oder eine Modulation von Stammzellen[237] Remyelinisierung und Regeneration zu fördern.[238]
Eine Studie aus Rom konnte zeigen, dass die Tuberkulose-Impfung BCG im Anfangsstadium die Entwicklung von neuen Läsionen verhindern und den Krankheitsverlauf positiv beeinflussen kann.[239] Noch sind aber zu wenig Daten vorhanden, um die BCG-Impfung für alle MS-Patienten zu empfehlen.
Wie bei anderen neurodegenerativen Krankheiten sind auch bei Multipler Sklerose Behandlungsansätze mit Stammzellen in der Erprobung. Das Interesse an beispielsweise mesenchymalen Stammzellen gründet auf folgenden Eigenschaften und Funktionen dieser Zellen: 1.) Sie wirken immunmodulierend und immunsuppressiv. 2.) Sie unterstützen die Wiederherstellung der Myelinscheide durch Ernährung der Oligodendrozyten. 3.) Über biochemische Reaktionen sind sie in der Lage, Nervengewebe zu schützen (Neuroprotektion).[240]
Prognose
Bislang ist es zu Beginn der Erkrankung kaum möglich, eine Prognose über den weiteren Verlauf zu stellen, was die betroffenen Patienten belastet. In den letzten Jahren wurden einige epidemiologische Studien zur Prognose der Multiplen Sklerose veröffentlicht. Die Ergebnisse waren überwiegend positiv und zeigten, dass die Erkrankung nicht selten weniger schwer als allgemein angenommen verläuft.[241] Basierend auf den Krankheitsverläufen von 1059 Patienten ist von einer Münchener Arbeitsgruppe ein webbasiertes Computerprogramm zur Bestimmung des individuellen Risikoprofils anhand von Krankheitsverlauf, Expanded Disability Status Scale, Erkrankungsdauer, Schubfrequenz und Alter entwickelt worden.[242]
Sonstiges
Schwangerschaft und Stillzeit
Grundsätzlich ist eine Schwangerschaft bei Diagnose MS möglich. Die MS scheint die Fruchtbarkeit bei Frau und Mann nicht zu beeinflussen.[243][244] Eine Schwangerschaft fördert das Fortschreiten der MS vermutlich nicht. Im Gegenteil: Während der Schwangerschaft nimmt die Schubrate meist kontinuierlich ab. Nach der Geburt steigt das Risiko für MS-Schübe aber wieder an. Langfristig wird die Schubrate sich wieder auf dem gleichen Niveau einpendeln, das vor der Schwangerschaft bestand.[245]
Sollte ein Schub auftreten, besteht die Möglichkeit, hochdosiert Kortison zu geben.[246][247]
MS ist keine „klassische“ Erbkrankheit – die Veranlagung an MS zu erkranken, kann allerdings vererbt werden. Laut Studien bedeutet das: Das Risiko für ein Kind, selbst an MS zu erkranken, bei einem Elternteil mit MS beträgt 2 %. Dieses liegt damit höher als bei nicht MS-betroffenen Eltern (0,1–0,2 %). Wenn beide Elternteile MS haben, steigt das Risiko für das Kind auf 20 % an.[247]
MS und Familienplanung
Die in der folgenden Tabelle verwendeten Informationen stammen aus den offiziellen Berichten der Europäischen Arzneimittel-Agentur (EMA), die für die Zulassung, Bewertung und Überwachung aller Arzneimittel in Europa verantwortlich ist.[248]
| Für hochaktive MS | Wann kann ich schwanger werden? | Therapie und Schwangerschaft möglich? | Therapie und Stillen möglich? |
|---|---|---|---|
| Alemtuzumab (Lemtrada)[248] |
4 Monate nach einer Infusion | Infusion während Schwangerschaft nur nach Nutzen-Risiko Abwägung mit dem behandelnden Arzt Schwangerschaft ist aber 4 Monate nach einer Infusion möglich |
Stillen ist 4 Monate nach letzter Infusion möglich |
| Cladribin (Tabletten) (Mavenclad)[248] |
6 Monate nach der Tabletteneinnahme, möglichst nach dem 2. Behandlungsjahr. Im 3. und 4. Jahr ist keine Tabletteneinnahme vorgesehen. |
Tabletteneinnahme in der Schwangerschaft nicht erlaubt, bei Schwangerschaft sofort an Arzt wenden. Schwangerschaft ist aber 6 Monate nach letzter Tabletteneinnahme im Jahr 2 möglich. |
Stillen ist 1 Woche nach letzter Tabletteneinnahme möglich |
| Fingolimod (Gilenya)[248] |
2 Monate nach der letzten Einnahme. Nach Absetzen Rückkehr der Krankheitsaktivität möglich. | Einnahme in der Schwangerschaft nicht erlaubt, bei Schwangerschaft sofort an Arzt wenden |
Stillen ist während der Behandlung nicht möglich |
| Mitoxantron (Ralenova)[249] |
6 Monate nach der Infusion, Risiko der Unfruchtbarkeit | Einnahme in der Schwangerschaft nicht erlaubt, bei Schwangerschaft sofort an Arzt wenden | Stillen ist während der Behandlung nicht möglich |
| Natalizumab (Tysabri)[248] |
Keine Angabe. Nach Absetzen Wiederkehr der Krankheitsaktivität möglich | Anwendung nur nach Nutzen-Risiko Abwägung mit dem behandelnden Arzt | Stillen ist während der Behandlung nicht möglich |
| Ocrelizumab (Ocrevus)[248] |
12 Monate nach letzter Infusion | Anwendung nur nach Nutzen-Risiko Abwägung mit dem behandelnden Arzt | Stillen ist während der Behandlung nicht möglich |
| Glatirameracetat (Copaxone,[250] Clift[251]) |
Keine Angabe | Anwendung nur nach Nutzen-Risiko Abwägung mit dem behandelnden Arzt | Stillen nur nach Nutzen-Risko Abwägung möglich |
| Dimethylfumarat (Tecfidera) |
Keine Angabe | Anwendung nur nach Nutzen-Risiko Abwägung mit dem behandelnden Arzt | Stillen nur nach Nutzen-Risko Abwägung möglich |
| Teriflunomid (Aubagio)[248] | Wenn Teriflunomid Konzentration nach Absetzen unter 0,02 mg/l fällt. | Anwendung in der Schwangerschaft nicht erlaubt, bei Schwangerschaft sofort an Arzt wenden |
Stillen ist während der Behandlung nicht möglich |
| Beta-Interferone (Avonex, Betaferon, Extavia, Rebif)[248] |
sofort | wenn klinisch erforderlich, offiziell zugelassen | Stillen ist während der Behandlung möglich. |
Stammzellspende, Organtransplantation, Blutspende
MS ist (ebenso wie eine Reihe weiterer Erkrankungen) ein Ausschlusskriterium für eine Stammzellspende.[252] Menschen mit einer MS können in der Regel keine Organe spenden.[253] Obwohl die Blutspende eines MS-Patienten wahrscheinlich weder für den Spender noch für den Empfänger mit einem nennenswerten Risiko verbunden ist, rät der ärztliche Beirat der DMSG auch in diesem Punkt grundsätzlich ab. Viele Menschen mit MS werden langfristig mit immunsuppressiven oder immunmodulierenden Medikamenten behandelt und kommen daher ohnehin nicht als Blutspender in Betracht.
Welt-Multiple-Sklerose-Tag
Seit 2009 wird jeweils am letzten Mittwoch im Mai der Welt-Multiple-Sklerose-Tag (World MS Day) begangen. Viele MS-Vereine und Selbsthilfegruppen, in Deutschland allen voran die Deutsche Multiple Sklerose Gesellschaft e. V. (DMSG), machen an diesem Tag Aktionsveranstaltungen, um über Multiple Sklerose und ihre Auswirkungen zu informieren sowie um Verständnis für die Belange von Menschen mit MS zu wecken. Anlässlich des ersten Welt-MS-Tags hat die Internationale MS Vereinigung MSIF gemeinsam mit der Gemeinnützigen Hertie-Stiftung einen Awareness-Film namens Beautiful Day gedreht. Die Rockband U2 hat dafür ihren gleichnamigen Song zur Verfügung gestellt. Der Film wurde in zahlreiche Sprachen übersetzt und hat international eine hohe Aufmerksamkeit für die Erkrankung erzielen können.[254]
Literatur
- Alastair Compston: McAlpine’s Multiple Sclerosis. Churchill Livingstone, Oxford 2005, ISBN 0-443-07271-X.
- Ralf Gold, Peter Rieckmann: Pathogenese und Therapie der Multiplen Sklerose. Uni-Med, Bremen 2004, ISBN 3-89599-785-4.
- Volker Limmroth, Eckhart Sindern: Multiple Sklerose. Thieme, Stuttgart 2004, ISBN 3-13-133281-6.
- Rudolf M. Schmidt, Frank Hoffmann: Multiple Sklerose. Urban & Fischer, München 2006, ISBN 3-437-22081-0.
- Heinz Wiendl, Robert Weißert, Volker Limmroth, Reinhard Hohlfeld: Multiple Sklerose und andere demyelinisierende Erkrankungen. In: Thomas Brandt, Johannes Dichgans, Hans-Christoph Diener (Hrsg.): Therapie und Verlauf neurologischer Erkrankungen. 5. Auflage. Kohlhammer, Stuttgart 2007, ISBN 978-3-17-019074-0, S. 654 ff.
Weblinks
- Linkkatalog zum Thema Multiple Sklerose bei curlie.org (ehemals DMOZ)
- Veröffentlichungen des Magazins MS in Focus kostenlos zum Herunterladen
- MS Ressource Center (Memento vom 30. April 2013 im Internet Archive)
- www.dmsg.de: Was ist MS?
Dachorganisationen
Leitlinien und Grundsätze
- S2e-Leitlinie Multiple Sklerose, Diagnostik und Therapie der Deutschen Gesellschaft für Neurologie (DGN). In: AWMF online (Stand 2012)
- Grundsätze zur Verbesserung der Lebensqualität von Menschen mit Multipler Sklerose (Memento vom 20. November 2008 im Internet Archive)
- S2-Leitlinie Multiple Sklerose im Kindesalter der Gesellschaft für Neuropädiatrie (GNP). In: AWMF online (Stand 2008)
Einzelnachweise
- Multiple Sklerose: die Krankheit mit den tausend Gesichtern. In: Deutsche Gesellschaft für Neurologie. Mai 2011, abgerufen am 23. Januar 2020.
- S. Madeh Piryonesi, Sorour Rostampour, S. Abdurrahman Piryonesi: Predicting falls and injuries in people with multiple sclerosis using machine learning algorithms. In: Multiple Sclerosis and Related Disorders. Band 49, Nr. 4, 1. Januar 2021, S. 102740, doi:10.1016/j.msard.2021.102740 (Online [abgerufen am 2. Februar 2021]).
- J. F. Kurtzke: Rating neurologic impairment in multiple sclerosis: An expanded disability status scale (EDSS). In: Neurology. Band 33, Nr. 11, 1. November 1983, ISSN 0028-3878, S. 1444–1444, doi:10.1212/WNL.33.11.1444.
- Rajarshi Mazumder, Charles Murchison, Dennis Bourdette, Michelle Cameron: Falls in People with Multiple Sclerosis Compared with Falls in Healthy Controls. In: PLoS ONE. Band 9, Nr. 9, 25. September 2014, ISSN 1932-6203, S. e107620, doi:10.1371/journal.pone.0107620, PMID 25254633.
- Roland Besser, Günter Krämer: Multiple Sklerose: Antworten auf die häufigsten Fragen. Georg Thieme Verlag, 2006, ISBN 3-8304-3333-6, S. 14 eingeschränkte Vorschau in der Google-Buchsuche
- Mögliches Porträt im Victoria and Albert Museum
- Pearce: Historical descriptions of multiple sclerosis. Eur Neurol. 2005;54 (1), S. 49–53)
- Firth: The case of August D’Este. Cambridge University Press. Cambridge 1948.
- T. J. Murray: Multiple sclerosis: the history of a disease. Demos Medical Publishing, 2005 eingeschränkte Vorschau in der Google-Buchsuche
- Ins Deutsche übersetzt nach W. I. McDonald: Physicians, subsequence and consequence. In: Journal of Neurology, Neurosurgery, and Psychiatry. Band 67, Nummer 3, September 1999, S. 282–289, PMID 10449547. PMC 1736520 (freier Volltext).
- MacKenzie: A practical treatise on diseases of the eye. Longman, London 1840; zitiert nach W. I. McDonald: Physicians, subsequence and consequence. In: Journal of neurology, neurosurgery, and psychiatry. Band 67, Nummer 3, September 1999, S. 282–289, PMID 10449547. PMC 1736520 (freier Volltext).
- D. M. Bourneville, L. Guérard: De la sclérose en plaques disséminées: nouvelle étude sur quelques points de la sclérose en plaques disséminées par Bourneville. Adrien Delahaye, Paris 1869 (books.google.cl).
- C. Aring: Observations on multiple sclerosis and conversion hysteria. In: Brain: A Journal of Neurology. Band 88, Nr. 4, November 1965, S. 663–674, PMID 5856073.
- T. Hein, W. Hopfenmüller: Hochrechnung der Zahl an Multiple Sklerose erkrankten Patienten in Deutschland. In: Der Nervenarzt. Band 71, Nummer 4, April 2000, S. 288–294, PMID 10795096.
- G. Petersen et al.: Epidemiologie der Multiplen Sklerose in Deutschland. In: Der Nervenarzt. Band 85, Nummer 8, 2014, S. 990–998.
- U. Baumhackl et al.: Prevalence of multiple sclerosis in Austria. Results of a nationwide survey. In: Neuroepidemiology. Band 21, Nummer 5, September–Oktober 2002, S. 226–234, doi:10.1159/000065640. PMID 12207150.
- S. Beer, J. Kesselring: High prevalence of multiple sclerosis in Switzerland. In: Neuroepidemiology. Band 13, Nummer 1–2, 1994, S. 14–18, PMID 8190201.
- Trial of Fingolimod versus Interferon Beta-1a in Pediatric Multiple Sclerosis | NEJM. Abgerufen am 4. Januar 2019 (englisch).
- T Chitnis et al.: Demographics of pediatric-onset multiple sclerosis in an MS center population from the Northeastern United States. In: Multiple Sclerosis. Band 15, Nr. 5, 2009, S. 627–631, doi:10.1177/1352458508101933, PMID 19299440.
- Janko Samardzic, John N. van den Anker, Sasa Peric, Dejan Stevanovic, Ivan Zaletel: Multiple Sclerosis in Pediatrics: Current Concepts and Treatment Options. In: Neurology and Therapy. Band 5, Nr. 2, 1. Dezember 2016, S. 131–143, doi:10.1007/s40120-016-0052-6, PMID 27640189, PMC 5130919 (freier Volltext).
- AJ Fay, EM Mowry, J Strober, E Waubant: Relapse severity and recovery in early pediatric multiple sclerosis. In: Multiple Sclerosis. Band 18, Nr. 7, 2012, S. 1008–1012, doi:10.1177/1352458511431725.
- S. Poser, W. Poser, G. Schlaf, W. Firnhaber, K. Lauer, M. Wolter, P. Evers: Prognostic indicators in multiple sclerosis. In: Acta neurologica Scandinavica. Band 74, Nummer 5, November 1986, S. 387–392, PMID 3825497.
- B. J. Hurwitz: Analysis of current multiple sclerosis registries. In: Neurology. Band 76, Nummer 1, Supplement 1, Januar 2011, S. S7–13, doi:10.1212/WNL.0b013e31820502f6. PMID 21205683. (Übersichtsarbeit).
- H. Brønnum-Hansen, N. Koch-Henriksen, E. Stenager: Trends in survival and cause of death in Danish patients with multiple sclerosis. In: Brain. Band 127, Nummer 4, April 2004, S. 844–850, doi:10.1093/brain/awh104. PMID 14960501.
- W. Hu, C. F. Lucchinetti: The pathological spectrum of CNS inflammatory demyelinating diseases. In: Seminars in Immunopathology. Band 31, Nummer 4, November 2009, S. 439–453, doi:10.1007/s00281-009-0178-z. PMID 19779719. (Übersichtsarbeit).
- Death and DALY estimates for 2004 by cause for WHO Member States (Excel-Tabelle; 3,1 MB)
- C. R. Gale, C. N. Martyn: Migrant studies in multiple sclerosis. In: Progress in neurobiology. Band 47, Nummer 4–5, Nov.–Dez. 1995, S. 425–448, PMID 8966212. (Übersichtsarbeit).
- H. Lassmann, W. Brück, C. Lucchinetti: Heterogeneity of multiple sclerosis pathogenesis: implications for diagnosis and therapy. In: Trends in Molecular Medicine. Band 7, Nummer 3, März 2001, S. 115–121, PMID 11286782. (Übersichtsarbeit).
- S. Jarius, F. B. König, I. Metz, K. Ruprecht, F. Paul, W. Brück, B. Wildemann: Pattern II and pattern III MS are entities distinct from pattern I MS: evidence from cerebrospinal fluid analysis. In: J Neuroinflammation. 14, März, S. 171. doi:10.1186/s12974-017-0929-z. PMID 28851393.
- S. Jarius, I. Metz, F. B. König, K. Ruprecht, M. Reindl, F. Paul, W. Brück, B. Wildemann B: Screening for MOG-IgG and 27 other anti-glial and anti-neuronal autoantibodies in 'pattern II multiple sclerosis’ and brain biopsy findings in a MOG-IgG-positive case. In: Mult Scler. 22, Nr. 12, März, S. 1541–1549. doi:10.1186/s12974-017-0929-z. PMID 26869529.
- M. Spadaro, L. A. Gerdes, M. C. Mayer, B. Ertl-Wagner, S. Laurent, M. Krumbholz, C. Breithaupt, T. Högen, A. Straube, A. Giese, R. Hohlfeld, H. Lassmann, E. Meinl, T. Kümpfel.: Histopathology and clinical course of MOG-antibody-associated encephalomyelitis. In: Ann Clin Transl Neurol. 2, März, S. 295–301. PMID 25815356.
- Neuer Ansatz für Therapie bei Multipler Sklerose: Erste Nervenschäden sind noch umkehrbar (Memento vom 27. Dezember 2011 im Internet Archive) von dmsg.de – abgerufen am 7. April 2011.
- F. B. König, B. Wildemann, S. Nessler, D. Zhou, B. Hemmer, I. Metz, H. P. Hartung, B. C. Kieseier, W. Brück: Persistence of immunopathological and radiological traits in multiple sclerosis. In: Arch Neurol. 65, Nr. 11, März, S. 1527–1532. doi:10.1001/archneur.65.11.1527. PMID 19001173.
- P. A. Brex et al.: A longitudinal study of abnormalities on MRI and disability from multiple sclerosis. In: The New England Journal of Medicine. Band 346, Nr. 3, Januar 2002, S. 158–164, doi:10.1056/NEJMoa011341. PMID 11796849.
- N. Evangelou et al.: Pathological study of spinal cord atrophy in multiple sclerosis suggests limited role of local lesions. In: Brain: a journal of neurology. Band 128, Teil 1, Januar 2005, S. 29–34, doi:10.1093/brain/awh323. PMID 15548559.
- A. Kutzelnigg et al.: Cortical demyelination and diffuse white matter injury in multiple sclerosis. In: Brain: a journal of neurology. Band 128, Nummer 11, November 2005, S. 2705–2712, doi:10.1093/brain/awh641. PMID 16230320.
- Lydia Bernhardt: Neuronale Degeneration bei spinaler multipler Sklerose. Dissertation, Medizinischen Fakultät Charité – Universitätsmedizin Berlin, 2010 (PDF)
- A. Ascherio: Environmental factors in multiple sclerosis. In: Expert review of neurotherapeutics. Band 13, Nummer 12, Supplement, Dezember 2013, S. 3–9, doi:10.1586/14737175.2013.865866. PMID 24289836. (Review).
- S. G. Gregory et al.: Interleukin 7 receptor alpha chain (IL7R) shows allelic and functional association with multiple sclerosis. In: Nature Genetics. Band 39, Nummer 9, September 2007, S. 1083–1091, doi:10.1038/ng2103. PMID 17660817.
- F. Lundmark et al.: Variation in interleukin 7 receptor alpha chain (IL7R) influences risk of multiple sclerosis. In: Nature genetics. Band 39, Nummer 9, September 2007, S. 1108–1113, doi:10.1038/ng2106. PMID 17660816.
- M. G. Marrosu: Susceptibility to multiple sclerosis: the role of interleukin genes. In: Lancet neurology. Band 6, Nummer 10, Oktober 2007, S. 846–847, doi:10.1016/S1474-4422(07)70228-4. PMID 17884670.
- S. Sawcer: The complex genetics of multiple sclerosis: pitfalls and prospects. In: Brain. Band 131, Pt 12 Dezember 2008, S. 3118–3131, doi:10.1093/brain/awn081. PMID 18490360. PMC 2639203 (freier Volltext). (Übersichtsarbeit).
- A. P. Gregory et al.: TNF receptor 1 genetic risk mirrors outcome of anti-TNF therapy in multiple sclerosis. In: Nature. Band 488, Nummer 7412, August 2012, S. 508–511, doi:10.1038/nature11307. PMID 22801493.
- N. A. Patsopoulos et al.: Fine-mapping the genetic association of the major histocompatibility complex in multiple sclerosis: HLA and non-HLA effects. In: PLoS genetics. Band 9, Nummer 11, November 2013, S. e1003926, doi:10.1371/journal.pgen.1003926. PMID 24278027. PMC 3836799 (freier Volltext).
- Erbgutanalyse bringt neue Erkenntnisse zur Entstehung der Multiplen Sklerose dmsg.de, am 11. August 2011, abgerufen am 9. März 2018.
- The International Multiple Sclerosis Genetics Consortium & The Wellcome Trust Case Control Consortium: Genetic risk and a primary role for cell-mediated immune mechanisms in multiple sclerosis. In: Nature. Band 476, Nummer 7359, August 2011, S. 214–219, doi:10.1038/nature10251. PMID 21833088. PMC 3182531 (freier Volltext).
- Jian Wang et al.: HLA-DR15 molecules jointly shape an autoreactive T cell repertoire in multiple sclerosis. In: Cell. Band 183, Nr. 5, 1. November 2020, S. 1264–1281.e20, doi:10.1016/j.cell.2020.09.054, PMID 33091337.
- R. Srivastava et al.: Potassium channel KIR4.1 as an immune target in multiple sclerosis. In: The New England journal of medicine. Band 367, Nummer 2, Juli 2012, S. 115–123, doi:10.1056/NEJMoa1110740. PMID 22784115.
- R. Schneider: Autoantibodies to Potassium Channel KIR4.1 in Multiple Sclerosis. In: Frontiers in neurology. Band 4, 2013, S. 125, doi:10.3389/fneur.2013.00125. PMID 24032025. PMC 3759297 (freier Volltext).
- M. Alter et al.: Multiple sclerosis frequency in Israel’s diverse populations. In: Neurology. Band 66, Nummer 7, April 2006, S. 1061–1066, doi:10.1212/01.wnl.0000204194.47925.0d. PMID 16606919.
- D. M. Williamson et al.: Prevalence of multiple sclerosis in 19 Texas counties, 1998–2000. In: Journal of environmental health. Band 69, Nummer 10, Juni 2007, S. 41–45, PMID 17583295.
- G. C. Ebers et al.: Conjugal multiple sclerosis: population-based prevalence and recurrence risks in offspring. Canadian Collaborative Study Group. In: Annals of Neurology. Band 48, Nummer 6, Dezember 2000, S. 927–931, PMID 11117550.
- N. P. Robertson et al.: Age-adjusted recurrence risks for relatives of patients with multiple sclerosis. In: Brain: a journal of neurology. Band 119 ( Pt 2), April 1996, S. 449–455, PMID 8800940. doi:10.1093/brain/119.2.449.
- Daniel S. Reich, Claudia F. Lucchinetti, Peter A. Calabresi: Multiple Sclerosis. Hrsg.: New England Journal of Medicine. Nr. 378, 2018, S. 169–180.
- S. E. Baranzini et al.: Genome, epigenome and RNA sequences of monozygotic twins discordant for multiple sclerosis. In: Nature. Band 464, Nummer 7293, April 2010, S. 1351–1356, doi:10.1038/nature08990. PMID 20428171. PMC 2862593 (freier Volltext).
- A. Katsnelson: Twin study surveys genome for cause of multiple sclerosis. In: Nature. Band 464, Nummer 7293, April 2010, S. 1259, doi:10.1038/4641259a. PMID 20428135. (Kommentar)
- D. A. Dyment et al.: Multiple sclerosis in stepsiblings: recurrence risk and ascertainment. In: Journal of neurology, neurosurgery, and psychiatry. Band 77, Nummer 2, Februar 2006, S. 258–259, doi:10.1136/jnnp.2005.063008. PMID 16421134. PMC 2077589 (freier Volltext).
- B. Banwell et al.: Clinical features and viral serologies in children with multiple sclerosis: a multinational observational study. In: Lancet neurology. Band 6, Nummer 9, September 2007, S. 773–781, doi:10.1016/S1474-4422(07)70196-5. PMID 17689148.
- S. Alotaibi et al.: Epstein-Barr virus in pediatric multiple sclerosis. In: JAMA. Band 291, Nummer 15, April 2004, S. 1875–1879, doi:10.1001/jama.291.15.1875. PMID 15100207.
- J. F. Kurtzke et al.: Multiple sclerosis in the Faroe Islands. 5. The occurrence of the fourth epidemic as validation of transmission. In: Acta neurologica Scandinavica. Band 88, Nummer 3, September 1993, S. 161–173, PMID 8256551.
- J. F. Kurtzke, K. Hyllested: Multiple sclerosis in the Faroe Islands: I. Clinical and epidemiological features. In: Annals of neurology. Band 5, Nummer 1, Januar 1979, S. 6–21, doi:10.1002/ana.410050104. PMID 371519.
- Ingo Arzt: Ist die Ursache von Multipler Sklerose gefunden? 14. Januar 2022, abgerufen am 14. Januar 2022.
- Lars Fischer: Langzeitfolgen: Hinter multipler Sklerose steckt wohl eine Virusinfektion. In: Spektrum.de. 14. Januar 2022, abgerufen am 14. Januar 2022.
- Kjetil Bjornevik et al.: Longitudinal analysis reveals high prevalence of Epstein-Barr virus associated with multiple sclerosis. In: Science. 21. Januar 2022, doi:10.1126/science.abj8222, PMID 35025605.
- Multiple Sklerose: Hakenwürmer erzielen in randomisierter Studie nur schwache Wirkung. In: Deutsches Ärzteblatt. 30. Juni 2020, abgerufen am 11. Januar 2021.
- A. L. Ponsonby et al.: Exposure to infant siblings during early life and risk of multiple sclerosis. In: JAMA. Band 293, Nummer 4, Januar 2005, S. 463–469, doi:10.1001/jama.293.4.463. PMID 15671431.
- I. A. van der Mei et al.: Past exposure to sun, skin phenotype, and risk of multiple sclerosis: case-control study. In: BMJ. Band 327, Nummer 7410, August 2003, S. 316, doi:10.1136/bmj.327.7410.316. PMID 12907484. PMC 169645 (freier Volltext).
- N. Kromann, A. Green: Epidemiological studies in the Upernavik district, Greenland. Incidence of some chronic diseases 1950–1974. In: Acta medica Scandinavica. Band 208, Nummer 5, 1980, S. 401–406, PMID 7457208.
- B. Deutch et al.: Traditional and modern Greenlandic food – dietary composition, nutrients and contaminants. In: Science of the Total Environment. Band 384, Nummer 1–3, Oktober 2007, S. 106–119, doi:10.1016/j.scitotenv.2007.05.042. PMID 17629548.
- Kassandra L. Munger et al.: Dietary intake of vitamin D during adolescence and risk of multiple sclerosis. In: Journal of Neurology. Band 258, Nr. 3, März 2011, S. 479–485, doi:10.1007/s00415-010-5783-1, PMID 20945071, PMC 3077931 (freier Volltext).
- M. Y. Hachim, N. M. Elemam, A. A. Maghazachi: The Beneficial and Debilitating Effects of Environmental and Microbial Toxins, Drugs, Organic Solvents and Heavy Metals on the Onset and Progression of Multiple Sclerosis. In: Toxins. Band 11, Nr. 3, März 2019, doi:10.3390/toxins11030147, PMID 30841532, PMC 6468554 (freier Volltext).
- Julia Feige et al.: Vitamin D Supplementation in Multiple Sclerosis: A Critical Analysis of Potentials and Threats. In: Nutrients. Band 12, Nr. 3, 16. März 2020, doi:10.3390/nu12030783, PMID 32188044, PMC 7146466 (freier Volltext).
- K. K. Aminzadeh, M. Etminan: Dental amalgam and multiple sclerosis: a systematic review and meta-analysis. In: Journal of public health dentistry. Band 67, Nummer 1, 2007, S. 64–66, PMID 17436982. (Metaanalyse).
- C. H. Hawkes: Smoking is a risk factor for multiple sclerosis: a metanalysis. In: Multiple sclerosis. Band 13, Nummer 5, Juni 2007, S. 610–615, doi:10.1177/1352458506073501. PMID 17548439.
- T. Riise, M. W. Nortvedt, A. Ascherio: Smoking is a risk factor for multiple sclerosis. In: Neurology. Band 61, Nummer 8, Oktober 2003, S. 1122–1124, PMID 14581676.
- F. di Pauli et al.: Smoking is a risk factor for early conversion to clinically definite multiple sclerosis. In: Multiple sclerosis. Band 14, Nummer 8, September 2008, S. 1026–1030, doi:10.1177/1352458508093679. PMID 18632775.
- P. Sundström, L. Nyström: Smoking worsens the prognosis in multiple sclerosis. In: Multiple sclerosis. Band 14, Nummer 8, September 2008, S. 1031–1035, doi:10.1177/1352458508093615. PMID 18632778.
- K. Konieczka, S. Koch, T. Binggeli, A. Schoetzau, J. Kesselring: Multiple sclerosis and primary vascular dysregulation (Flammer syndrome). EPMA Journal 2016 Jun 15;7:13
- Gibt es einen Zusammenhang zwischen Hepatitis-B-Impfung und Multipler Sklerose? In: RKI. 22. Februar 2018, abgerufen am 12. Mai 2021.
- M. A. Hernán et al.: Recombinant hepatitis B vaccine and the risk of multiple sclerosis: a prospective study. In: Neurology. Band 63, Nummer 5, September 2004, S. 838–842, PMID 15365133.
- Y. Mikaeloff et al.: Hepatitis B vaccination and the risk of childhood-onset multiple sclerosis. In: Archives of pediatrics & adolescent medicine. Band 161, Nummer 12, Dezember 2007, S. 1176–1182, doi:10.1001/archpedi.161.12.1176. PMID 18056563.
- F. DeStefano et al.: Vaccinations and risk of central nervous system demyelinating diseases in adults. In: Archives of Neurology Band 60, Nummer 4, April 2003, S. 504–509, doi:10.1001/archneur.60.4.504. PMID 12707063.
- Y. Mikaeloff et al.: Hepatitis B vaccine and risk of relapse after a first childhood episode of CNS inflammatory demyelination. In: Brain. Band 130, Pt 4 April 2007, S. 1105–1110, doi:10.1093/brain/awl368. PMID 17276994.
- F. Zipp, J. G. Weil, K. M. Einhäupl: No increase in demyelinating diseases after hepatitis B vaccination. In: Nature medicine Band 5, Nummer 9, September 1999, S. 964–965, doi:10.1038/12376. PMID 10470051.
- Julia Stowe et al.: Do Vaccines Trigger Neurological Diseases? Epidemiological Evaluation of Vaccination and Neurological Diseases Using Examples of Multiple Sclerosis, Guillain–Barré Syndrome and Narcolepsy. In: CNS Drugs. Band 34, Nr. 1, 1. Januar 2020, S. 1–8, doi:10.1007/s40263-019-00670-y, PMID 31576507, PMC 7224038 (freier Volltext).
- Mia Topsøe Mailand und Jette Lautrup Frederiksen: Vaccines and multiple sclerosis: a systematic review. In: Journal of Neurology. Band 264, Nr. 6, 1. Juni 2017, S. 1035–1050, doi:10.1007/s00415-016-8263-4.
- Carlo Di Pietrantonj et al.: Vaccines for measles, mumps, rubella, and varicella in children. In: The Cochrane Database of Systematic Reviews. Band 4, 20. April 2020, S. CD004407, doi:10.1002/14651858.CD004407.pub4, PMID 32309885, PMC 7169657 (freier Volltext).
- Susanne Gallus: Impfen verursacht keine Multiple Sklerose. Medical Tribune, 23. September 2019, abgerufen am 15. Oktober 2019.
- T. Putnam: „Encephalitis“ and sclerotic plaques produced by venular obstruction. In: Arch Neurol Psychiatry, 1935;33(5), S. 929–940.
- T. Putnam: Evidences of vascular occlusion in multiple sclerosis and encephalomyelitis. In: Arch Neurol Psychiatry. 1937; 37 (6), S. 1298–1321.
- T. Putnam, A. Adler: Vascular architecture of the lesions of multiple sclerosis. In: Arch Neurol Psychiat. 38:1, 1937.
- R. S. Dow, G. Berglund: Vascular pattern of lesions of multiple sclerosis. In: Arch Neurol Psychiatry. 1942;47(1), S. 1–18.
- F. Schelling: Damaging venous reflux into the skull or spine: relevance to multiple sclerosis. In: Medical Hypotheses. Band 21, Nummer 2, Oktober 1986, S. 141–148, PMID 3641027.
- P. Zamboni et al.: Chronic cerebrospinal venous insufficiency in patients with multiple sclerosis. In: Journal of neurology, neurosurgery, and psychiatry. Band 80, Nummer 4, April 2009, S. 392–399, doi:10.1136/jnnp.2008.157164. PMID 19060024. PMC 2647682 (freier Volltext).
- M. Simka: Blood brain barrier compromise with endothelial inflammation may lead to autoimmune loss of myelin during multiple sclerosis. In: Current neurovascular research. Band 6, Nummer 2, Mai 2009, S. 132–139, PMID 19442163. (Übersichtsarbeit).
- Deutsche Multiple Sklerose Gesellschaft: Ist ein gestörter Blutfluss im Gehirn aufgrund venöser Insuffizienz (CCSVI) die Ursache von MS? (Memento vom 14. Dezember 2009 im Internet Archive) abgerufen am 8. November 2009.
- P. Sundström et al.: Venous and cerebrospinal fluid flow in multiple sclerosis: a case-control study. In: Annals of neurology. Band 68, Nummer 2, August 2010, S. 255–259, doi:10.1002/ana.22132. PMID 20695018.
- F. Doepp et al.: No cerebrocervical venous congestion in patients with multiple sclerosis. In: Annals of neurology. Band 68, Nummer 2, August 2010, S. 173–183, doi:10.1002/ana.22085. PMID 20695010.
- B. A. Bagert, E. Marder, O. Stüve: Chronic cerebrospinal venous insufficiency and multiple sclerosis. In: Archives of neurology. Band 68, Nummer 11, November 2011, S. 1379–1384, doi:10.1001/archneurol.2011.179. PMID 21747006. (Übersichtsarbeit).
- Neurologen warnen vor gefährlicher Therapie bei Multipler Sklerose. (PDF) DGN, 17. September 2010, abgerufen am 22. September 2010.
- A. L. Traboulsee et al.: Prevalence of extracranial venous narrowing on catheter venography in people with multiple sclerosis, their siblings, and unrelated healthy controls: a blinded, case-control study. In: The Lancet. 2013 Oct 8. pii: S0140-6736(13)61747-X doi:10.1016/S0140-6736(13)61747-X, PMID 24119384.
- R. Gold et al.: Übersicht und Analyse internationaler Fall-Kontroll-Studien zu „Chronischen zerebrospinalen venösen Insuffizienz“ (CCSVI) und Multipler Sklerose. In: Aktuelle Neurologie. 2013; 40 (08), S. 445–451. doi:10.1055/s-0033-1351271
- H. Lassmann: Experimental models of multiple sclerosis. In: Revue neurologique. Band 163, Nummer 6–7, Juni 2007, S. 651–655, PMID 17607184. (Übersichtsarbeit).
- P. P. Ho et al.: Identification of Naturally Occurring Fatty Acids of the Myelin Sheath That Resolve Neuroinflammation. In: Science Translational Medicine. 4, 2012, S. 137ra73–137ra73, doi:10.1126/scitranslmed.3003831.
- Moises Velasquez-Manoff: Gut Microbiome: The Peacekeepers. In: Nature. 2015. doi:10.1038/518S3a.
- Darmbakterien sorgen für gesundes Gehirn. Auf: Pressemitteilung der Uniklinik Freiburg vom 1. Juni 2015.
- Zwillingsstudie: Natürliche Darmflora kann Multiple Sklerose auslösen - Genetisch veränderte Mäuse liefern ersten Hinweis, dass menschliche Darmbakterien Multiple Sklerose auslösen können, 11. September 2017. In: mpg.de
- Could Multiple Sclerosis Begin in the Gut? Auf: Scientific American vom 8. Oktober 2014.
- James D. Thacker: The law of unintended consequences and antibiotics. In: Open Journal of Immunology. 02, Nr. 2, 2012, S. 59. doi:10.4236/oji.2012.22007.
- Anjelique Schulfer, Martin J. Blaser: Risks of Antibiotic Exposures Early in Life on the Developing Microbiome. In: PLoS Pathogens. 2015. doi:10.1371/journal.ppat.1004903.
- Cell, 2020, Vol. 180, issue 6, S. 1067–1080; doi:10.1016/j.cell.2020.02.035
- F. D. Lublin, S. C. Reingold: Defining the clinical course of multiple sclerosis: results of an international survey. National Multiple Sclerosis Society (USA) Advisory Committee on Clinical Trials of New Agents in Multiple Sclerosis. In: Neurology. Band 46, Nummer 4, April 1996, S. 907–911, PMID 8780061.
- Wallace J. Brownlee, Todd A. Hardy, Franz Fazekas, David H. Miller: Diagnosis of multiple sclerosis: progress and challenges. In: The Lancet. Band 389, Nr. 10076, April 2017, ISSN 0140-6736, S. 1336–1346, doi:10.1016/s0140-6736(16)30959-x.
- B. G. Weinshenker et al.: The natural history of multiple sclerosis: a geographically based study. I. Clinical course and disability. In: Brain. Band 112, Februar 1989, S. 133–146, PMID 2917275.
- D. Buljevac et al.: Prospective study on the relationship between infections and multiple sclerosis exacerbations. In: Brain. Band 125, Pt 5 Mai 2002, S. 952–960, PMID 11960885.
- C. Confavreux: Infections and the risk of relapse in multiple sclerosis. In: Brain. Band 125, Pt 5 Mai 2002, S. 933–934, PMID 11960883.
- S. Vukusic et al., The Pregnancy In Multiple Sclerosis Group: Pregnancy and multiple sclerosis (the PRIMS study): clinical predictors of post-partum relapse. In: Brain. Band 127, Pt 6 Juni 2004, S. 1353–1360, doi:10.1093/brain/awh152. PMID 15130950.
- D. S. Goodin et al.: The relationship of MS to physical trauma and psychological stress: report of the Therapeutics and Technology Assessment Subcommittee of the American Academy of Neurology. In: Neurology. Band 52, Nummer 9, Juni 1999, S. 1737–1745, PMID 10371517.
- D. C. Mohr et al..: Association between stressful life events and exacerbation in multiple sclerosis: a meta-analysis. In: BMJ. Band 328, Nummer 7442, März 2004, S. 731, doi:10.1136/bmj.38041.724421.55. PMID 15033880. PMC 381319 (freier Volltext). (Übersichtsarbeit).
- A. Apel et al.: In: Fortschritte der Neurologie-Psychiatrie. Band 74, Nummer 10, Oktober 2006, S. 567–574, doi:10.1055/s-2005-919090. PMID 16586258. (Übersichtsarbeit).
- Wallace J Brownlee, Todd A Hardy, Franz Fazekas, David H Miller: Diagnosis of multiple sclerosis: progress and challenges. In: The Lancet. Band 389, Nr. 10076, April 2017, ISSN 0140-6736, S. 1336–1346, doi:10.1016/s0140-6736(16)30959-x.
- J. M. Dargin, R. A. Lowenstein: The painful eye. In: Emergency medicine clinics of North America. Band 26, Nummer 1, Februar 2008, S. 199–216, viii, doi:10.1016/j.emc.2007.10.001. PMID 18249263. (Übersichtsarbeit).
- C. Solaro et al.: The prevalence of pain in multiple sclerosis: a multicenter cross-sectional study. In: Neurology. Band 63, Nummer 5, September 2004, S. 919–921, PMID 15365151.
- Rohit Bakshi: Fatigue associated with multiple sclerosis: diagnosis, impact and management. In: Multiple Sclerosis Journal. Band 9, Nr. 3, Juni 2003, ISSN 1352-4585, S. 219–227, doi:10.1191/1352458503ms904oa.
- Jiska C.E. Kempen, Caroline A.M. Doorenbosch, Dirk L. Knol, Vincent de Groot, Heleen Beckerman: Newly Identified Gait Patterns in Patients With Multiple Sclerosis May Be Related to Push-off Quality. In: Physical Therapy. Band 96, Nr. 11, November 2016, S. 1744–1752.
- D. Denney, L. Sworowski, S. Lynch: Cognitive impairment in three subtypes of multiple sclerosis. In: Archives of Clinical Neuropsychology. Band 20, Nr. 8, Dezember 2005, ISSN 0887-6177, S. 967–981, doi:10.1016/j.acn.2005.04.012.
- L. M. J. De Sonneville, J. B. Boringa, I. E. W. Reuling, R. H. C. Lazeron, H. J. Adèr: Information processing characteristics in subtypes of multiple sclerosis. In: Neuropsychologia. Band 40, Nr. 11, Januar 2002, ISSN 0028-3932, S. 1751–1765, doi:10.1016/s0028-3932(02)00041-6.
- Rosa E. Boeschoten, Annemarie M. J. Braamse, Aartjan T. F. Beekman, Pim Cuijpers, Patricia van Oppen: Prevalence of depression and anxiety in Multiple Sclerosis: A systematic review and meta-analysis. In: Journal of the Neurological Sciences. Band 372, Januar 2017, ISSN 0022-510X, S. 331–341, doi:10.1016/j.jns.2016.11.067.
- Lauren B Krupp: Fatigue in Multiple Sclerosis. In: CNS Drugs. Band 17, Nr. 4, 2003, ISSN 1172-7047, S. 225–234, doi:10.2165/00023210-200317040-00002.
- I.-K. Penner: Evaluation of cognition and fatigue in multiple sclerosis: daily practice and future directions. In: Acta Neurologica Scandinavica. Band 134, September 2016, ISSN 0001-6314, S. 19–23, doi:10.1111/ane.12651.
- S. M. Rao: Multiple sclerosis. In: J. L. Cummings (Hrsg.): Subcortical dementia. Oxford University Press, New York 1990, S. 164–180.
- Pasquale Calabrese, Iris Katharina Penner: Cognitive dysfunctions in multiple sclerosis – a “multiple disconnection syndrome”? In: Journal of Neurology. Band 254, S2, Mai 2007, ISSN 0340-5354, S. II18–II21, doi:10.1007/s00415-007-2006-5.
- Caspar E. P. van Munster, Bernard M. J. Uitdehaag: Outcome Measures in Clinical Trials for Multiple Sclerosis. In: CNS Drugs. Band 31, Nr. 3, März 2017, ISSN 1172-7047, S. 217–236, doi:10.1007/s40263-017-0412-5, PMID 28185158.
- W. I. McDonald et al.: Recommended diagnostic criteria for multiple sclerosis: guidelines from the International Panel on the diagnosis of multiple sclerosis. In: Annals of neurology. Band 50, Nummer 1, Juli 2001, S. 121–127, PMID 11456302.
- Polman et al.: Diagnostic criteria for multiple sclerosis: 2005 revisions to the „McDonald Criteria“. In: Annals of neurology. Band 58, Nummer 6, Dezember 2005, S. 840–846, doi:10.1002/ana.20703. PMID 16283615. (Übersichtsarbeit).
- Übersicht über die Änderungen der überarbeitete Fassung der Mc-Donald-Kriterien bei der DMSG (Memento vom 13. Oktober 2007 im Internet Archive)
- Polman et al.: Diagnostic criteria for multiple sclerosis: 2010 revisions to the McDonald criteria. In: Annals of neurology. Band 69, Nummer 2, Februar 2011, S. 292–302, doi:10.1002/ana.22366. PMID 21387374. PMC 3084507 (freier Volltext).
- Alan J. Thompson, Brenda L. Banwell, Frederik Barkhof, William M. Carroll, Timothy Coetzee: Diagnosis of multiple sclerosis: 2017 revisions of the McDonald criteria. In: The Lancet Neurology. Band 17, Nr. 2, Februar 2018, S. 162–173, doi:10.1016/S1474-4422(17)30470-2 (elsevier.com [abgerufen am 21. Januar 2022]).
- Giovannoni et al.: Serum inflammatory markers and clinical/MRI markers of disease progression in multiple sclerosis. In: Journal of neurology. Band 248, Nummer 6, Juni 2001, S. 487–495, PMID 11499639.
- Berger et al.: Antimyelin antibodies as a predictor of clinically definite multiple sclerosis after a first demyelinating event. In: The New England Journal of Medicine. Band 349, Nummer 2, Juli 2003, S. 139–145, doi:10.1056/NEJMoa022328. PMID 12853586.
- Kuhle et al.: Lack of association between antimyelin antibodies and progression to multiple sclerosis. In: The New England Journal of Medicine. Band 356, Nummer 4, Januar 2007, S. 371–378, doi:10.1056/NEJMoa063602. PMID 17251533.
- H. Link, Y. M. Huang: Oligoclonal bands in multiple sclerosis cerebrospinal fluid: an update on methodology and clinical usefulness. In: Journal of neuroimmunology. Band 180, Nummer 1–2, November 2006, S. 17–28, doi:10.1016/j.jneuroim.2006.07.006. PMID 16945427. (Übersichtsarbeit).
- H. Reiber, S. Ungefehr, C. Jacobi: The intrathecal, polyspecific and oligoclonal immune response in multiple sclerosis. In: Multiple sclerosis. Band 4, Nummer 3, Juni 1998, S. 111–117, PMID 9762657.
- S. Jarius, P. Eichhorn, D. Franciotta, H.F. Petereit, G. Akman-Demir, M. Wick, B. Wildemann. The MRZ reaction as a highly specific marker of multiple sclerosis: re-evaluation and structured review of the literature. In: J Neurol., 2016, doi:10.1007/s00415-016-8360-4, PMID 28005176
- L. A. Rolak, J. O. Fleming: The differential diagnosis of multiple sclerosis. In: The neurologist. Band 13, Nummer 2, März 2007, S. 57–72, doi:10.1097/01.nrl.0000254705.39956.34. PMID 17351525. (Übersichtsarbeit).
- B. G. Weinshenker et al.: A randomized trial of plasma exchange in acute central nervous system inflammatory demyelinating disease. In: Annals of neurology. Band 46, Nummer 6, Dezember 1999, S. 878–886, PMID 10589540.
- D. M. Sutton et al.: Complications of plasma exchange. In: Transfusion. Band 29, Nummer 2, Februar 1989, S. 124–127, PMID 2919422.
- M. H. Mokrzycki, A. A. Kaplan: Therapeutic plasma exchange: complications and management. In: American journal of kidney diseases. Band 23, Nummer 6, Juni 1994, S. 817–827, PMID 8203364.
- Gregoriadis et al. Considerations on long-term immuno-intervention in the treatment of multiple sclerosis: an expert opinion. Expert Opin Pharmacother. 2016 Oct;17(15):2085-95; doi:10.1080/14656566.2016.1232712. PMID 27594523.
- H. L. Weiner et al. Immunosuppressive treatment in multiple sclerosis. J Neurol Sci. 2004 Aug 15;223(1):1-11. doi:10.1016/j.jns.2004.04.013 PMID 15261554.
- Schreier et al.: Infections in the Immunocompromised Host.
- Oh and O’Connor. Established disease-modifying treatments in relapsing-remitting multiple sclerosis. 2015 Jun;28(3):220-9. doi:10.1097/WCO.0000000000000202. PMID 25923124.
- Penn et Starzl. Malignant tumors arising de novo in immunosuppressed organ transplant recipients. 1972 Oct;14(4):407-17. PMC 3006181 (freier Volltext). PMID 4345337.
- Ghezzi et al. Disease reactivation after fingolimod discontinuation in two multiple sclerosis patients. 2013 Jan;260(1):327-9. doi:10.1007/s00415-012-6744-7 – PMID 23161460.
- Deutsche Gesellschaft für Neurologie. Leitlinien für Diagnostik und Therapie in der Neurologie (PDF; 3,1 MB)
- Diagnose und Therapie der Multiplen Sklerose Aktualisierte Leitlinie der DGN, abgerufen am 16. März 2019
- N. Wagner et al.: Impfen bei Immundefizienz. (PDF; 409 kB) In: Bundesgesundheitsblatt - Gesundheitsforschung - Gesundheitsschutz. 4, 2019; abgerufen am 16. September 2020.
- Qualitätshandbuch MS / NMOSDEmpfehlungen zur Therapie der Multiplen Sklerose / Neuro myelitis-optica-Spektrum-Erkrankungen für Ärzte (PDF) 3. überarbeitete und erweiterte Auflage Juli 2018, Herausgeber: Krankheitsbezogenes Kompetenznetz Multiple Sklerose e. V
- Peter Rieckmann, Hans-Peter Hartung, Klaus V. Toyka: Multiplen-Sklerose Rekombinante Beta-Interferone: Immunmodulatorische Therapie der schubförmigen Multiplen Sklerose. In: Deutsches Ärzteblatt. Band 93, Nr. 46. Deutscher Ärzte-Verlag, 15. November 1996, S. A-3022 / B-2553 / C-2272 (aerzteblatt.de).
- Filippini et al.: Interferons in relapsing remitting multiple sclerosis: a systematic review. In: Lancet. Band 361, Nummer 9357, Februar 2003, S. 545–552, doi:10.1016/S0140-6736(03)12512-3. PMID 12598138. (Metaanalyse).
- R. Gold: Placebo-Controlled Phase 3 Study of Oral BG-12 for Relapsing Multiple Sclerosis. In: N Engl J Med. Band 367, September 2012, S. 1098–1107, doi:10.1056/NEJMoa1114287.
- R. J. Fox: Placebo-Controlled Phase 3 Study of Oral BG-12 or Glatiramer in Multiple Sclerosis. In: N Engl J Med. Band 367, September 2012, S. 1087–1097, doi:10.1056/NEJMoa1206328.
- L. Munari, R. Lovati, A. Boiko: Therapy with glatiramer acetate for multiple sclerosis. In: Cochrane database of systematic reviews (Online). Nummer 1, 2004, S. CD004678, doi:10.1002/14651858.CD004678. PMID 14974077. (Metaanalyse).
- I. Casetta, G. Iuliano, G. Filippini: Azathioprine for multiple sclerosis. In: Cochrane database of systematic reviews (Online). Nummer 4, 2007, S. CD003982, doi:10.1002/14651858.CD003982.pub2. PMID 17943809. (Metaanalyse).
- O. Gray, G. V. McDonnell, R. B. Forbes: Intravenous immunoglobulins for multiple sclerosis. In: Cochrane database of systematic reviews (Online). Nummer 4, 2003, S. CD002936, doi:10.1002/14651858.CD002936. PMID 14583956. (Metaanalyse).
- J. A. Cohen et al.: Oral fingolimod or intramuscular interferon for relapsing multiple sclerosis. In: The New England Journal of Medicine. Band 362, Nummer 5, Februar 2010, S. 402–415, doi:10.1056/NEJMoa0907839. PMID 20089954.
- L. Kappos et al.: A placebo-controlled trial of oral fingolimod in relapsing multiple sclerosis. In: The New England Journal of Medicine. Band 362, Nummer 5, Februar 2010, S. 387–401, doi:10.1056/NEJMoa0909494. PMID 20089952.
- Polman et al.: A randomized, placebo-controlled trial of natalizumab for relapsing multiple sclerosis. In: The New England Journal of Medicine. Band 354, Nummer 9, März 2006, S. 899–910, doi:10.1056/NEJMoa044397. PMID 16510744.
- Martinelli Boneschi et al.: Mitoxantrone for multiple sclerosis. In: Cochrane database of systematic reviews (Online). Nummer 4, 2005, S. CD002127, doi:10.1002/14651858.CD002127.pub2. PMID 16235298. (Metaanalyse).
- La Mantia et al.: Cyclophosphamide for multiple sclerosis. In: Cochrane database of systematic reviews (Online). Nummer 1, 2007, S. CD002819, doi:10.1002/14651858.CD002819.pub2. PMID 17253481. (Metaanalyse).
- CHMP empfiehlt Zulassungsänderung von Rebif® für den klinisch erforderlichen Einsatz während Schwangerschaft und Stillzeit, PM Merck vom 23. September 2019, abgerufen am 28. Oktober 2019
- Summary of Product Characteristics (PDF; 1,0 MB) Zulassungstext der EMA am Beispiel von Rebif, abgerufen am 28. Oktober 2019
- De Jong et al.: Confusing Cochrane reviews on treatment in multiple sclerosis. In: Lancet neurology. Band 4, Nummer 6, Juni 2005, S. 330–331, doi:10.1016/S1474-4422(05)70081-8. PMID 15907736. (Kommentar)
- European Medicines Agency – Find medicine – Mavenclad. Abgerufen am 31. August 2018 (englisch).
- Office of the Commissioner: Press Announcements - FDA approves new oral treatment for multiple sclerosis. Abgerufen am 30. März 2019 (englisch).
- Biogen. Biogen and AbbVie’s Once-Monthly ZINBRYTA™ (Daclizumab) Approved in European Union for Treatment of Multiple Sclerosis (Memento vom 17. Februar 2017 im Internet Archive).
- PML-Risiko steigt mit jeder Natalizumab-Infusion: neue Daten zur Risikostratifizierung. In: Deutsche Gesellschaft für Neurologie& e. V. Abgerufen am 6. November 2021.
- Fingolimod (Gilenya®): Erster Bericht einer progressiven multifokalen Leukoenzephalopathie (PML) bei einem Multiple-Sklerose-Patienten unter Fingolimod-Therapie ohne vorherige Behandlung mit Natalizumab oder anderen immunsuppressiven Arzneimitteln (PDF; 331 kB) RHB vom 4. Mai 2015, abgerufen am 16. März 2019
- Fingolimod (Gilenya®): Risiken im Zusammenhang mit den Auswirkungen auf das Immunsystem (PDF; 941 kB) RHB vom Januar 2016, abgerufen am 16. März 2019
- Fingolimod (Gilenya®): Kontraindikationen bei Patienten mit kardialen Erkrankungen (PDF; 427 kB) RHB vom 6. November 2017, abgerufen am 16. März 2019
- Fingolimod (Gilenya®): Neue Kontraindikation bei Anwendung während der Schwangerschaft und bei Frauen im gebärfähigen Alter, die keine wirksame Verhütungsmethode anwenden (PDF; 770 kB) RHB vom 2. September 2019, abgerufen am 26. Februar 2020
- Use of multiple sclerosis medicine Lemtrada restricted while EMA review is ongoing, PM EMA vom 12. April 2019, abgerufen am 12. Februar 2020
- Alemtuzumab - Nur noch für schwere Fälle, Pharmazeutische Zeitung vom 12. April 2019, abgerufen am 12. Februar 2020
- Alemtuzumab (LEMTRADA): Einschränkung der Anwendung bei Multipler Sklerose aufgrund von Sicherheitsbedenken (PDF; 1,4 MB) Rote Hand Brief Sanofi April 2019, abgerufen am 12. Februar 2020
- LEMTRADA (Alemtuzumab): Einschränkung der Indikation, zusätzliche Gegenanzeigen und risikominimierende Maßnahmen (PDF) Rote Hand Brief Sanofi Januar 2020, abgerufen am 12. Februar 2020
- Updated safety of cladribine tablets in the treatment of patients with multiple sclerosis: Integrated safety analysis and post-approval data, ECTRIMS Kongress, Stockholm September 2019, abgerufen am 12. Februar 2020
- Ron Winslow: After 40-year odyssey, first drug for aggressive MS wins FDA approval. (Nicht mehr online verfügbar.) STAT, 28. März 2017, archiviert vom Original am 1. April 2017; abgerufen am 10. Februar 2021.
- Ocrelizumab label. FDA. März 2017. Archiviert vom Original am 1. April 2017. Abgerufen am 1. April 2017. Siehe auch FDA index page for BLA 761053 zu Updates; 1. April 2017 (Memento vom 1. April 2017 im Internet Archive)
- BLA Approval Letter. FDA. 28. März 2017. Archiviert vom Original am 2. April 2017.
- Schweiz lässt MS-Antikörper Ocrevus zu. Abgerufen am 4. Oktober 2017.
- John Miller, Michael Shields: Roche’s star MS medicine Ocrevus wins EU approval. In: Reuters. 12. Januar 2018, abgerufen am 12. Januar 2018 (englisch).
- Katharine Harding et al.: Clinical Outcomes of Escalation vs Early Intensive Disease-Modifying Therapy in Patients With Multiple Sclerosis In: JAMA Neurol, February 2019, S. 643–652, doi:10.1001/jamaneurol.2018.4905. (Originalarbeit).
- Das Zeitfenster nutzen!, Kommentar in Ärzte Zeitung online, 24. Februar 2019
- Welche Therapie für sie eventuell am besten passt, Eine Orientierungshilfe
- www.ema.eu.
- Celgene Submits Application to EMA for Ozanimod for the Treatment of Relapsing-Remitting Multiple Sclerosis, PM Celgene vom 11. März 2019, abgerufen am 16. März 2019.
- Zeposia, EMA, positive opinion, abgerufen am 10. April 2020.
- Novartis announces positive phase III results showing efficacy of BAF312 in patients with secondary progressive MS, PM Novartis vom 25. August 2016.
- EPAR der EMA (PDF; 1006 kB) Zusammenfassung der Merkmale des Arzneimittels auf der Website der EMA, abgerufen am 26. Februar 2020.
- Merck mit brandaktuellen positiven Phase-II-Daten zu oraler Prüftherapie Evobrutinib bei RMS (PDF) (Seite nicht mehr abrufbar, Suche in Webarchiven) Info: Der Link wurde automatisch als defekt markiert. Bitte prüfe den Link gemäß Anleitung und entferne dann diesen Hinweis. , PM Merck vom 12. Oktober 2018, abgerufen am 17. März 2019.
- M. B. Rietberg et al.: Exercise therapy for multiple sclerosis. In: Cochrane database of systematic reviews (Online). Nummer 1, 2005, S. CD003980, doi:10.1002/14651858.CD003980.pub2. PMID 15674920. (Meta-Analyse)
- J. Kesselring, S. Beer: Symptomatic therapy and neurorehabilitation in multiple sclerosis. In: Lancet neurology. Band 4, Nummer 10, Oktober 2005, S. 643–652, doi:10.1016/S1474-4422(05)70193-9. PMID 16168933. (Übersichtsarbeit).
- Zusammenfassung des EPAR für die Öffentlichkeit (PDF) von der Website der europäischen Gesundheitsbehörde (EMA), abgerufen am 10. Februar 2014.
- Davide Cattaneo, Carmela De Nuzzo, Marco Macalli, Ivana Pisoni, Roldano Cardini: Risks of falls in subjects with multiple sclerosis. In: Archives of Physical Medicine and Rehabilitation. Nr. 83, 2002, S. 864–867 (sciencedirect.com).
- Maurizio Falso, Eleonora Cattaneo, Elisa Foglia, Marco Zucchini, Franco Zucchini: How does a Personalized Rehabilitative Model influence the Functional Response of Different Ankle Foot Orthoses in a Cohort of Patients Affected by Neurological Gait Pattern? Hrsg.: Journal of Novel Physiotherapy and Rehabilitation. Band 1, 2017, ISSN 2573-6264, S. 072–092 (core.ac.uk).
- Eva Swinnen, Tom Deliens, Elke Dewulf, Shauni Van Overstraeten, Nina Lefeber, Johan Van Nieuwenhoven, Stephan Ilsbroukx, Eric Kerckhofs: What is the opinion of patients with multiple sclerosis and their healthcare professionals about lower limb orthoses? A qualitative study using focus group discussions. In: NeuroRehabilitation. Band 42, Nr. 1, 2018, S. 81–92 (vub.be).
- Camela Leone, Deborah Severijns et al.: Prevalence of Walking-Related Motor Fatigue in Persons With Multiple Sclerosis. In: Neurorehabilitation and Neural Repair. 4. Auflage. Nr. 30. Sage Journals, 2015, S. 373–383 (sagepub.com).
- D. T. Shakespeare, M. Boggild, C. Young: Anti-spasticity agents for multiple sclerosis. In: Cochrane database of systematic reviews (Online). Nummer 4, 2003, S. CD001332, doi:10.1002/14651858.CD001332. PMID 14583932.
- Tetrahydrocannabinol und Cannabidiol–Sativex<sup>®</sup>–05–2011. In: Pharmazeutische Zeitung online. 2011, abgerufen am 27. Dezember 2014.
- Arzneimittel-Richtlinie/Anlage VI: Gabapentin zur Behandlung der Spastik im Rahmen der Multiplen Sklerose, Beschluss des G-BA vom 28. März 2014, abgerufen am 29. März 2014.
- Pöllmann et al.: Therapie von Schmerzen bei MS – eine Übersicht mit evidenzbasierten Therapieempfehlungen. In: Fortschritte der Neurologie-Psychiatrie. Band 73, Nummer 5, Mai 2005, S. 268–285, doi:10.1055/s-2004-830193. PMID 15880305. (Übersichtsarbeit).
- V. Kalsi, C. J. Fowler: Therapy Insight: bladder dysfunction associated with multiple sclerosis. In: Nature clinical practice. Urology. Band 2, Nummer 10, Oktober 2005, S. 492–501, doi:10.1038/ncpuro0323. PMID 16474623. (Übersichtsarbeit).
- R. M. Merson, M. I. Rolnick: Speech-language pathology and dysphagia in multiple sclerosis. In: Physical medicine and rehabilitation clinics of North America. Band 9, Nummer 3, August 1998, S. 631–641, PMID 9894114. (Übersichtsarbeit).
- Psychological interventions for multiple sclerosis. In: Cochrane database of systematic reviews (Online). Nummer 1, 2006, S. CD004431, doi:10.1002/14651858.CD004431.pub2. PMID 16437487.
- Tomassini et al.: Comparison of the effects of acetyl L-carnitine and amantadine for the treatment of fatigue in multiple sclerosis: results of a pilot, randomised, double-blind, crossover trial. In: Journal of the neurological sciences. Band 218, Nummer 1–2, März 2004, S. 103–108, doi:10.1016/j.jns.2003.11.005. PMID 14759641.
- Wingerchuk et al.: A randomized controlled crossover trial of aspirin for fatigue in multiple sclerosis. In: Neurology. Band 64, Nummer 7, April 2005, S. 1267–1269, doi:10.1212/01.WNL.0000156803.23698.9A. PMID 15824361.
- Rammohan et al.: Efficacy and safety of modafinil (Provigil) for the treatment of fatigue in multiple sclerosis: a two centre phase 2 study. In: J Neurol Neurosurg Psychiatry. 2002;72, S. 179–183 PMID 11796766
- Pucci et al.: Amantadine for fatigue in multiple sclerosis. In: Cochrane database of systematic reviews (Online). Nummer 1, 2007, S. CD002818, doi:10.1002/14651858.CD002818.pub2. PMID 17253480. (Metaanalyse).
- Stankoff et al.: Modafinil for fatigue in MS: a randomized placebo-controlled double-blind study. In: Neurology. Band 64, Nummer 7, April 2005, S. 1139–1143, doi:10.1212/01.WNL.0000158272.27070.6A. PMID 15824337.
- B. M. Hulter, P. O. Lundberg: Sexual function in women with advanced multiple sclerosis. In: Journal of neurology, neurosurgery, and psychiatry. Band 59, Nummer 1, Juli 1995, S. 83–86, PMID 7608715. PMC 1073606 (freier Volltext).
- M. Zorzon et al.: Sexual dysfunction in multiple sclerosis: a case-control study. I. Frequency and comparison of groups. In: Multiple sclerosis. Band 5, Nummer 6, Dezember 1999, S. 418–427, PMID 10618699.
- D. Borello-France et al.: Bladder and sexual function among women with multiple sclerosis. In: Multiple sclerosis. Band 10, Nummer 4, August 2004, S. 455–461, PMID 15327046.
- R. DasGupta, C. J. Fowler: Sexual and urological dysfunction in multiple sclerosis: better understanding and improved therapies. In: Current opinion in neurology. Band 15, Nummer 3, Juni 2002, S. 271–278, PMID 12045724. (Review).
- Natalie E. Parks et al.: Dietary interventions for multiple sclerosis-related outcomes. In: The Cochrane Database of Systematic Reviews. Band 5, 19. Mai 2020, S. CD004192, doi:10.1002/14651858.CD004192.pub4, PMID 32428983, PMC 7388136 (freier Volltext).
- Vanitha A Jagannath et al.: Vitamin D für die Behandlung von Multipler Sklerose. In: Cochrane. 24. September 2018, abgerufen am 9. September 2020.
- Apel et al.: Frequency of current utilisation of complementary and alternative medicine by patients with multiple sclerosis. In: Journal of neurology. Band 253, Nummer 10, Oktober 2006, S. 1331–1336, doi:10.1007/s00415-006-0217-9. PMID 16786211.
- Pucci et al.: Why physicians need to look more closely at the use of complementary and alternative medicine by multiple sclerosis patients. In: European journal of neurology. Band 11, Nummer 4, April 2004, S. 263–267, doi:10.1046/j.1468-1331.2003.00758.x. PMID 15061828.
- S. Schwarz et al.: Alternative und komplementäre Therapien der Multiplen Sklerose. In: Fortschritte der Neurologie-Psychiatrie. Band 73, Nummer 8, August 2005, S. 451–462, doi:10.1055/s-2004-830248. PMID 16052439. (Übersichtsarbeit)
- Abfrage bei Clinicaltrials.org am 12. November 2013.
- B. A. Cohen, P. Rieckmann: Emerging oral therapies for multiple sclerosis. In: International journal of clinical practice. Band 61, Nummer 11, November 2007, S. 1922–1930, doi:10.1111/j.1742-1241.2007.01561..x. PMID 17784852. (Review).
- P. A. Muraro, B. Bielekova: Emerging therapies for multiple sclerosis. In: Neurotherapeutics. Band 4, Nummer 4, Oktober 2007, S. 676–692, doi:10.1016/j.nurt.2007.07.003. PMID 17920549. (Übersichtsarbeit über aktuelle Forschungsschwerpunkte)
- Christoph Kleinschnitz et al.: Multiple sclerosis therapy: an update on recently finished trials. In: Journal of neurology. Band 254, Nummer 11, November 2007, S. 1473–1490, doi:10.1007/s00415-007-0684-7. PMID 18004638. (Review). (Übersichtsarbeit über aktuelle Forschungsschwerpunkte)
- Blanco et al.: Autologous haematopoietic-stem-cell transplantation for multiple sclerosis. In: Lancet neurology. Band 4, Nummer 1, Januar 2005, S. 54–63, doi:10.1016/S1474-4422(04)00966-4. PMID 15620857. (Übersichtsarbeit zur autologen Stammzelltransplantation)
- Gladstone et al.: High-dose cyclophosphamide for moderate to severe refractory multiple sclerosis. In: Archives of neurology. Band 63, Nummer 10, Oktober 2006, S. 1388–1393, doi:10.1001/archneur.63.10.noc60076. PMID 16908728.
- H. L. Atkins et al.: Immunoablation and autologous haemopoietic stem-cell transplantation for aggressive multiple sclerosis: a multicentre single-group phase 2 Trial. Lancet. 8. Juni 2016, pii: S0140-6736(16)30169-6. PMID 27291994, doi:10.1016/S0140-6736(16)30169-6.
- Vana et al.: Platelet-derived growth factor promotes repair of chronically demyelinated white matter. In: Journal of Neuropathology & Experimental Neurology, Band 66, Nummer 11, November 2007, S. 975–988, doi:10.1097/NEN.0b013e3181587d46. PMID 17984680. PMC 2788485 (freier Volltext).
- Nait-Oumesmar et al.: Activation of the subventricular zone in multiple sclerosis: evidence for early glial progenitors. In: Proceedings of the National Academy of Sciences. Band 104, Nummer 11, März 2007, S. 4694–4699, doi:10.1073/pnas.0606835104. PMID 17360586. PMC 3025281 (freier Volltext).
- Volltext 'MS in focus’ 11/2008 Stem Cells and Remylination in MS (Memento vom 25. Juni 2012 im Internet Archive) (PDF; 1,4 MB)
- G. Ristori et al.: Effects of Bacille Calmette-Guerin after the first demyelinating event in the CNS. In: Neurology. doi:10.1212/01.wnl.0000438216.93319.ab.
- C. M. Rice et al.: Stem Cells 1: Cell therapy for multiple sclerosis: an evolving concept with implications for other neuro-degenerative diseases. Lancet 2013; 382, S. 1204–1213.
- Pittock et al.: Change in MS-related disability in a population-based cohort: a 10-year follow-up study. In: Neurology. Band 62, Nummer 1, Januar 2004, S. 51–59, PMID 14718697.
- Daumer et al.: Prognosis of the individual course of disease–steps in developing a decision support tool for Multiple Sclerosis. In: BMC medical informatics and decision making. Band 7, 2007, S. 11, doi:10.1186/1472-6947-7-11. PMID 17488517. PMC 1884137 (freier Volltext). Dort vorgestelltes Web-basiertes Programm zur Bestimmung des Risikoprofils.
- S2-Leitlinie: Diagnose und Therapie der Multiplen Sklerose. Stand Januar 2012 (Ergänzung August 2014) (PDF; 3,1 MB) Arbeitsgemeinschaft der Wissenschaftlichen Medizinischen Fachgesellschaften, abgerufen am 28. Oktober 2019.
- Krankheitsbezogenes Kompetenznetz Multiple Sklerose e. V. (Hrsg.): Qualitätshandbuch MS / NMOSD. Empfehlungen zur Therapie der Multiplen Sklerose / Neuromyelitis-optica-Spektrum-Erkrankungen für Ärzte. 3. überarbeitete und erweiterte Auflage Juli 2018; Seite 244
- Rate of Pregnancy-Related Relapse in Multiple Sclerosis, NEJM doi:10.1056/NEJM199807303390501, abgerufen am 28. Oktober 2019.
- Berger T, Di Pauli F. J Neurol Neurochir Psychiatr 2009;10:26-31
- Hellwig K et al. Ther Adv Neurol Disord 2012;5:247–53
- EMA -> „Medicines“ -> „Search“: Namen des Medikaments eingeben und suchen klicken – Runterscrollen und den Artikel mit dem Namen des Medikaments und „European puplic assessment report (EPAR)“ im Titel anklicken – Auf dieser Seite erneut runterscrollen und „Product information“ anklicken -> Sprache „German“ auswählen und zu Abschnitt „Schwangerschaft, Stillzeit, Fertilität“ scrollen.
- Patientenaufklärung zur Behandlung mit Mitoxantron (PDF; 106 kB) Kompetenznetz Multiple Sklerose, abgerufen am 26. Juli 2020
- Fachinfo Copaxone, Website des Herstellers, abgerufen am 26. Juli 2020
- Fachinfo Clift (PDF) Website des Herstellers, abgerufen am 26. Juli 2020
- DKMS Deutsche Knochenmarkspenderdatei. dkms.de; abgerufen am 19. Mai 2010.
- Stellungnahme des Ärztlichen Beirats der DMSG, Bundesverband e. V. zu Organtransplantation, Blutspende und Stammzell-Spende bei Multipler Sklerose. (Memento vom 16. Januar 2013 im Internet Archive) Deutsche Multiple Sklerose Gesellschaft, 13. November 2012; abgerufen am 28. Februar 2013.
- 90-Sekunden-Version