Präkursor-Proteine
Präkursor-Proteine (englisch precursor aus lateinisch praecursor ‚Vorläufer‘), auch Propeptide oder Präproteine, sind inaktive Präkursoren von Proteinen, welche durch mindestens eine posttranslationale Modifikation, eine proteolytische Spaltung einer Peptidbindung, in eine aktive Form überführt werden. Die Vorsilben Pro oder Präpro vor dem Namen des Proteins kennzeichnen den Präkursor.[1] Präkursor-Proteine entstehen zunächst in einer inaktiven Form und werden erst bei Bedarf und in situ durch spezifische Aktivierungs-Enzyme aktiviert.
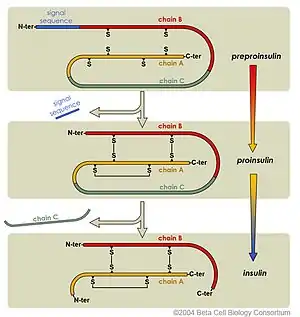
Funktion der Präkursor-Peptidsequenz
Generell verhindert die Präkursor-Sequenz die Aktivität des Proteins, manchmal allosterisch, indem sich dieser Bereich etwa über ein aktives Zentrum schiebt oder die Konformation des Gesamtmoleküls so beeinflusst, dass es nicht wirksam wird. In einigen Fällen (Insulin, Kollagen) sind diese Bereiche erforderlich für die funktionale Ausbildung der Konformation der Tertiärstruktur. Oft stellt das Präkursor-Protein eine Transportform oder eine Vorratsform dar. Die Abspaltung einer Peptidsequenz geht in aller Regel mit einer interaktiven Konformationsänderung einher.
Präkursor-Proteingruppen
Prohormone
Präkursor-Hormone werden auch oft als Prohormone bezeichnet, etwa Proinsulin, der Präkursor des Insulins.
Proenzyme
Präkursor-Enzyme werden als Proenzyme oder Zymogene bezeichnet. Beispiele stellen Verdauungsenzyme, Gerinnungsfaktoren, spezifische Proteinasen wie die Prokollagenase[2] und einige Faktoren des Komplementsystems.
Präkursor-Strukturproteine
Einige Strukturproteine entstehen zunächst als inaktive Präkursoren, welche erst in situ ihre aktive starre Form erhalten, wie Kollagen oder das Seidenprotein Fibroin.
Spezifische Aktivierungs-Enzyme
Aktivierungs-Enzyme zur spezifischen Spaltung eines Präkursor-Proteins in ein Propeptid und ein aktives Protein sind Teil der posttranslationalen Modifikationen. Als Peptidasen sind sie Hydrolasen und gehören der EC 3.4.-.- an.
Beispiele:
Die Spaltung der Prokollagene erfolgt durch Prokollagen-Peptidasen.[3] Dabei ist das Enzym Prokollagen-N-Endopeptidase (EC 3.4.24.14) bei der Abspaltung aminoterminaler Sequenzen erforderlich, während das Enzym Prokollagen-C-Endopeptidase (EC 3.4.24.19) carboxyterminale Prokollagen-Sequenzen abspaltet.
Die Aktivierung durch Abspaltung eines aminoterminalen Peptides vom Pro-Inselzell-Amyloid-Polypeptid (proIAPP) erfolgt durch das Prohormon-Convertase-Enzym[4] (EC 3.4.21.93).
Siehe auch
Einzelnachweise
- Cleavage on pair of basic residues. In: UniProt Keywords. UniProtKB, abgerufen am 10. September 2010: „Definition. Protein which is posttranslationally modified by the cleavage on at least one pair of basic residues, in order to release one or more mature active peptides (such as hormones).“
- Edward J. Campbell, J. Davis Cury, Cathy J. Lazarus, and Howard G. Welgus: Monocyte procollagenase and tissue inhibitor metalloproteinases. Identification, characterization, and regulation. (PDF) In: The Journal of Biological Chemistry. 262, Nr. 33, 25. November 1987, S. 15862–15868. Abgerufen am 3. März 2013.
- Charles M. Lapière, Albert Lenaers, and Leonard D. Kohn: Procollagen peptidase: An enzyme excising the coordination peptides of procollagen. In: Proc Natl Acad Sci U S A.. 68, Nr. 12, Dezember 1971, S. 3054–3058. PMC 389589 (freier Volltext).
- Jing Wang, et al.: The prohormone convertase enzyme 2 (PC2) is essential for processing pro-islet amyloid polypeptide at the NH2-terminal cleavage site. In: diabetes. 50, Nr. 3, März 2001, S. 534–539. doi:10.2337/diabetes.50.3.534. Abgerufen am 3. März 2013.