Chemotaxis
Chemotaxis (griechisch chêmeia „Chemie“ und altgriechisch τάξις taxis „Ordnung, Aufmarsch“) bezeichnet die Beeinflussung der Fortbewegungsrichtung von Lebewesen oder Zellen durch Stoffkonzentrationsgradienten. Wird die Bewegung in einem solchen Gradienten in Richtung auf höhere Konzentrationen des Stoffes gesteuert, so bezeichnet man das als positive Chemotaxis und nennt den betreffenden Stoff Lockstoff oder Attractant. Wird die Bewegung in die umgekehrte Richtung gelenkt, nennt man das negative Chemotaxis und den betreffenden Stoff Schreckstoff oder Repellent. Positive Chemotaxis kann bei hoher Konzentration eines Stoffes in eine negative umschlagen.
| Übergeordnet |
| Taxis Antwort auf chemischen Stimulus |
| Untergeordnet |
| positive/negative zelluläre Chemotaxis Axonlenkung |
| Gene Ontology |
|---|
| QuickGO |
Phylogenese und chemotaktische Signalisierung
Chemotaxis ist eine der grundlegendsten physiologischen Zellreaktionen. In den frühen Entwicklungsphasen der Phylogenese war das Entstehen von Rezeptorsystemen für die Erkennung von schädlichen und günstigen Substanzen für einzellige Organismen von bedeutendem Vorteil. Umfangreiche Analysen chemotaktischer Abläufe des eukaryotischen Protozoons Tetrahymena pyriformis und der Konsensussequenz auftretender Aminosäuren in der Ursuppe deuten auf eine gute Korrelation zwischen chemotaktischen Eigenschaften dieser relativ einfachen organischen Moleküle und der Entwicklung der Erde hin. Daher nahm man an, dass frühzeitig aufgetretene Moleküle (z. B. Glycin, Glutamin, Prolin) chemisch sehr anziehend wirken und später aufgetretene (z. B. Tyrosin, Tryptophan, Phenylalanin) chemisch abweisend wirken.[1]
Bakterielle Chemotaxis
Bei Bakterien ist die Art der Steuerung der Chemotaxis verschieden je nach Art der Fortbewegung: freies Schwimmen mittels Flagellen oder mittels Drehung wendelförmiger Bakterien (Spirochäten), Kriechen auf Oberflächen fester oder gelartiger Untergründe (Myxobakterien, einige Cyanobakterien).
Bei Bakterien, die sich mittels Flagellen frei schwimmend in flüssigen Medium fortbewegen, ist zwischen polar und peritrich begeißelten Bakterien zu unterscheiden, also zwischen solchen, die nur an einem oder an zwei Enden („Polen“) Flagellen besitzen, und solchen, die mehrere Flagellen auf der gesamten Zelloberfläche verteilt tragen.
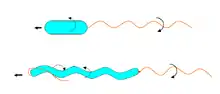
- Monopolar begeißelte Bakterien lassen ihre Geißeln entsprechend deren Wendelrichtung so um die Wendelachse rotieren, dass ein Vorschub erzeugt wird. Befinden sich mehrere Geißeln an dem begeißelten Zellende, so fügen sie sich dabei zu einem gewendelten, um die Wendelachse rotierenden Bündel (auch als Geißelzopf bezeichnet) zusammen. Der Bakterienkörper rotiert dabei mit einer geringeren Drehfrequenz in entgegengesetzter Richtung (Erhaltung des Drehimpulses).
- Bipolar begeißelte Bakterien lassen ihre Geißeln an einem Zellende wie die der monopolar begeißelten Bakterien rotieren, die Geißeln des anderen Zellendes werden jedoch über den Bakterienkörper zurückgeschlagen und rotieren (einzeln bzw. als Geißelbündel) um das Zellende.
- Peritrich begeißelte Bakterien lassen ihre Geißeln gleichsinnig rotieren, so dass sie sich dabei zu einem nach hinten gerichteten, wendelförmigen, um die Wendelachse rotierenden Geißelbündel („Geißelzopf“) zusammenlegen, wodurch ein Vorschub erzeugt wird. Wird die Drehrichtung der Geißeln umgekehrt, so richten sich die Geißeln nach verschiedenen Richtungen aus, die Vorschübe der einzelnen Geißeln heben sich ungefähr auf und das Bakterium taumelt um eine Stelle.
Das Problem bei der Chemotaxis von Bakterien ist, dass in der Größendimension der üblichen Bakterien (1 − 10 µm) der Stoffkonzentrationsgradient durch die Brownsche Molekularbewegung überdeckt wird. Dadurch kann ein Bakterium an einem bestimmten Ort im Stoffkonzentrationsfeld die Richtung des Gradienten nicht erkennen.
Der Ausweg besteht bei frei schwimmenden, polar begeißelten Bakterien darin, dass das Bakterium eine Strecke in einer zufällig festgelegten Richtung schwimmt. Steigt dabei die Stoffkonzentration entlang dieser Strecke, so behält es bei positiver Chemotaxis diese zufällig eingeschlagene Schwimmrichtung umso länger bei, je stärker die Konzentration steigt. Sinkt aber die Konzentration, so kehrt das Bakterium durch Umschaltung der Drehrichtung der Flagellen die Bewegungsrichtung sehr bald um. Dabei wird eine nicht genau, sondern nur ungefähr entgegengesetzte Schwimmrichtung eingeschlagen. Die Länge dieser zweiten Fortbewegungsphase hängt wiederum davon ab, ob die Stoffkonzentration dabei stärker oder schwächer steigt oder dabei fällt. Die jeweils zurückgelegte Strecke ist umso länger, je stärker die Stoffkonzentration steigt. Die Folge ist, dass sich das Bakterium in der Summe in Richtung steigender Konzentration bewegt. Bei negativer Chemotaxis verhält sich das Bakterium umgekehrt: Bei fallender Konzentration schwimmt es länger in der eingeschlagenen Richtung als bei steigender Konzentration. In der Summe bewegt sich dadurch das Bakterium in Richtung fallender Stoffkonzentration.

Frei schwimmende, peritrich begeißelte Bakterien verhalten sich etwas anders. Auch sie schwimmen zunächst eine Strecke in einer zufällig festgelegten Richtung. Auch sie behalten bei positiver Chemotaxis diese zufällig eingeschlagene Schwimmrichtung umso länger bei, je stärker die Konzentration steigt, und nur kurz, wenn die Konzentration sinkt. Danach gerät das Bakterium durch Umkehrung der Drehrichtung der auf der ganzen Oberfläche verteilten Flagellen – anders als polar begeißelte Bakterien – in eine Taumelbewegung und schlägt nach einer kurzen Taumelphase eine neue, wieder zufällige Fortbewegungsrichtung ein. Die Länge dieser zweiten Fortbewegungsphase hängt wiederum von der Änderung der Stoffkonzentration ab. Fortbewegung und Taumeln wechseln sich ständig ab und die zurückgelegte Strecke bei Fortbewegung ist umso länger, je stärker die Stoffkonzentration steigt. Die Folge ist, dass sich das Bakterium in der Summe in Richtung steigender Konzentration bewegt. Bei negativer Chemotaxis verhält sich das Bakterium umgekehrt: Bei fallender Konzentration schwimmt es länger in der eingeschlagenen Richtung als bei steigender Konzentration. In der Summe bewegt sich dadurch das Bakterium in Richtung fallender Stoffkonzentration.
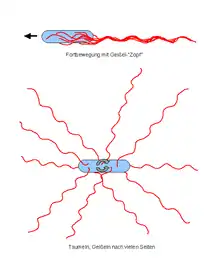
Chemotaxis bei peritrichen Bakterien
Die auf der Oberfläche eines peritrichen Bakteriums verteilten Flagellen drehen sich folgendermaßen:
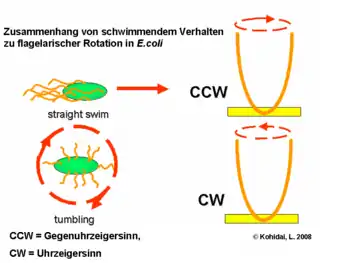
- Von der Flagellenspitze zum Bakterienkörper gesehen im Gegenuhrzeigersinn sich drehende Flagella schmiegen sich aneinander zu einem wendelförmigen, sich drehenden Bündel; so schwimmen die Bakterien in einer geraden Linie mit dem Flagellenbündel nach hinten gerichtet. Das Flagellenbündel wirkt als Schubpropeller.
- Bei sich im Uhrzeigersinn drehenden Flagellen wird kein Bündel gebildet und jedes Flagellum zeigt in eine andere Richtung. In der Folge taumelt das Bakterium auf der Stelle.
Die Drehrichtung der Flagellen kann umgekehrt werden. Beim Übergang der Drehrichtung vom Gegenuhrzeigersinn zum Uhrzeigersinn löst sich das Flagellenbündel und die Flagellen richten sich nach allen Seiten.
Verhalten
Die allgemeine Dynamik eines Bakteriums resultiert von sich abwechselnden Taumel- und Schwimmbewegungen. Wenn man ein Bakterium in einem einheitlichen Umfeld beobachtet, sieht es aus wie eine Folge zufallsbedingter Bewegungen: relativ gerade Bewegungen werden von scheinbar willkürlichen Taumelbewegungen unterbrochen. Bakterien ist es im Allgemeinen nicht möglich, die Bewegungsrichtung auszuwählen oder sich stets gerade fortzubewegen. Dies bedeutet, dass die Bakterien „vergessen“ in welche Richtung sie sich bewegen. Angesichts dieser Einschränkungen ist es bemerkenswert, dass Bakterien bestimmten chemischen Lockstoffen folgen und Schadstoffen ausweichen können.
In Gegenwart eines Stoffkonzentrationsgradienten passen sich Bakterien dieser Umgebung an. „Merkt“ ein Bakterium, dass es sich in die richtige Richtung bewegt (zum Lockstoff hin / vom Schadstoff weg), schwimmt es länger in einer geraden Linie weiter bevor Taumeln eintritt. Bewegt es sich in die falsche Richtung, tritt Taumeln schneller ein und das Bakterium schlägt wahllos eine andere Richtung ein. Auf diese Art und Weise erreichen Bakterien die höhere Konzentration des Lockstoffes sehr effektiv. Sogar in einer Umgebung mit äußerst hohen Konzentrationen können sie auf minimale Abweichungen reagieren.
Es ist bemerkenswert, dass sich diese zweckmäßige, scheinbar willkürliche Bewegungsart aus der Wahl zwischen zwei willkürlichen Fortbewegungsweisen ergibt; nämlich das gerade Schwimmen und das Taumeln. Die chemotaktischen Reaktionen der Bakterien erscheinen wie bei höheren Lebewesen, die ein Gehirn haben, das Vergessen, das Aussuchen von Bewegungen und die Beschlussfähigkeit.[2]
Signaltransduktion
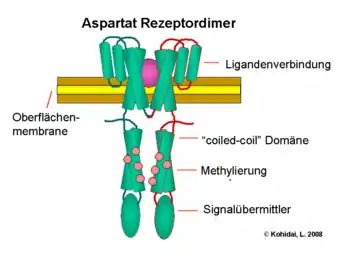
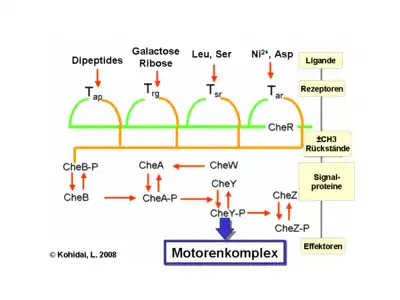
Stoffkonzentrationsgradienten werden durch multiple Transmembranrezeptoren namens Methyl-akzeptierende Chemotaxisproteine (MCPs) wahrgenommen, welche sich anhand ihrer Liganden unterscheiden. Lockstoffe bzw. Schreckstoffe können entweder direkt oder indirekt durch Interaktion mit Proteinen des Periplasmas gebunden werden. Signale dieser Rezeptoren werden durch die Zellmembran ins Zytoplasma übermittelt und aktivieren Che-Proteine, die wiederum die Taumel-Frequenz der Zelle bzw. die Rezeptoren selbst modifizieren.
Flagellen-Regulation
Die Proteine CheW und CheA binden den Rezeptor. Externe Stimuli verursachen Autophosphorylierung in der Histidinkinase, CheA, an einem einzelnen stark konservierten Histidin-Rest. CheA wiederum überträgt die Phosphorylgruppe an Aspartat-Reste in Antwortskoordinatoren CheB und CheY. Dieser Mechanismus der Signaltransduktion nennt sich „Zwei-Komponenten-System“ und befindet sich häufig in Bakterien. CheY induziert Rotation des Bakteriums durch Interaktion mit dem flagellären Switch-Protein FliM und ändert damit die Rotationsrichtung der Flagellen von linksdrehend nach rechtsdrehend. Wechsel der Drehrichtung eines einzelnen Flagellums kann seine ganze Funktion zum Erliegen bringen und ein Durcheinander verursachen.
Rezeptorregulation
CheB, durch CheA aktiviert, fungiert als Methylesterase und trennt somit Methylgruppen von Glutamat-Resten auf der cytosolischen Seite des Rezeptors. Es stellt einen Antagonisten zu CheR – einer Methyltransferase – dar, das Methylgruppen an die gleichen Glutamat-Seitenketten hinzufügt. Je mehr Methylester an den Rezeptor gebunden sind, desto sensitiver ist er auf Schreckstoffe. Da das Signal vom Rezeptor seine Demethylierung durch eine Rückkopplungsschleife auslöst, ist das System ständig an chemische Verhältnisse in der Umgebung angepasst und bleibt somit auch für kleine Veränderungen auch bei extremen Konzentrationen empfindlich. Diese Regulation ermöglicht es dem Bakterium, sich an chemische Verhältnisse der näheren Vergangenheit zu „erinnern“ und diese mit den aktuellen zu vergleichen. Insofern „weiss“ es, ob es sich mit oder gegen einen Konzentrationsgradienten bewegt. Weitere regulatorische Mechanismen wie Rezeptorclustering und Rezeptor-Rezeptor-Interaktionen müssen Erwähnung finden, da auch diese wichtige Elemente der Signalübermittlung sind und die Sensibilität des Bakteriums beeinflussen.
Eukaryotische Chemotaxis
Der Mechanismus, der in Eukaryoten Anwendung findet, unterscheidet sich vom prokaryotischen. Dennoch bildet auch hier die Wahrnehmung des Stoffkonzentrationsgradienten die Grundlage. Aufgrund ihrer Größe können Prokaryoten effektive Konzentrationsgradienten nicht wittern; somit scannen und beurteilen sie ihre Umgebung durch stetiges Schwimmen (abwechselnd geradeaus oder rotierend). Eukaryoten wiederum sind in der Lage, Gradienten aufzuspüren, was sich in einer dynamischen und polarisierten Distribution von Rezeptoren der Plasmamembran niederschlägt. Induktion dieser Rezeptoren durch Attractanten oder Chemorepellenten löst eine Migration zur oder weg von der chemischen Substanz aus. Rezeptorlevel, intrazelluläre Signalbahnen und Effektormechanismen repräsentieren alle diverse Komponenten der eukaryotischen Chemotaxis. Hier sind amöboide Bewegung sowie Cilia bzw. Flagella charakteristische Effektoren unizellulärer Organismen (z. B. Amöbe, Tetrahymena). Einige Vertreter höherer vertebraler Herkunft, wie z. B. Immunzellen, bewegen sich ebenfalls dorthin, wo sie benötigt werden. Abgesehen von einigen immunokompetenten Zellen (Granulozyt, Monozyt, Lymphozyt) ist eine erstaunlich große Gruppe von Zellen – früher als gewebegebunden klassifiziert – in der Tat unter gewissen physiologischen (z. B. Mastzelle, Fibroblast, Endothelzelle) oder pathologischen Bedingungen (z. B. Metastase) fähig zur Migration. Chemotaxis ist auch in den frühen Phasen der Embryogenese von großer Bedeutung, da die Entwicklung der Keimblätter durch Konzentrationsgradienten von Botenstoffen gesteuert wird.
Motilität
Im Gegensatz zur bakteriellen Chemotaxis sind die Mechanismen, durch die sich Eukaryoten bewegen, relativ unklar.[3] Teilweise scheinen externe chemotaktische Gradienten wahrgenommen zu werden, die sich in einem intrazellulären PIP3 Gradienten niederschlagen der eine Signalkaskade beeinflusst, die in der Polymerisation von Aktinfilamenten gipfelt. Deren wachsendes distales Ende bildet Verbindungen mit der internen Oberfläche der Plasmamembran via verschiedene Peptide aus und Pseudopodien formen sich. Ein eukaryotisches Cilium kann auch in eukaryotischer Chemotaxis involviert sein. Hierbei lässt sich die Bewegung auf einer Ca2+ basierten Modifikation des mikrotubulären Systems des Basalkörpers und dem Axonem (9*2+2) erklären. Das koordinierte Rudern hunderter Cilia wird durch ein submembranöses System zwischen den Basalkörpern synchronisiert. Die Details der verantwortlichen Signalkaskaden sind immer noch nicht klar.

Mit Chemotaxis verknüpfte migratorische Resonanz
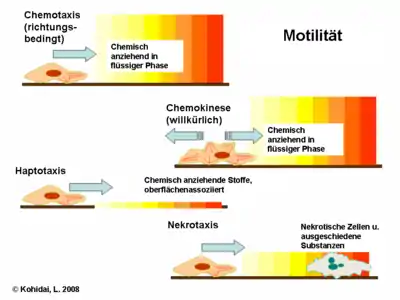
Obwohl Chemotaxis die am meisten studierte Methode der Zellmigration ist, sind weitere Formen von Lokomotion auf zellulärer Ebene zu erwähnen.
- Chemokinese wird auch durch lösliche Moleküle aus der Umgebung ausgelöst. Allerdings handelt es sich hierbei um eine nonvektorielle, zufällige Taxis. Man kann sie eher als Scanning des Umfelds anstatt einer Bewegung zwischen zwei klaren Punkten beschreiben. Es lassen sich keine gerichteten Komponenten für Auftreten oder Ausmaß festlegen.
- In Haptotaxis drückt sich der Lockstoffgradient an der Zelloberfläche aus, währenddessen er sich im klassischen Modell eher im freien Raum nachweisen ließ. Hier spielt die extrazelluläre Matrix (ECM) eine Schlüsselrolle. Faszinierende Beispiele des Haptotaxis-Modells sind transendotheliale Migration und Angiogenese, bei denen die Präsenz gebundener Liganden als Auslöser zu betrachten ist.
- Nekrotaxis verkörpert eine spezielle Art von Chemotaxis, in der Botenstoffe von nekrotischen oder apoptotischen Zellen freigelassen werden. Der Charakter dieser Substanzen entscheidet, ob Zellen angezogen oder abgestoßen werden, was die pathophysiologische Bedeutung dieses Phänomens unterstreicht.
Rezeptoren
Eukaryoten wittern die Präsenz chemotaktischer Stimuli hauptsächlich durch 7-Transmembran (gewundene) heterotrimerische G-Protein gekoppelte Rezeptoren, deren gewaltige Klasse einen bedeutsamen Anteil des Genoms ausmacht. Einige Mitglieder dieser Gen-Superfamilie finden Anwendung beim Sehvorgang (Rhodopsin) oder Geruchssinn. Die Hauptklassen spezialisierter chemotaktischer Rezeptoren werden von Formylpeptiden (FPR), Chemokinen (CCR oder CXCR) bzw. Leukotrienen (BLT) angesteuert. Übrigens kann Zellmigration auch über eine Fülle von Membranrezeptoren durch Aminosäuren, Insulin oder vasoaktive Peptide eingeleitet werden.
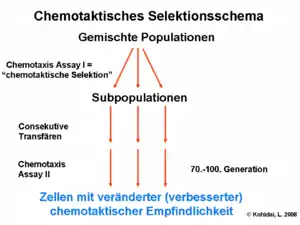
Chemotaktische Selektion
Aufgrund ihrer genetischen Grundlagen werden manche Rezeptoren für lange Zeit in die Zellmembran integriert; andere weisen Kurzzeitdynamiken vor, bei denen sie sich in Präsenz eines Liganden ad hoc zusammensetzen. Ihre diversen Facetten sowie die Vielseitigkeit der Liganden erlauben die Auswahl eines Responders durch eine simple Prüfung. Durch chemotaktische Selektion lässt sich nachweisen, ob ein noch uncharakterisiertes Molekül über den Lang- oder Kurzzeitpfad fungiert. Die Bezeichnung chemotaktische Auslese designiert ebenfalls eine Technik, die Eukaryoten oder Prokaryoten aufgrund ihrer Empfindlichkeit für Selektorliganden sortiert.[4]
Chemotaktische Liganden
Die Liste an Molekülen, die chemotaktische Phänomene herauslocken, ist relativ lang – man unterscheidet zwischen primären und sekundären. Die wichtigsten Vertreter primärer Liganden sind folgende:
- Formylpeptide sind Di-, Tri- und Tetrapeptide bakterieller Herkunft (Formylgruppe am N-Terminus des Peptids). Sie werden in vivo oder nach Dekomposition des Bakteriums freigelassen. Ein typischer Vertreter dieser Gruppe ist das N-Formylmethionyl-Leucyl-Phenylalanin (fMLF oder fMLP in Referenzen). Es spielt in Entzündungsprozessen eine Schlüsselkomponente im Heranlocken neutrophiler Granulozyten und Monozyten.
- C3a und C5a sind Zwischenprodukte der Komplementkaskade. Ihre Synthese ist mit drei alternativen Wegen der Komplementaktivierung (klassischer, Lektin- und alternativer Weg) gekoppelt. Hauptziele dieser Derivate stellen ebenfalls neutrophile Granulozyten und Monozyten dar.
- Chemokine repräsentieren eine eigene Klasse von Cytokinen. Ihre Gruppierung (C, CC, CXC, CX³C) spricht nicht nur für ihre Struktur (spezielle Ausrichtung von Disulfidbrücken), sondern auch die Zielgenauigkeit: CC-Chemokine wirken auf Monozyten (z. B. RANTES), CXC wiederum sind Neutrophil-spezifisch (z. B. IL-8).
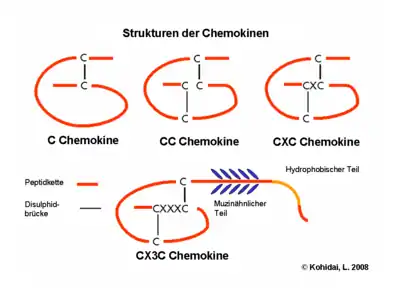
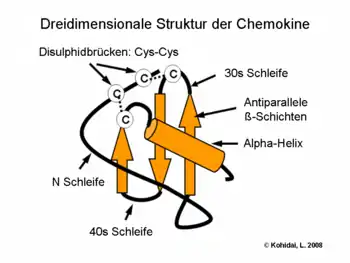
Untersuchungen der 3D Struktur von Chemokinen lassen uns darauf schließen, dass eine charakteristische Verknüpfung von β-Faltblättern und alpha-Helixen eine für die Interaktion mit dem Rezeptor unabdingbare Sequenz-Expression ermöglicht. Dimerisierung und erhöhte biologische Aktivität wurde durch Kristallographie bei mehreren Chemokinen wie z. B. IL-8 demonstriert.
- Leukotriene gehören zu der Gruppe der Eicosanoide: Sie sind bedeutende Lipidmediatoren der Arachidonsäurekaskade, konvertiert durch 5-Dipoxygenase. Hervorzuheben ist Leukotrien B4 (LTB4), welches Adhäsion, Chemotaxis und Leukozytenaggregation auslöst. Sein charakteristischer Effekt wird via G-Protein-gekoppelte heptahelikale Leukotrienrezeptoren induziert und schlägt sich besonders während Entzündungs- und allergischen Prozessen nieder.
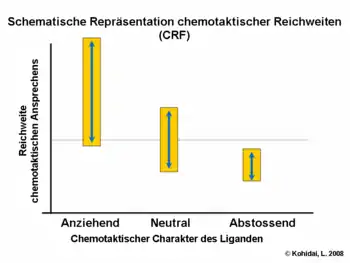
Chemotaktisches Range Fitting (CRF)
Man differenziert generell anhand der optimalen effektiven Konzentration des Liganden. Manchmal werden jedoch auch Korrelation der hervorgerufenen Wirkung und das Verhältnis zwischen Responderzellen und der Gesamtzahl unter Betracht gezogen. Untersuchungen über Liganden-Familien (z. B. Aminosäuren oder Oligopeptide) haben bewiesen, dass es eine Wechselwirkung zwischen Reichweite (Ausschlag, Anzahl der Responder) und chemotaktischer Aktivität gibt: Die Lockfunktion lässt sich auch über große Entfernung beobachten; abstoßender Charakter hingegen fungiert auf kurzer Distanz.
Klinischer Stellenwert
Ein verändertes migratorisches Potential der Zellen hat relativ große Bedeutung in der Entwicklung mehrerer klinischer Symptome und Syndrome. Modifizierte chemotaktische Aktivität extrazellulärer (z. B. Escherichia coli) oder intrazellulärer (z. B. Listeria monocytogenes) Pathogene ist von gewaltigem klinischen Interesse. Änderung der endogenen chemotaktischen Kompetenz dieser Mikroorganismen kann das Aufkommen von Infektionen oder die Verbreitung vieler ansteckenden Krankheiten verringern oder gar ausradieren. Abgesehen von infektiösen Erkrankungen gibt es einige andere Leiden, bei denen beeinträchtigte Chemotaxis den primären ätiologischen Faktor darstellt, so zum Beispiel im Chediak-Higashi-Syndrom, wo gigantische intrazelluläre Vesikel die normale Zellmigration hemmen.
| Krankheitstyp | erhöhte Chtx. | verminderte Chtx. |
|---|---|---|
| Infektionen | Entzündungen | AIDS, Brucellose |
| Chtx. führt zur Erkrankung | - | Chediak-Higashi-Syndrom, Kartagener-Syndrom |
| Chtx. ist beeinträchtigt | Atherosklerose, Arthritis, Parodontitis, Schuppenflechte, Reperfusionsverletzung, metastatische Tumoren | Multiple Sklerose, Morbus Hodgkin, Unfruchtbarkeit bei Männern |
| Intoxikation, Rausch | Asbestose, Benzpyren | Hg- und Cr-Salze, Ozon (O3) |
Messung der Chemotaxis
Vielfältige Techniken sind vorhanden, um die chemotaktische Aktivität der Zelle bzw. den anziehenden oder abstoßenden Charakter des Liganden zu evaluieren. Die Grundvoraussetzungen der Messung sind folgende:
- Stoffkonzentrationsgradienten können sich innerhalb des Systems recht schnell entwickeln und bleiben lang erhalten
- Chemotaktische und chemokinetische Aktivitäten sind profiliert
- Zellmigration ist zur und weg von der Achse des Konzentrationsgradienten möglich
- Erfasste Reaktionen sind tatsächlich das Resultat der aktiven Zellmigration
Abgesehen davon, dass es noch keine ideale chemotaktische Untersuchung gibt, weisen einige Protokolle und Ausrüstungsgegenstände Einklang mit den oben beschriebenen Konditionen auf. Am meisten angewendet werden:
- Agar-Probe, z. B. PP-Kammer
- Zwei-Kammer Techniken, z. B. Boyden-Kammer, Zigmond-Kammer, Dunn-Kammern, Multi-gut-Kammern, Kapillartechniken
- Andere: T-Maze Methode, Opaleszenz-Technik, Orientationsproben
Damit eine Zelle sich bewegen kann, benötigt sie einige zelluläre Komponenten (wie z. B. zelluläre Motoren, verschiedene Enzyme etc.). Weiterhin muss sie in der Lage sein, ihre Form zu verändern. Im Allgemeinen spricht man von zwei Typen der Zell-Lokomotion:
- Hapoptatisch (Bewegung aufgrund physischer und mechanischer Stimuli)
- Chemotaktisch (Migration als Antwort auf einen chemischen Gradienten)
Theoretische Beschreibung
Die Frage nach der zeitlichen Entwicklung der Konzentration chemotaktisch erregbarer Zellen bzw. Lebewesen in einem Volumen führt unter Ausnutzung des gaußschen Integralsatzes auf die partielle Differentialgleichung Dabei hat der Fluss üblicherweise neben der chemotaktisch induzierten Bewegung entlang des Gradienten auch noch eine Diffusionskomponente. Die Gleichung nimmt damit die Form an. Dabei bezeichnet eine Diffusionskonstante. Neben diesem einfachsten Fall existieren in der theoretischen Biologie mathematische Beschreibungen komplexerer Situationen, in denen beispielsweise die chemotaktisch aktive Substanz von den Zellen selbst produziert werden kann.[5]
Geschichte der Chemotaxisforschung
Fortbewegung von Lebewesen und Zellen wurde erstmals bei der Entwicklung von Mikroskopen entdeckt (Leeuwenhoek). Eingehendere Untersuchungen, auch schon zur Chemotaxis, wurden von Theodor Wilhelm Engelmann (1881) und Wilhelm Pfeffer (1884) im Bereich der Bakterien und von H. S. Jennings (1906) im Bereich von Ziliaten gemacht.
Der Nobelpreisträger Ilja Iljitsch Metschnikow hat mit seinen Studien der Phagozytose zu weiteren Fortschritten beigetragen. Die Wichtigkeit der Chemotaxis in der Biologie und der klinischen Pathologie wurde weitgehend in den 1930er Jahren erkannt. Während dieser Zeit wurden grundlegende Definitionen zu diesem Thema entworfen. H. Harris hat während der 1950er Jahre die allerwichtigsten Qualitätskontrollmethoden für Chemotaxis-Tests beschrieben.
In den 1960ern und 1970ern hat der Durchbruch in der modernen Zellbiologie und in der Biochemie das Fundament für neue Methoden gelegt, die die Erforschung von migratorischen Responderzellen und Subzellfraktionen, die für die Chemotaxis von Zellen verantwortlich sind, ermöglichten. Die bahnbrechenden Studien von J. Adler stellten einen bedeutenden Wendepunkt im Verständnis des gesamten Prozesses der intrazellularen Signalübertragung von Bakterien dar.[6] Am 3. November 2006 wurde Dennis Bray, Universität Cambridge, mit dem Microsoft European Science Award für seine Studien der Chemotaxis von Escherichia coli ausgezeichnet.[7][8]
Siehe auch
Quellen
- Amino acids. Abgerufen am 21. Januar 2009, englisch.
- Howard C. Berg: E. coli in Motion. In: Springer-Verlag, Berlin. ISBN 0-387-00888-8, 2003.
- Laszlo Köhidai: Chemotaxis as an Expression of Communication of Tetrahymena. In: Guenther Witzany, Mariusz Nowacki (Hrsg.): Biocommunication of Ciliates. Springer, Switzerland 2016, ISBN 978-3-319-32209-4, S. 65–82.
- L. Kohidai L, G. Csaba: Chemotaxis and chemotactic selection induced with cytokines (IL-8, RANTES and TNF alpha) in the unicellular Tetrahymena pyriformis.. In: Cytokine. 10, 1988, S. 481–6. PMID 9702410.
- Nicholas F. Britton: Essential Mathematical Biology. Springer-Verlag, 2004, ISBN 978-1-85233-536-6.
- Julius Adler, Wung-Wai Tso: Decision-Making in Bacteria: Chemotactic Response of Escherichia Coli to Conflicting Stimuli. In: Science. 184, 1974, S. 1292–4. PMID 4598187.
- Rob Knies: U.K. Professor Captures Inaugural European Science Award. Abgerufen am 21. Januar 2009, englisch.
- Computer bug study wins top prize. In: BBC News. Abgerufen am 21. Januar 2009, englisch.
Weblinks
- Chemotaxis (englisch)
- Cell Migration Gateway (englisch)
- Bruce Alberts, Alexander Johnson, Julian Lewis, Martin Raff, Keith Roberts, Peter Walter: Bacterial Chemotaxis Depends on a Two-Component Signaling Pathway Activated by Histidine-Kinase-associated Receptors. In: Molecular Biology of the Cell. 4. Auflage, englisch.
- Bruce Alberts, Alexander Johnson, Julian Lewis, Martin Raff, Keith Roberts, Peter Walter: The two-component signaling pathway that enables chemotaxis receptors to control the flagellar motor during bacterial chemotaxis. In: Molecular Biology of the Cell. 4. Auflage, englisch.
- Freies Tool basierend auf ImageJ zur Analyse von chemotaktischen Prozessen (englisch)