N-Glycolylneuraminsäure
N-Glycolylneuraminsäure, auch Neu5Gc genannt, gehört zu der Klasse der Sialinsäuren.
| Strukturformel | |||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
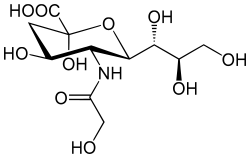 | |||||||||||||
| β-Anomer der N-Glycolylneuraminsäure | |||||||||||||
| Allgemeines | |||||||||||||
| Name | N-Glycolylneuraminsäure | ||||||||||||
| Andere Namen |
Neu5Gc | ||||||||||||
| Summenformel | C11H19NO10 | ||||||||||||
| Kurzbeschreibung |
farbloser Feststoff[1] | ||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||
| |||||||||||||
| Eigenschaften | |||||||||||||
| Molare Masse | 325,27 g·mol−1 | ||||||||||||
| Sicherheitshinweise | |||||||||||||
| |||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||
In tierischen Organismen ist Neu5Gc eine häufig vorkommenden Sialinsäure. Im menschlichen Organismus dagegen fehlt Neu5Gc. Beim Menschen kommt ausschließlich N-Acetylneuraminsäure vor, da das Enzym CMP-Neu5Ac-Hydroxylase, welches die Bildung von N-Glycolylneuraminsäure aus N-Acetylneuraminsäure katalysiert, beim Menschen nicht funktional ist.[2] Das Gen, welches für das entsprechende Enzym (CMP-Neu5Ac-Hydroxylase = CMAH) codiert, ist beim Menschen durch eine Mutation funktionslos. Im Gegensatz dazu haben beispielsweise Schimpansen die Fähigkeit Neu5Gc – unter anderem im Gehirn – zu synthetisieren.[3] Das für CMAH codierende Gen befindet sich auf Chromosom 6 Genlocus p21.32.[4] Neu5Gc kommt bei den meisten Mammalia vor, mit Ausnahmen wie Menschen, Frettchen, Schnabeltieren, westlichen Hunderassen und Neuweltaffen.[5]
Ein Forschungsteam an der medizinischen Fakultät der University of California, San Diego unter der Leitung von Ajit Varki hat 2014 einen neuen Mechanismus aufgezeigt, wie der Konsum von Neu5Gc aus externen Quellen wie rotem Fleisch und Milchprodukten zum erhöhten Risiko von kanzerogenen Tumoren beitragen könnte.[6] Andererseits wurde 2019 beobachtet, dass gentechnisch veränderte Mäuse ohne die Fähigkeit zur Neu5Gc-Bildung ein erhöhtes Risiko zur Herausbildung kardiovaskulärer Erkrankungen aufweisen, und die schädigende Wirkung durch Neu5Gc aus rotem Fleisch eher aus der menschlichen Antikörperbildung gegen Neu5Gc resultiert. Damit könnte die verlorengegangene Fähigkeit zur endogenen Neu5Gc-Bildung eine Ursache für das im Vergleich zu Tieren häufige Auftreten von Herz-Kreislauf-Erkrankungen beim Menschen sein.[7]
Das Fehlen von CMAH beim Menschen ist offenbar auch der Grund dafür, warum das Typhus-Toxin der Typhus-Erreger Salmonella Typhi und Salmonella Paratyphi zwar Menschen schädigt, nicht aber andere Säugetiere. Kultivierte menschliche Zellen werden durch Gabe von Neu5GC resistent gegen das Typhus-Toxin.[8]
Einzelnachweise
- Datenblatt N-Glycolylneuraminic acid bei Sigma-Aldrich, abgerufen am 15. Juni 2011 (PDF).
- M. von Elstermann: Alternative Wege einer endogenen Biosynthese der N-Glycolylneuraminsäure in menschlichen Mammakarzinomzellen. Dissertation, Universität zu Köln, 2006. urn:nbn:de:hbz:38-20747
- R. Vaas: Zukunft der Neurowissenschaft. Lexikon der Neurowissenschaft.
- NCBI: CMAH cytidine monophosphate-N-acetylneuraminic acid hydroxylase (CMP-N-acetylneuraminate monooxygenase) pseudogene (Homo sapiens).
- Preston S. K. Ng, Raphael Böhm, Lauren E. Hartley-Tassell, Jason A. Steen, Hui Wang, Samuel W. Lukowski, Paula L. Hawthorne, Ann E. O. Trezise, Peter J. Coloe, Sean M. Grimmond, Thomas Haselhorst, Mark von Itzstein, Adrienne W. Paton, James C. Paton, Michael P. Jennings: Ferrets exclusively synthesize Neu5Ac and express naturally humanized influenza A virus receptors. In: Nature Communications. 5, 2014, S. 5750. doi:10.1038/ncomms6750. PMID 25517696. PMC 4351649 (freier Volltext).
- Annie N. Samraj, Oliver M. T. Pearce, Heinz Läubli, Alyssa N. Crittenden, Anne K. Bergfeld, Kalyan Banda, Christopher J. Gregg, Andrea E. Bingman, Patrick Secrest, Sandra L. Diaz, Nissi M. Varki, and Ajit Varki: A red meat-derived glycan promotes inflammation and cancer progression, PNAS, 13. Januar 2015, 112 (2) 542-547; doi:10.1073/pnas.1417508112
- Kawanishi Et al.: Human species-specific loss of CMP-N-acetylneuraminic acid hydroxylase enhances atherosclerosis via intrinsic and extrinsic mechanisms, PNAS, 6. August 2019, 116 (32) 16036-16045, doi:10.1073/pnas.1902902116.
- Lingquan Deng et al.: Host Adaptation of a Bacterial Toxin from the Human Pathogen Salmonella Typhi, in: Cell, Band 159, Nr. 6, S. 1290–1299, 4. Dezember 2014, doi:10.1016/j.cell.2014.10.057, dazu:
- Heather Buschman: New Research Details Why Typhoid Toxin Targets Only Humans, auf: SciTechDaily vom 8. Dezember 2014
Literatur
- Hedlund, M. et al. (2007): N-glycolylneuraminic acid deficiency in mice: implications for human biology and evolution, in: Mol Cell Biol 27(12), S. 4340–4346; PMID 17420276.
Weblinks
- Sialic Acid and Evolution (engl.)