Hoden
Der Hoden [ˈhoːdn̩] oder (seltener) der oder die Hode [ˈhoːdə] (über mittelhochdeutsch hōde und althochdeutsch hodo von indogermanisch *skeu(t)- „bedecken, verhüllen“) oder der Testikel (von lateinisch testiculus, Verkleinerungsform von testis „Zeuge [der Virilität], Hode“, Plural: testes; altgriechisch ὄρχις orchis), fachsprachlich auch Testis und Testiculus, ist ein paarig angelegtes, inneres männliches Geschlechtsorgan vieler sich geschlechtlich fortpflanzender Gewebetiere. Er gehört, wie der Eierstock der weiblichen Individuen, zu den Keimdrüsen (Gonaden) und produziert die Samenfäden (Spermien). Zudem werden im Hoden männliche Geschlechtshormone (Androgene), vor allem das Testosteron, gebildet. Die Hoden entstehen bei Wirbeltieren embryonal in der Bauchhöhle, wandern aber bei den meisten Säugetieren in den Hodensack (das Scrotum).
Anatomie
Größe und Lage
Der menschliche Hoden ist etwa pflaumenförmig, wiegt etwa 20 Gramm und hat ein mittleres Volumen von 20–25 ml. Die mittlere Länge beträgt 5 cm, die Dicke etwa 3 cm.[1] Die Hoden entwickeln sich erst in der Pubertät zu ihrer vollen Größe und erreichen im 4. Lebensjahrzehnt ihre Maximalgröße. Im Alter nimmt die Hodengröße wieder ab.[2] Das Hodenvolumen gibt unter anderem Aufschluss über den funktionellen Zustand des Hodens. Liegt das Hodenvolumen unterhalb von 8 ml, ist davon auszugehen, dass die Spermienproduktion nur eingeschränkt oder gar nicht funktioniert. Testosteron wird dagegen teilweise noch bis zu einem Volumen von 1,5 ml produziert; darunter ist der Hoden in der Regel funktionslos.
Bei den Säugetieren variiert die Hodenform von rundlich bis eiförmig. In der Größe gibt es deutliche Unterschiede, eine enge Beziehung zum Körpergewicht besteht jedoch nicht. Die größten Hoden in der Tierwelt besitzen Südkaper, sie machen mit je 500 kg 2 % des Körpergewichts aus.[3] Relativ große Hoden haben Nagetiere, Schafe (bis zu je 300 g) und Hausschweine (bis zu je 750 g), relativ kleine dagegen die Raubtiere. Bei Tieren mit einer jahreszeitlichen Periodik in der Fortpflanzung unterliegt die Hodengröße darüber hinaus saisonalen Schwankungen, die Hoden sind in der Paarungszeit deutlich größer als in der Paarungsruhe.
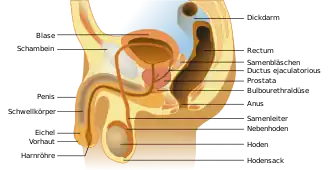
Bei den meisten Säugetieren liegen beide Hoden bei geschlechtsreifen Individuen im Hodensack (Scrotum) oder in hodensackähnlichen Hauttaschen. Die Hoden entstehen zwar in der Bauchhöhle, wandern aber etwa zum Geburtszeitpunkt, bei Nagetieren erst zur Pubertät, durch den Leistenkanal in den Hodensack. Dieser Vorgang wird als Hodenabstieg (Descensus testis) bezeichnet. Bei einigen Säugetieren (beispielsweise Hamster, Fledermäuse) findet ein saisonaler Hodenabstieg statt, und die Hoden liegen nur zur Paarungszeit außerhalb der Bauchhöhle. Innerhalb der Säugetiere gibt es allerdings einige Tiergruppen, bei denen die Hoden generell in der Bauchhöhle verbleiben, die sogenannten Testiconda. Dabei können die Hoden am Ort der Anlage verbleiben (wie bei Elefanten) oder zwar absteigen, aber dennoch in der Bauchhöhle verweilen (beispielsweise bei Walen, s. a. Tabelle).
| Testiconda | ||
| Kein Hodenabstieg | Unvollständiger Hodenabstieg | Saisonaler Hodenabstieg |
| Kloakentiere, Goldmulle, Rüsselspringer, Igeltenreks, Schliefer, Elefanten, Seekühe, Dreifinger-Faultiere, Ameisenbären | Wale, Gürteltiere | Maulwürfe, Schlitzrüssler, Erdferkel, Spitzmäuse, Fledertiere, einige Nagetiere |
Anatomischer Aufbau
Die äußere anatomische Gliederung des Hodens erfolgt nach dem ihm anliegenden und mit ihm verwachsenen Nebenhoden. Der zum Nebenhodenkopf zeigende Hodenabschnitt wird als Kopfende (Extremitas capitata), der zum Nebenhodenschwanz zeigende als Schwanzende (Extremitas caudata) bezeichnet. Am Schwanzende befindet sich häufig ein funktionsloses, warzenförmiges Rudiment des sogenannten Müller-Ganges, das als Hodenanhang (Appendix testis, eine Morgagni-Hydatide) bezeichnet wird. Der zum Nebenhoden zeigende Rand ist der Nebenhodenrand (Margo epididymalis), ihm gegenüber liegt der freie Rand (Margo liber). Außerdem lassen sich eine zur Mitte zeigende (Facies medialis) und eine nach außen zeigende Fläche (Facies lateralis) unterscheiden.
Der Hodenabstieg erfolgt in eine Aussackung des Bauchfells und der inneren Rumpffaszie (hier als Fascia spermatica interna bezeichnet), den Scheidenhautfortsatz (Processus vaginalis). Der Scheidenhautfortsatz gehört zu den Hodenhüllen im Inneren des Hodensacks. Der Bauchfellanteil dieser Ausstülpung wird als Scheidenhaut (Tunica vaginalis testis) bezeichnet. Sie kleidet dabei das Hodensackinnere aus (sogenanntes Wandblatt, Lamina parietalis oder Periorchium), stülpt sich dann als Doppellamelle ins Innere und überzieht als Eingeweideblatt (Lamina visceralis oder Epiorchium) den Hoden. Zwischen den beiden Blättern befindet sich ein sehr enger Spaltraum, das Cavum vaginale, das die Verschieblichkeit des Hodens im Hodensack sicherstellt. Die Verbindungsstelle zwischen den beiden Blättern ist das Hodengekröse (Mesorchium), welches der Befestigung des Hodens im Hodensack dient. Der Hoden ist außerdem am Schwanzende mit einem kurzen Band mit dem Nebenhoden verbunden (Hodeneigenband, Ligamentum testis proprium). Dieses setzt sich vom Nebenhodenschwanz als Nebenhodenschwanzband (Ligamentum caudae epididymidis) fort und befestigt den Hoden zusätzlich indirekt am Boden des Hodensacks. Am Scheidenhautfortsatz setzt auch der Hodenhebermuskel (Musculus cremaster) an, der als Schutzvorrichtung den Hoden bei Berührung oder Kälte näher an die Bauchwand zieht. Bei Nagetieren und Säugetieren mit saisonalem Hodenabstieg, selten auch bei einzelnen Individuen anderer Säugetiere, kann der Muskel den Hoden gänzlich in die Bauchhöhle zurückziehen („Pendelhoden“).
Direkt unter dem Bauchfellüberzug des Hodens liegt eine dicke weißliche Bindegewebskapsel, die Tunica albuginea. Sie sorgt für die mechanische Festigkeit des Organs und hält einen gewissen Innendruck aufrecht. Von dieser Kapsel ziehen Septen in das Innere und unterteilen den Hoden in Hodenläppchen (Lobuli testis). Der Hoden des Mannes besitzt etwa 350 Hodenläppchen. Die Septen bilden zudem einen Bindegewebskörper, das Mediastinum testis, das in der Humananatomie auch Corpus Highmori genannt wird.
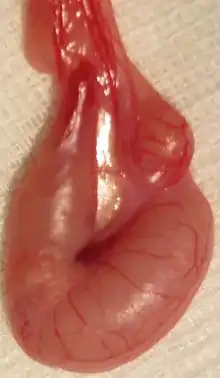
 Hoden, Nebenhoden und Samenstrang eines Katers:
Hoden, Nebenhoden und Samenstrang eines Katers:
1 Kopfende
2 Schwanzende
3 Nebenhodenrand
4 freier Rand
5 Hodengekröse
6 Nebenhoden
7 Geflecht der Hodenarterie und -vene
8 Samenleiter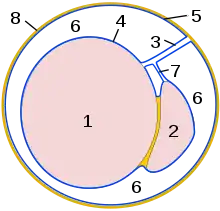 Querschnitt durch den Scheidenhautfortsatz:
Querschnitt durch den Scheidenhautfortsatz:
1 Hoden
2 Nebenhoden
3 Hodengekröse
4 Organblatt der Scheidenhaut
(Epiorchium)
5 Wandblatt der Scheidenhaut
(Periorchium)
6 Cavum vaginale
7 Nebenhodengekröse
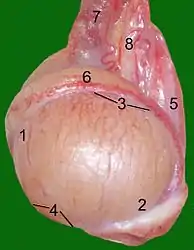
8 Fascia spermatica interna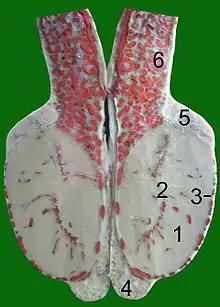 Schnitt durch einen Stierhoden:
Schnitt durch einen Stierhoden:
(Blutgefäße mit roter Gelatine injiziert)
1 Hodenparenchym
2 Mediastinum testis
3 Tunica albuginea
4 Nebenhodenschwanz
5 Nebenhodenkopf
6 Samenstrang mit
Rankenkonvolut der Hodenarterie
Gefäße und Nerven
.jpg.webp)
1 Rankenkonvolut
2 Hodenarterie
3 Gefäßbett des Hodens
4 Nebenhodenarterie
5 Gefäßbett des
Nebenhodenschwanzes
Die Blutversorgung des Hodens erfolgt über die Hodenarterie (Arteria testicularis). Sie entspringt, entsprechend dem Ort der embryonalen Anlage des Hodens (s. u.), unmittelbar hinter der Nierenarterie direkt aus der Bauchaorta im Lendenbereich. Bei den Tieren mit Hodenabstieg muss sich die Hodenarterie entsprechend verlängern und verläuft an der rückenseitigen Bauchwand entlang, in einem kurzen Gekröse (Mesorchium proximale) zum Leistenkanal. Außerhalb der Bauchhöhle tritt sie in den Samenstrang. Hier legt sie sich in enge spiralige Windungen, das sogenannte Rankenkonvolut. Dabei ist beispielsweise beim Bullen ein zwei Meter langer Arterienabschnitt auf einer Samenstranglänge von 13 cm untergebracht. Das Rankenkonvolut ist vom Rankengeflecht (Plexus pampiniformis) der Hodenvene (Vena testicularis) umsponnen. Hierdurch entsteht eine große Kontaktfläche zwischen zu- und abführendem Blut, die als Wärmeübertrager fungiert. Im Hodensack liegt die Temperatur wenige Grad unter der Körperinnentemperatur, was für die Bildung fruchtbarer Spermien bei Säugetieren mit Hodenabstieg unerlässlich ist. Das ankommende Blut in der Arterie wird durch diese Anordnung vom abfließenden Blut der Vene heruntergekühlt.
Die Hodenarterie verläuft am Nebenhodenrand zunächst zum Schwanzende des Hodens. Von dort zieht sie innerhalb der Hodenkapsel am freien Rand bei den meisten Säugetieren (eine Ausnahme machen beispielsweise Wiederkäuer) wieder zum Kopfende. Ihre Aufzweigungen verlaufen geschlängelt in der Tunica albuginea über die Seitenflächen und treten über die Hodensepten ins Innere zum Mediastinum testis und von dort wieder zentrifugal zurück zu den Samenkanälchen, um die sie ein Kapillarnetz bilden.
Die Innervation des Hodens wird durch den Sympathikus, einen Teil des vegetativen Nervensystems, vermittelt. Die Nervenfasern kommen aus dem Grenzstrang des Lendenbereichs und ziehen, die Hodenarterie geflechtartig umspinnend (Plexus testicularis, Synonym: Nervus spermaticus superior), zum Hoden. Eine zweite Gruppe von Nervenfasern verläuft von Kreuzganglien des Grenzstrangs mit dem Samenleiter (Ductus deferens) zum Hoden (Plexus deferentialis, Syn. Nervus spermaticus inferior). Die efferenten Nervenfasern treten vor allem an die Blutgefäße und regulieren damit die Durchblutung und die Temperatur des Hodens. Eine Beteiligung an der Feinsteuerung der Spermienbildung, dem Spermientransport und der Hormonproduktion im Hoden einiger Säugetiere wird derzeit diskutiert,[4] primär erfolgt diese Steuerung aber über Hormone. Die Zellkörper jener Nervenfasern, die Informationen zum Zentralnervensystem leiten (Visceroafferenzen), liegen in den Spinalganglien des Lendenbereichs. Sie übermitteln Schmerzempfindungen (Eingeweideschmerz), allerdings wird ein Großteil der hohen Schmerzempfindlichkeit des Hodens über die sensiblen Nervenfasern der Hodenhüllen (Äste des Nervus genitofemoralis) vermittelt. Die hohe Sensitivität gegenüber Berührungsreizen macht Hoden und Hodensack zu einer erogenen Zone. Andererseits wird die große Schmerzempfindlichkeit auch bei BDSM (cock and ball torture) und Folterungen ausgenutzt; Hodenquetschungen können zu einem Schock führen. Eine Neuralgie des Nervus genitofemoralis, die zum Beispiel nach chirurgischer Korrektur eines Leistenbruchs auftreten kann, äußert sich in Hodenschmerzen.[5]
Die Lymphgefäße des Hodens verlaufen zusammen mit den Hodenvenen zu den Lendenlymphknoten (Lymphonodi lumbales) rückenwärts der Aorta, bei Haussäugetieren auch zu den Darmbeinlymphknoten (Lymphonodi iliaci mediales) an der Aortenaufzweigung. In diesen, im Retroperitonäum des Bauchs liegenden Lymphknoten können bei Hodenkrebs Metastasen auftreten.
Übrige Chordatiere
Bei allen anderen Chordatieren liegen die Hoden in der Leibeshöhle und unterhalb der Nieren.
Bei den Schädellosen ist kein kompakter Hoden ausgebildet, die Gonaden sind noch segmental gegliedert, bei Asymmetron ist nur der rechte Hoden vorhanden. Bei Schleimaalen ist der langgestreckte Hoden ebenfalls nur einseitig in Form eines gelappten Bandes ausgebildet. Die Rundmäuler haben paarige Hoden, die über die gesamte Länge der Leibeshöhle reichen.
Innerhalb der Knorpelfische entwickelt sich nur beim Kragenhai, dem anatomisch und morphologisch urtümlichsten Hai, die gesamte Hodenanlage zur langgestreckten Keimdrüse, bei den übrigen Vertretern, wie bei den anderen Wirbeltieren, nur deren Mittelabschnitt (s. u.). Bei den Echten Haien sind die Hoden ebenfalls länglich, bei den Rochen kurz und platt. Bei Dornhaien und Zitterrochen liegen die Hoden weit vorn, nahe dem Herzbeutel, sonst im mittleren oder hinteren Rumpfabschnitt. Bei den meisten Knochenfischen sind die Hoden langgestreckt. Bei den Echten Knochenfischen liegen sie unterhalb der Nieren und der Schwimmblase und sind über ein Mesorchium befestigt. Bei einigen Barschartigen sind beide Hoden am hinteren Ende miteinander verschmolzen. Die dünne Tunica albuginea ist bei Knochenfischen gelegentlich pigmentiert. In den Hoden von Fischen kann gleichzeitig Eierstockgewebe auftreten (Zwittergonade, Ovotestis). Sägebarsche und Meerbrassen sind Hermaphroditen, besitzen also sowohl Hoden als auch Eierstöcke und können im Laufe ihres Lebens das Geschlecht wechseln.
Amphibien haben entweder längliche (Schwanzlurche, Schleichenlurche) oder rundliche (Froschlurche) Hoden. Sie sind über ein Mesorchium an der Rumpfwand oder der Urniere befestigt. Medial (in Richtung Medianebene) des Hodens ist ein deutlicher Fettkörper ausgebildet. Bei Salamandern sind mehrere Hodenabteilungen zu einem Lappen verschmolzen, die Anzahl der Abteilungen nimmt im Alter zu. Bei Amphibien zeigt sich die beginnende Trennung von Harn- und Samenweg. Die Nebenhodengänge (Ductuli epididymidis) münden erst kurz vor der Kloake in den Wolff-Gang. Männliche Kröten sind Hermaphroditen. Vor den Hoden liegt das sich aus der vorderen Gonadenanlage entwickelnde Bidder-Organ, ein primitiver Eierstock.[6][7]
Bei den Reptilien liegen die Hoden vor und unterhalb der Nieren in unmittelbarer Nachbarschaft zu den Nebennieren. Die Hoden sind oval, bei Schildkröten eher rundlich, bei Schlangen langgestreckt. Die Nebenhoden liegen medial (zur Körpermitte hin) des jeweiligen Hodens. Das Bindegewebsgerüst des Hodens ist schwach entwickelt.
Auch bei den Vögeln liegen die Hoden vor den Nieren an den Nebennieren. Im Gegensatz zum Eierstock, der bei Vögeln nur einseitig ausgebildet wird, sind die Hoden stets paarig. Die Hodengröße weist die stärksten jahreszeitlichen Schwankungen innerhalb der Wirbeltiere auf, sie nimmt beispielsweise bei Sperlingsvögeln in der Paarungszeit um bis das 800-fache zu und zur Paarungsruhe wieder ab. Bei einem Hauserpel sind die Hoden in der Paarungszeit etwa 8 cm lang und 4,5 cm breit. Das Bindegewebsgerüst des Hodens ist bei Vögeln nur gering entwickelt, die Tunica albuginea ist dünn, ein Mediastinum testis fehlt.[8] Die endoskopische Betrachtung des Hodens spielte früher eine große Rolle zur Geschlechtsbestimmung bei Arten, die keinen Sexualdimorphismus zeigen, ist heute aber weitestgehend durch molekularbiologische Methoden ersetzt.
Wirbellose
Innerhalb der Nesseltiere gibt es ungeschlechtliche und geschlechtliche Fortpflanzung. Bei geschlechtlicher Fortpflanzung werden die Keimzellen durch Platzen des Epithels in das umgebende Wasser oder den Gastralraum entlassen. Rippenquallen sind generell Zwitter und haben unter den kammartigen Plättchen („Rippen“) sitzende, in die Mesogloea eingelagerte Hoden und Eierstöcke.
Urmünder (Protostomia)
Die meisten Plattwürmer (Plathelminthes) sind Zwitter. Sie besitzen keine Leibeshöhle (Coelom), die Hoden liegen den Eierstöcken benachbart in einem Bindegewebsraum (Interstitium) innerhalb des Tieres, bei Bandwürmern innerhalb eines jeden Bandwurmgliedes (Proglottide). Einige Plattwürmer (Catenulida und Acoelomorpha) besitzen keine Gonaden. Auch Bauchhärlinge (Gastrotricha) haben kein Coelom, die Süßwasserarten vermehren sich ungeschlechtlich über Jungfernzeugung. Die Salzwasservertreter sind Zwitter, funktionell sind aber nur die Gonaden eines Geschlechts aktiv. Die Abgabe der Keimzellen erfolgt über Spermienhaufen. Rädertierchen (Rotatoria) haben ein Pseudocoelom mit einem paarigen oder unpaaren Hoden, bei einigen Arten kommen sogenannte Zwergmännchen vor, bei anderen keine Männchen, die Vermehrung erfolgt dann über Jungfernzeugung. Cycliophora vermehren sich im sogenannten Fressstadium ungeschlechtlich. Bei der geschlechtlichen Vermehrung kommen Zwergmännchen vor. Sie besitzen zwei externe „Hoden“ und ein Kopulationsorgan neben der Haftscheibe. Bei Kratzwürmern (Acanthocephala) zieht ein sogenanntes Genitalband durch den Körper, an dessen unterem Drittel die beiden Hoden sitzen. Von den Hoden zieht je ein Samenleiter zum Penis.
Priapswürmer (Priapulida) und Korsetttierchen (Loricifera) haben paarige Hoden, die mit den Protonephridien zu einem Harn- und Geschlechtsapparat vereinigt sind. Bei Fadenwürmern (Nematoda) gibt es sowohl getrenntgeschlechtliche Arten als auch Zwitter. Der langgestreckte Hoden liegt unterhalb des Darms und mündet auch in diesen (s. Abb.). Saitenwürmer (Nematomorpha) haben paarige Hoden im Pseudocoelom. Bärtierchen (Tardigrada) sind getrenntgeschlechtlich. Während die Leibeshöhle ein Pseudocoelom darstellt, gibt es um den unpaaren Hoden ein echtes Coelom. Stummelfüßer (Onychophora) besitzen paarige Hoden, die über Ausführungsgänge in einen gemeinsamen Samenleiter münden. Bei den Gliederfüßern (Arthropoda: Tausendfüßer, Insekten, Krebstiere und Cheliceraten) besitzen Männchen paarige Hoden im blutgefüllten Pseudocoel (Haemocoel) des Hinterleibs bzw. der hinteren Rumpfsegmente. Bei einigen Gliederfüßern kommen auch Zwitter vor.
Die Ringelwürmer haben paarige Hoden. Gürtelwürmer sind zumeist Zwitter, befruchten sich aber gegenseitig. Die Hoden liegen im Coelom, bei Regenwürmern im 10. und 11. Körpersegment und der Samenleiter mündet im 15. Segment nach außen. Vielborster sind dagegen zumeist eingeschlechtlich und männliche Vertreter besitzen in jedem Körpersegment Hoden. Bei Weichtieren (Mollusca) kommen Zwitter, Zwittergonaden (Ovotestis) und getrenntgeschlechtliche Formen vor. Das Coelom ist auf zwei Hohlräume um die Gonaden (Gonadocoel) und um das dahinterliegende Herz (Perikard) reduziert. Bei Armfüßern (Brachiopoda) liegen die Hoden im Coelom (genauer im Metacoel), die Gameten werden über die Metanephridien abgeleitet.
Neumünder (Deuterostomia)
Innerhalb der Stachelhäuter (Echinodermata) haben Seewalzen nur einen Hoden, bei Seeigeln und Seewalzen füllen die Hoden nahezu das gesamte Metacoel aus, bei den Seelilien (drei bis fünf Gonaden) und Seesternen (zwei pro Arm) liegen sie in den Armen und münden zwischen diesen Armen mit jeweils einer Geschlechtsöffnung.
 Innere Organe eines Knochenfischs:
Innere Organe eines Knochenfischs:
7 Hoden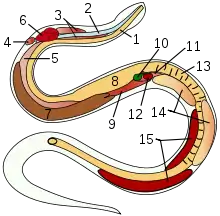 Innere Organe einer Schlange:
Innere Organe einer Schlange:
14 Hoden
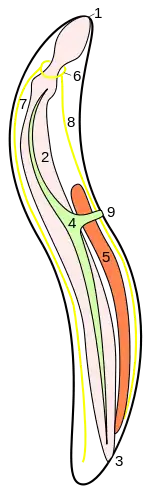 Fadenwurm:
Fadenwurm:
5 Hoden Bauplan eines Armfüßers mit Gonaden im Metacoel
Bauplan eines Armfüßers mit Gonaden im Metacoel
Feinbau und Funktion bei Wirbeltieren
Die Hodenläppchen enthalten jeweils zwei bis vier gewundene Samenkanälchen (Tubuli seminiferi contorti s. convoluti), die das Hodenparenchym darstellen. Sie sind etwa 50 bis 80 cm lang und haben einen Durchmesser von 150 bis 300 µm. Ihre Wand besteht aus einer Bindegewebshülle mit kontraktionsfähigen Myofibroblasten, einer Basalmembran und dem Keimepithel (Epithelium spermatogenicum).
Dieses Epithel besteht aus Samen- oder Keimzellen (Cellulae spermatogenicae) und Sertoli-Zellen. Aus den Keimzellen bilden sich die Spermien (Spermatogenese). Da die Spermatogenese die wichtigste Aufgabe des Hodens darstellt, sind die Keimzellen auch mengenmäßig am häufigsten im Hoden vorhanden. Bei der Spermienbildung werden die aufeinanderfolgenden Entwicklungsstadien der Keimzellen (Spermatogonien → Spermatozyten → Spermatiden → Spermien) allmählich in Richtung Lumen transportiert. Die Spermienbildung dauert zwischen 35 (Maus, Schwein) und 64 Tagen (Mensch), anschließend ist aber eine weitere Reifung in den Nebenhoden notwendig, damit die Spermien befruchtungsfähig werden. Diese dauert bei den meisten Säugetieren eine Woche, beim Menschen 8 bis 17 Tage. Pro Ejakulation werden beim Mann etwa 200 bis 300 Millionen Spermien aus dem Nebenhoden freigesetzt. Bei häufigerer Ejakulation sinkt die Spermienmenge, da die tägliche Spermienbildungskapazität begrenzt ist. Sie ist abhängig von der Hodenmasse und der Zahl der Sertoli-Zellen und beträgt beim Mann zwischen 45 und 200 Millionen Spermien pro Tag.[9]
Die zweite wichtige Komponente der Samenkanälchen sind die Sertoli-Zellen (Epitheliocyti sustentantes). Sie sind etwa 70 bis 80 µm lang und durchziehen radiär das gesamte Keimepithel bis zum Lumen. Die Sertoli-Zellen haben eine Stütz- und Ammenfunktion für die Samenzellen, sie ernähren die Samenzellen, sorgen für ihre richtige hormonelle Umgebung und bewerkstelligen über Plasmabewegungen deren Transport zum Lumen. Zudem phagozytieren die Sertolizellen degenerierte Samenzellen und Zellreste, die bei der Spermienentwicklung entstehen. Die Sertoli-Zellen werden durch das follikelstimulierende Hormon (FSH) der Hypophyse gesteuert, dessen Ausschüttung sie über die Bildung des Hormons Inhibin B beeinflussen. Zudem sezernieren sie das Androgenbindungsprotein, das Anti-Müller-Hormon und eine Kalium-reiche Seminalflüssigkeit.
Die Sertoli-Zellen besitzen zahlreiche Fortsätze, die die Keimzellen umgeben. Diese Zellfortsätze verbinden sich basal im Samenkanälchen über Tight junctions mit denen benachbarter Sertoli-Zellen und bilden so die sogenannte Blut-Hoden-Schranke. Dieser Begriff ist eigentlich irreführend, denn diese Barriere liegt nicht zwischen Blut und Hodengewebe, sondern verläuft zwischen den Spermatogonien und Spermatozyten, teilt also zirkulär die Hodenkanälchen in ein basales und ein zum Lumen gerichtetes (adluminales) Kompartiment. Die Blut-Hoden-Schranke ist für die meisten Eiweiße undurchlässig und schützt die Spermien vor Mutagenen und vor der körpereigenen Abwehr. Letzteres ist notwendig, weil die ersten Spermien erst nach Ende der Prägung der Lymphozyten entstehen (siehe Selbsttoleranz), das Immunsystem sie also für körperfremde Zellen halten würde.[10] Allerdings spielen auch entzündungshemmende Zytokine, deren Ausschüttung vermutlich Androgen-abhängig ist, und die Zellen des Immunsystems im Hoden (dendritische Zellen, Makrophagen) eine Rolle beim Schutz vor Autoimmunreaktionen.[11]
Die gewundenen Samenkanälchen gehen bei vielen Wirbeltieren an beiden Enden in ein kurzes gerades Samenkanälchen (Tubulus seminifer rectus) über. Die geraden Kanälchen sind von einem einschichtigen Epithel ausgekleidet und münden in ein Kanälchensystem im Mediastinum, das Hodennetz (Rete testis). Das Kanälchensystem des Hodennetzes ist ebenfalls zumeist von einem einschichtigen Epithel ausgekleidet (bei Rindern zweischichtig). Beim Mann, Hengst und bei Nagetieren liegt das Hodennetz allerdings vorwiegend an der Hodenperipherie („extratestikuläres Rete“). Vom Hodennetz ziehen mehrere geschlängelt verlaufende Ductuli efferentes testis in den Nebenhodenkopf und vereinigen sich dort zum Nebenhodengang. Bei Säugetieren sind es etwa 15 Ductuli efferentes, die Zahl variiert innerhalb der Wirbeltiere zwischen einem (z. B. Rochen) und 32 (z. B. Axolotl).
Das Gewebe zwischen den gewundenen Samenkanälchen wird als Interstitium bezeichnet. Es macht bei den meisten Wirbeltieren etwa 10 bis 20 % des Hodengewebes aus, in Extremfällen wie beim Waldmurmeltier fast 70 %. Im Interstitium finden sich neben Bindegewebe, Blutgefäßen und Nervenfasern auch die Leydig-Zellen (Endocrinocyti interstitiales). Sie bilden über spezielle Zellkontakte (Gap Junctions) untereinander in Verbindung stehende Zellverbände, sogenannte funktionelle Synzytien. Die Leydig-Zellen produzieren, in Abhängigkeit vom luteinisierenden Hormon (LH), männliche Geschlechtshormone (Androgene wie Testosteron und Androstanolon) sowie Oxytozin, welches die Motilität der Samenkanälchen fördert. Der Hoden ist damit auch ein endokrines Organ. Testosteron bewirkt in den Samenkanälchen die Reifung der Spermatiden. Um durch die Blut-Hoden-Schranke an seinen Wirkungsort zu gelangen, benötigt es das Androgenbindungsprotein der Sertoli-Zellen. Die Androgene haben darüber hinaus vielfältige Wirkungen im Körper, unter anderem fördern sie die Entwicklung der sekundären Geschlechtsmerkmale, wirken anabol und steuern das Sexualverhalten. Außerdem bilden die Leydig-Zellen zahlreiche weitere hormonell wirksame Peptide, die auf Nachbarzellen (parakrin) oder auf die sie bildende Leydig-Zelle selbst (autokrin) wirken.
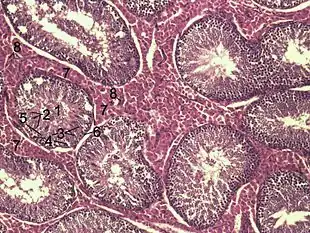 Histologisches Bild des Hodenparenchyms eines Ebers:
Histologisches Bild des Hodenparenchyms eines Ebers:
1 Lumen eines gewundenen Samenkanälchens
2 Spermatiden
3 Spermatozyten
4 Spermatogonien
5 Sertoli-Zellen
6 Myofibroblasten
7 Leydig-Zellen
8 Kapillaren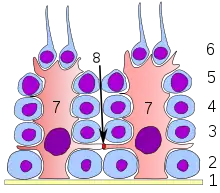 Keimepithel des Samenkanälchens:
Keimepithel des Samenkanälchens:
1 Basalmembran
2 Spermatogonie
3 Spermatozyt 1. Ordnung
4 Spermatozyt 2. Ordnung
5 Spermatide
6 reife Spermatide
7 Sertoli-Zelle
8 Tight junction
(Blut-Hoden-Schranke) Schema des inneren Aufbaus des Hodens und des Nebenhodens:
Schema des inneren Aufbaus des Hodens und des Nebenhodens:
1 Tunica albuginea
2 Septen
3 Hodenläppchen
4 Mediastinum testis
5 gewundene Samenkanälchen
6 gerade Samenkanälchen
7 Rete testis
8 Ductuli efferentes testis
9 Nebenhodengang
10 Anfang des Samenleiters
Hormonale Steuerung
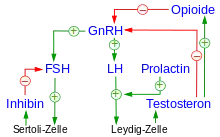
Die hormonelle Steuerung des Hodens erfolgt durch das stoßweise, von Nervenzellen in der Eminentia mediana im Hypothalamus gebildete Gonadoliberin (GnRH). GnRH wirkt allerdings nicht direkt auf den Hoden, sondern regt die Bildung der Hormone LH und FSH im Hypophysenvorderlappen an. Die Ausschüttung dieser Hormone wird über einen negativen Rückkopplungsmechanismus auch vom Hoden selbst gesteuert: Die FSH-Sekretion wird durch das von den Sertoli-Zellen produzierte Inhibin B, die GnRH-Sekretion durch das von den Leydig-Zellen produzierte Testosteron gehemmt. Die saisonalen Schwankungen der Größe und Aktivität der Hoden bei vielen Tieren werden durch Unterdrückung der GnRH-Sekretion während der Fortpflanzungsruhe unter dem Einfluss der Tageslichtlänge vermittelt. Der genaue Mechanismus ist noch nicht im Detail bekannt: Bei Säugetieren sind vermutlich Opioide, dopaminerge Neurone und Melatonin in diesen Regelkreis involviert, bei Vögeln auch die Hormone der Schilddrüse.
LH bindet an einen Membranrezeptor der Leydig-Zellen und induziert damit die Synthese von Androgenen. Dabei wird Cholesterin schrittweise, unter anderem über Pregnenolon und Progesteron, zu Testosteron umgesetzt, wobei zwei verschiedene Synthesewege (Δ4 und Δ5) möglich sind. Die LH-Wirkung auf die Leydig-Zellen wird durch Prolactin potenziert, bei einer Überproduktion von Prolaktin kommt es jedoch durch Herabregulation der LH-Rezeptoren zu einer Hemmung der Testosteronsynthese. Auch in der Nebennierenrinde kann LH die Bildung von Androgenen induzieren, das dort gebildete Dehydroepiandrosteron gelangt über das Blut in den Hoden und kann dort als Testosteron-Vorläufer genutzt werden. Etwa 97 % der Androgene werden im Hoden gebildet (beim Mann etwa 7 mg/Tag), der verbleibende Teil in den Nebennieren. Androgene wirken auf das Keimepithel und werden, an ein Protein gebunden, über das Blut auch zu ihren anderen Zielorganen transportiert.
FSH bindet an entsprechende Rezeptoren der Sertoli-Zellen. Sowohl FSH als auch das Testosteron steuern die Spermiogenese. FSH leitet die Spermiogenese ein, Testosteron fördert die mitotischen und meiotischen Zellteilungen und damit die Bildung von Spermatozyten aus den Spermatogonien, während FSH wiederum die endgültige Reifung der Spermatiden zu Spermien bewirkt.
Die Unterdrückung der hormonellen Anregung der Hodenfunktion wird auch bei der Entwicklung von Verhütungsmitteln für den Mann gegenwärtig intensiv beforscht. Dabei werden Testosteron oder dessen Kombination mit GnRH-Antagonisten oder Gestagenen wie Progestin gegenwärtig als aussichtsreichste Kandidaten angesehen. Sie führen zu stark erniedrigten Testosteron-Konzentrationen innerhalb des Hodens und damit zu einer starken oder vollständigen Reduzierung der Spermienbildung.[12][13][14] In der Tiermedizin ist seit 2008 ein Präparat auf der Basis des GnRH-Analogons Deslorelin (Suprelorin®) zugelassen, das bei Rüden eine mehrmonatige Unterdrückung der Fruchtbarkeit bewirkt. Darüber hinaus ist ein Impfstoff für Schweine (Improvac®) zugelassen, der zu einer Antikörperbildung gegen GnRH führt und damit die Hodenfunktion unterdrückt.[15]
Entwicklungsgeschichte

Voraussetzung der geschlechtlichen Fortpflanzung ist die Trennung der zur Fortpflanzung spezialisierten Zellen (Keimzellen) von den gewöhnlichen Körperzellen (somatische Zellen). Diese Trennung ist bereits bei Wimpertierchen in Form eines Mikronucleus, deutlicher dann bei Kugelalgen vollzogen, wo dem Hauptzellverband der Körperzellen eine kleine Gruppe Keimzellen (Gonidien) gegenübersteht, die allerdings noch nicht in Form eines abgegrenzten Organs ausgebildet ist. Das Vorhandensein von Hoden (oder prinzipiell von Gonaden) ist kein Grundmerkmal der Vielzeller.
Bei den Bilateria treten erstmals ein drittes Keimblatt, das Mesoderm, und damit komplexe Organe auf. Allerdings ist die geschlechtliche Fortpflanzung bei vielen Wirbellosen noch mit der Möglichkeit der ungeschlechtlichen Fortpflanzung kombiniert. Hierbei findet sich häufig ein Generationswechsel, also der sexuelle folgt auf einen asexuellen Fortpflanzungszyklus.
Die Differenzierung der Gonaden in Hoden und Eierstöcke ist Kennzeichen getrenntgeschlechtlicher Arten. Bislang ist nicht geklärt, ob Zwittrigkeit oder Getrenntgeschlechtlichkeit das plesiomorphe Merkmal der Bilateria ist. Beide Keimdrüsen gehen in der Embryonalentwicklung aus derselben Anlage hervor. In vielen Tiergruppen ist trotz dieser vollzogenen Geschlechtertrennung auch Fortpflanzung ohne Befruchtung (Parthenogenese) möglich, die als reduzierte Form der sexuellen Fortpflanzung angesehen werden kann. Hier treten männliche Tiere nur ausnahmsweise auf. Parthenogenese findet man in zahlreichen Taxa, von den Rädertierchen bis hin zu einigen Eidechsen. Bis zu den Amphibien sind auch Zwitterformen oder eine Veränderung des Geschlechts (Dichogamie) während der Ontogenese anzutreffen. Dabei ist sowohl eine Umwandlung der Eierstöcke in Hoden (Proterogynie) als auch der Hoden in Eierstöcke (Proterandrie) möglich.
Ob aus der zunächst geschlechtsindifferenten Anlage der Gonaden ein Hoden oder ein Eierstock entsteht, ist bei den meisten Tieren genetisch determiniert. Bei Würmern und Fliegen ist das Geschlecht durch das Verhältnis von X-Chromosomen und Autosomen festgelegt. Bei staatenbildenden Insekten entstehen Hoden bei Nachwuchs aus unbefruchteten Eiern, Eierstöcke bei Tieren mit diploidem Chromosomensatz, also aus befruchteten Eiern. Bei Säugetieren wird das Geschlecht durch das Y-Chromosom bestimmt. Auf diesem Geschlechtschromosom (Gonosom) ist ein Gen (Sex determining region of Y, Sry) lokalisiert, das mit Genen anderer Chromosomen interagiert und (beim Menschen ab der 7. Woche nach der Befruchtung) zur Bildung des Hoden-determinierenden Faktors führt. Dieser leitet die Entwicklung zum Hoden und damit zum männlichen Geschlecht generell ein. Es codiert eine Reihe von Transkriptionsfaktoren, die sogenannten HMG-Proteine (high mobility group proteins). Diese Proteine haben zahlreiche weitere Funktionen in anderen Geweben, die genauen Mechanismen bei der Hodenentstehung werden gegenwärtig intensiv erforscht.[16] Mit der Expression von Sry differenzieren sich die Sertoli-Zellen, welche unter anderem das Anti-Müller-Hormon bilden und damit die Rückbildung der Müller-Gänge bewirken. Die weitere Entwicklung des Hodens und die der übrigen Merkmale des männlichen Geschlechts wird durch Androgene gesteuert. Bei einigen Tiergruppen wird das Geschlecht dagegen durch Umweltfaktoren bestimmt. So ist bei einigen Amphibien und vielen Reptilien (Schildkröten, Alligatoren) das Geschlecht von der Bebrütungstemperatur abhängig.[17] (Siehe auch. Temperaturabhängige Geschlechtsbestimmung)
Bei vielen Tieren entstehen die Gonaden in enger Beziehung zum Exkretionssystem (Urniere, Nephridien), insbesondere die harnableitenden Wege werden als samenableitendes System mitgenutzt, weshalb man bei Wirbeltieren beide Organsysteme als Harn- und Geschlechtsapparat zusammenfasst. Bei den Wirbellosen sind Entstehungsort, Lage und Ausführungsgänge allerdings sehr verschieden ausgebildet, so dass man davon ausgeht, dass die geschlechtliche Fortpflanzung mehrfach und unabhängig voneinander in der Evolution entstanden ist. Die Komplexität des Geschlechtsorgane ist dabei nicht von der Evolutionsstufe abhängig, sie ist beispielsweise bei den Plattwürmern sehr hoch.
Embryologie bei Wirbeltieren
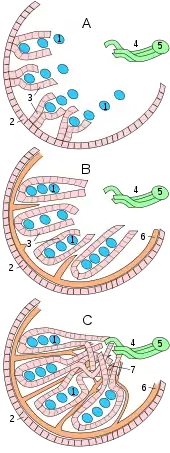
Hodenentwicklung bei Wirbeltieren
|
Hoden und Eierstock entstehen beim Embryo aus derselben Anlage, der sogenannten Genitalleiste. Sie bildet sich im Bereich der Urniere und reicht zunächst vom Thorax bis zur Lende. Bei den meisten Wirbeltieren wird nur der mittlere Teil dieser langgestreckten Anlage zur eigentlichen Keimdrüse, die übrigen Abschnitte entwickeln sich zu den Keimdrüsenbändern. In die Gonadenanlage wandern (beim Menschen in der 6. Embryonalwoche) unter dem Einfluss von Sry die Urkeimzellen aus dem Dottersack ein und das Epithel der primitiven Leibeshöhle (Coelom) wächst fingerartig als sogenannte primäre Keimstränge in die Anlage ein.
Die Keim- oder Hodenstränge dringen in die Gonadenanlage vor und umwachsen die Urkeimzellen. Dabei tritt vorübergehend eine Gliederung der Keimdrüsenanlage in Rinde und Mark auf, wobei sich bei männlichen Embryonen jedoch nur das Mark zum Hoden entwickelt, die Rinde dagegen wieder zurückgebildet wird. Bei genetisch weiblichen Individuen finden ähnliche Vorgänge statt, allerdings später und der Eierstock bildet sich aus der Rinde, während das Mark degeneriert. Die Verbindung der Hodenstränge zur Oberfläche geht schließlich verloren. Aus den Hodensträngen entwickeln sich über die Sry-exprimierenden Prä-Sertoli-Zellen die Sertoli-Zellen, die als Organisatoren der weiteren Hodenentwicklung angesehen werden[16] und dabei mit den myoiden Zellen interagieren. Aus den Urgeschlechtszellen entstehen die Spermatogonien.
Im Inneren bilden die Hodenstränge ein Netz aus untereinander in Verbindung stehenden Strängen, das spätere Hodennetz (Rete testis). Das Hodennetz nimmt Verbindung zu einigen Urnierenkanälchen auf, die damit zu den Ductuli efferentes des Nebenhodenkopfes werden. Der Urnierenausführungsgang (Wolff-Gang) wird als Nebenhodenkanal und Samenleiter ebenfalls zum samenableitenden Weg umfunktioniert. Das Lumen der Samenkanälchen entsteht jedoch erst zur Pubertät, bei Amphibien nach der Metamorphose, bis dahin sind die Hodenstränge solide.
Aus dem mesodermalen Anteil der Hodenanlage entstehen die Tunica albuginea, das Bindegewebsgerüst des Hodens und die Leydig-Zellen. Die Leydig-Zellen sind ebenfalls bereits in der frühen Hodenentwicklung anzutreffen, sie exprimieren den Steroidogenic factor 1 (Sf1), und ihre Testosteronproduktion bestimmt maßgeblich die Entwicklung der männlichen Geschlechtsorgane.[16]
Alterung
Beim Mann findet – im Gegensatz zur Frau (siehe Menopause) – kein plötzliches Aussetzen der Funktion der Keimdrüsen in einem definierten Lebensalter statt. Sowohl die Hormonproduktion als auch die Reifung der Keimzellen sind potentiell bis ins hohe Alter erhalten.[18] Tatsächlich sind bis in die zehnte Lebensdekade Vaterschaften belegt. In der Realität bestehen jedoch ausgeprägte individuelle Unterschiede und viele Männer werden früher oder später infertil, was nicht mit Impotenz verwechselt werden darf. Die genauen Ursachen für diese Unterschiede sind im Einzelnen unbekannt, vermutet werden unter anderem vaskuläre Faktoren. Statistisch betrachtet kommt es etwa ab der vierten Lebensdekade zur sehr langsam voranschreitenden Involution des Hodens mit Abnahme von Gewicht, Größe und Spermienproduktion. Für den Einzelnen sind jedoch kaum Vorhersagen zu treffen.
Auch die strukturellen Veränderungen unterliegen demzufolge einer großen Bandbreite, als typisch kann jedoch ein Mischbild von normalen und deutlich atrophischen Hodenkanälchen angesehen werden.[19] Ein bei manchen Männern zu beobachtender deutlicher Abfall der Testosteronproduktion kann zu einem Climacterium virile mit Hitzewallungen, Kopfschmerz und weiteren Symptomen führen.
Erforschungsgeschichte
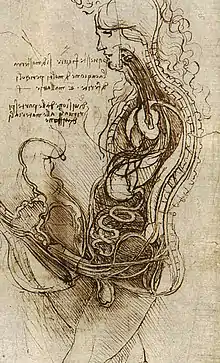
Der Hoden galt in Antike und Mittelalter nur als Durchgangsstation für den Samen. Alkmaion von Kroton (frühes 5. Jahrhundert v. Chr.) vermutete das Gehirn als Ursprung des Samens, der über Blutgefäße zu den Hoden gelange. Die Atomisten (Anaxagoras, Demokrit) und Aristoteles bezogen das Rückenmark in diesen Weg ein, Galenus (125–199) vermutete den Ursprung der Samenzellen in den Blutgefäßen, über welche sie in den Hoden gelangen. Diese Vorstellungen blieben bis ins Mittelalter erhalten. Die anatomischen Zeichnungen Leonardo da Vincis zeigen Verbindungen des Hodens zu Lunge und Gehirn, weil da Vinci die Herkunft der „geistigen Kraft“ des Samens im Gehirn vermutete, während die Hoden nur die stoffliche Grundlage für die „niederen Regungen“ beitragen.
Strukturelle Erforschung
Erst mit Beginn der Aufklärung im 17. Jahrhundert wurden die Vorstellungen vom männlichen Samen entmystifiziert und der direkte Zusammenhang zwischen Hoden und Fortpflanzung erkannt. Die erste moderne Beschreibung des Aufbaus des Hodens stammt von Reinier de Graaf (1641–1673). Nathaniel Highmore beschrieb 1651 den Bindegewebskörper des Hodens (Corpus Highmori), der 1830 von Astley Paston Cooper Mediastinum testis genannt wurde. Der Erfinder des Mikroskops, Antoni van Leeuwenhoek, entdeckte 1677 damit auch die Spermien, die er für miniaturisierte vorgebildete Lebewesen („Samentiere“) hielt.

Mit der Entwicklung histologischer Techniken konnte auch der Feinbau des Hodens aufgeklärt werden. 1841 erkannte der Schweizer Anatom Albert von Koelliker erstmals den direkten Zusammenhang zwischen Hodenkanälchen und Spermien und deckte auf, dass die Spermien in diesen Kanälchen als Produkte einer zellulären Differenzierung entstehen.[20] 1850 beschrieb Köllikers Schüler Franz von Leydig erstmals die Zwischenzellen (Leydig-Zellen).
1865 entdeckte Enrico Sertoli die Stützzellen (Sertoli-Zellen). 1871 gelang es Victor Ebner, die Sertoli-Zellen von den Spermatogonien abzugrenzen und fünf Jahre später prägte La Valette St. George[21] den Begriff „Spermatogonie“ und die noch heute übliche Einteilung der einzelnen Entwicklungsstadien der Samenzellen. Die Sertoli-Zellen wurden sehr lange als Synzitien betrachtet, erst 1956 konnten Don W. Fawcett und Mario H. Burgos nachweisen, dass jede Sertoli-Zelle eigene Zellgrenzen hat.
Bereits 1904 erkannte Hugo Ribbert, dass in das Blut verabreichtes Karmin nicht in das Lumen der Samenkanälchen und das Hodennetz gelangt. Dieser Entdeckung wurde lange Zeit keine Bedeutung zugemessen, obwohl sie der erste Nachweis der Blut-Hoden-Schranke war. Erst in den späten 1950er Jahren wurde diese Erkenntnis wieder aufgegriffen und 1963 gelang J. Brökelmann[22] der Nachweis der Tight junctions der Sertoli-Zellen als der morphologischen Grundlage der Blut-Hoden-Schranke. Paul J. Gardner und Edward A. Holyoke[23] konnten ein Jahr später die Feinstruktur der Blut-Hoden-Schranke aufklären.
Hormone
Obwohl die Auswirkungen von Kastrationen seit Jahrtausenden bekannt waren, gelang erst 1849 Arnold Adolph Berthold[24] mittels Hodentransplantationen bei Hähnen der experimentelle Nachweis der Hormonbildung im Hoden. In hohem Alter unternahm Charles-Édouard Brown-Séquard Ende des 19. Jahrhunderts Selbstversuche mit Flüssigkeit aus Hoden von Hunden und Meerschweinchen, denen er eine verjüngende und stärkende Kraft zuschrieb, allerdings waren es eher homöopathische Hormonmengen, die er auf diese Weise gewann. Zu Beginn des 20. Jahrhunderts galt die Transplantation von Tierhoden unter die Bauchdecke als Verjüngungsmittel, insbesondere die Wiener Robert Lichtenstern und Eugen Steinach waren Protagonisten dieser Methode. Steinach wollte diesen Verjüngungsprozess auch durch Unterbindung der Samenleiter erreichen (sein berühmtester Patient war Sigmund Freud) und beschrieb die Hodentransplantation als „Therapie“ bei Homosexualität. Nach 1945 kamen diese umstrittenen Xenotransplantationen aus der Mode.[25]
1903 publizierten Pol Bouin und Paul Ancel erstmals die Erkenntnis, dass die Leydig-Zellen der Bildungsort der männlichen Geschlechtshormone sind.[26] 1931 isolierten Adolf Butenandt und Kurt Tscherning Androsteron (ein Metabolit des Testosterons) aus Urin von Männern, 1935 konnte Ernst Laqueur das Testosteron selbst aus Stierhoden isolieren und prägte auch den Namen dieses Hormons (von testis „Hoden“ und „Steroid“).[27]
Die Existenz nichtsteroidaler Hormone im Hoden wurde bereits in den 1920er Jahren postuliert, aber erst 1932 von D. Roy McCullagh an kastrierten Ratten funktionell nachgewiesen und Inhibin genannt. Obwohl in den 1960er Jahren Bioassays für dieses Hormon entwickelt wurden, war dessen Existenz über einige Jahrzehnte umstritten und wurde erst 1979 allgemein akzeptiert. 1984/85 wurden die Struktur und die Untertypen des Hormons aufgedeckt. Mit der Aufklärung der das Hormon codierenden DNA-Sequenz wurde 1985 auch die Zugehörigkeit des Inhibins zur Gruppe der β-transforming-growth-factors erkannt.
Während die Beziehungen zwischen LH und Testosteron bereits in den 1960er Jahren bekannt waren, wurde die FSH-Abhängigkeit der Sertoli-Zellen erst 1984 durch Joanne M. Orth bewiesen.
Geschlechtsdifferenzierung
Die chromosomale Basis der Geschlechtsdifferenzierung wurde bereits zwischen 1910 und 1916, vor allem durch die Arbeiten von Thomas Hunt Morgan an Taufliegen aufgeklärt, wofür er 1933 den Nobelpreis für Physiologie oder Medizin bekam. Alfred Jost erkannte 1947, dass die Keimdrüsenanlage primär auf das weibliche Geschlecht determiniert ist und die Ausprägung des männlichen Geschlechts abhängig von Testosteron ist. Dennoch dauerte es bis in die frühen 1960er Jahre, bis das Y-Chromosom als maßgeblicher Faktor bei Säugetieren identifiziert wurde. Die genaue Lokalisation des Gens für den Hoden-determinierenden Faktor wurde erst 1990 ermittelt, seine vielfältigen Funktionen sind noch nicht im Detail bekannt und Gegenstand aktueller Forschung.[16]
Entwicklungsstörungen und Erkrankungen
Verletzungen des Hodens kommen beim Menschen als stumpfe Traumen vor allem bei Kampfsportarten und Schlägereien vor. Hier besteht die Gefahr der Einblutung unter die Hodenkapsel (Hämatozele), die in der Regel einer chirurgischen Versorgung bedarf. Verletzungen mit Eröffnung des Hodensacks (Stich- und Pfählungswunden, bei Tieren auch Bisse, Stacheldraht usw.) können Hodenentzündungen (s. u.) oder gar Abszesse verursachen, infolge der offenen Verbindung des Scheidenhautfortsatzes zur Bauchhöhle auch eine Bauchfellentzündung.
Fehlbildungen
Als Anorchie bezeichnet man das Fehlen beider Hoden, ist nur ein Hoden ausgebildet spricht man von einer Monorchie. Etwa 5 % der wegen eines ausbleibenden Hodenabstiegs operierten männlichen Kinder haben nur einen oder keinen Hoden. Bei ihnen findet man häufig kleine bindegewebige Knoten mit eingestreuten Leydig-Zellen. Da ein funktionell intakter Hoden für die männliche Geschlechtsausprägung zwingend erforderlich ist, muss in der Embryonalphase mindestens ein intakter Hoden vorgelegen haben, der sich dann später zurückentwickelt haben kann.
In seltenen Fällen können infolge von Entwicklungsstörungen auch beim Menschen und bei anderen Säugetieren neben Hoden gleichzeitig Eierstöcke auftreten (Hermaphroditismus verus – „echte“ Zwitter; siehe auch Intersexualität). Bei bestimmten Keimdrüsenfehlentwicklungen (Gonadendysgenesien) werden die Hoden nicht angelegt, bleiben unterentwickelt oder enthalten Eierstockgewebe (Ovotestis).
Eine sehr seltene Fehlentwicklung stellt die Splenogonadale Fusion mit einer Verbindung zwischen Hoden- und Milzgewebe dar.
Bei Störungen der Wanderung des Hodens (Maldescensus testis) können verschiedene Lageanomalien auftreten. Dabei kann der Hoden in der Bauchhöhle verbleiben (Kryptorchismus, „Bauchhoden“), im Leistenkanal stecken bleiben („Leistenhoden“, „Gleithoden“) oder eine falsche Route nehmen und beispielsweise unter der Haut der Leistengegend oder der Oberschenkelinnenseite zu liegen kommen (Hodenektopie). Der Maldescensus testis ist eine der häufigsten Fehlbildungen beim Menschen und tritt bei 3 bis 5 % der Neugeborenen und 33 % der Frühgeborenen auf,[28] auch bei Haustieren treten Kryptorchiden in ähnlicher Häufigkeit auf und führen zum Ausschluss von der Zucht. Bei falscher Position des Hodens können sich aufgrund der Temperaturempfindlichkeit des Keimepithels keine fruchtbaren Spermien bilden, die Androgenproduktion bleibt jedoch erhalten. Ein länger als zwei Jahre ausbleibender Hodenabstieg kann zum Verlust von Spermatogonien und damit zu unumkehrbaren Veränderungen des Hodens führen.
Erblich bedingter Kleinwuchs der Hoden (Hodenhypoplasie) ist bei Haustieren relativ häufig. Hodenhypoplasien können auch durch Chromosomenstörungen (Klinefelter-Syndrom), Infektionen oder hormonelle Störungen verursacht werden.
Eine abnormale Vergrößerung der Hoden wird als Makroorchidie bezeichnet.
Hodenentzündung
Eine Hodenentzündung (Orchitis) kann bei Verletzungen des Hodensacks mit Eindringen von Bakterien oder bei einigen Infektionskrankheiten auftreten. Eine Orchitis ist beim Menschen eine mögliche Komplikation bei Mumps, Coxsackie-Virus-Infektionen und Windpocken. Auch Brucellose und Tuberkulose können sich am Hoden manifestieren. Bei Tieren können ebenfalls Tuberkulose und Brucellose sowie die Pseudotuberkulose (Schafe), die Ansteckende Blutarmut der Einhufer und die feline infektiöse Anämie (Katzen) mit einer Orchiditis einhergehen. Hodenentzündungen können zu einer Schrumpfung des Hodens (Hodenatrophie) und zu Unfruchtbarkeit führen, weil gar keine (Aspermie) oder keine funktionstüchtigen Spermien mehr gebildet werden können.
Zirkulationsstörungen
Als Varikozele bezeichnet man krampfaderähnliche Erweiterungen, die vor allem die linksseitigen Venen des Plexus pampiniformis im Samenstrang betreffen. Eine Varikozele kann zu einer eingeschränkten Spermienbildung des gleichseitigen Hodens führen.
Als Hydrozele oder Wasserbruch wird die Ansammlung seröser Flüssigkeit in den Hodenhüllen bezeichnet. Daneben kann sich die Flüssigkeit auch im Samenstrang ansammeln, dieses wird dann als Hydrocele funiculi spermatici bezeichnet.
Eine Hodentorsion ist eine abnorme Drehung des Hodens, wobei die spiralförmige Abklemmung des Samenstranges und der abführenden Venen zu einem Absterben des Hodens führen kann. Eine hochgradige Hodentorsion ist ein sehr schmerzhafter Notfall, bereits nach zwei Stunden ist mit dauerhaften Schäden des Hodens zu rechnen. Auch der Appendix testis kann eine sogenannte Hydatidentorsion vollziehen.
Zirkulationsstörungen mit der Gefahr der Entstehung von Nekrosen werden auch bei Erkrankungen der Blutgefäße wie Purpura Schönlein-Henoch, Endangiitis obliterans und Panarteriitis nodosa des Menschen, Arteritis der Pferde sowie generell bei Thrombosen beobachtet.
Tumoren
Als Hodentumor wird eine krankhafte Vergrößerung des Hodens bezeichnet. Hodentumoren können gut- oder bösartig sein.
Zumeist harmlose Hodenvergrößerungen sind Zysten. Am Hoden können zwei verschiedene Zystenarten entstehen. Hydrozelen sind Aussackungen der Tunica vaginalis testis, die eine klare bernsteinfarbene Flüssigkeit enthalten. Sie entstehen durch Verletzungen oder Entzündungen. Spermatozelen gehen vom Rete testis oder dem Nebenhoden aus und enthalten Spermien. Teratome sind zumeist gutartige Tumoren der Keimzellen.
Eine sehr seltene Ursache einer Raumforderung am Hoden kann die Splenogonadale Fusion sein.
Bösartige Hodentumoren (Hodenkrebs) werden in Entartungen der Keimzellen (germinale Hodentumoren: Seminome) und Nichtseminome untergliedert. Entartungen der Keimzellen sind die häufigste Krebserkrankung bei Männern im Alter zwischen 20 und 40 Jahren und machen etwa 90 % aller Hodentumoren aus. Den Hauptrisikofaktor stellen nicht in den Hodensack gewanderte Hoden dar. Die verbleibenden 10 % entfallen auf tumoröse Entartungen anderer Gewebsanteile (Sertoli-Zell-Tumor, Leydig-Zell-Tumor, Non-Hodgkin-Lymphom u. a.).
Funktionsstörungen
Neben den oben genannten Krankheiten können auch die Blut-Hoden-Schranke überwindende chemische Substanzen wie Umweltgifte (z. B. Cadmium), Zusätze zu Verpackungsmitteln (z. B. Phthalate, Diethylhexyladipat), einige Arzneimittel (z. B. Furazolidon) und Hormone (s. a. Endokrine Disruptoren) oder ionisierende Strahlung zu schweren Beeinträchtigungen des Epithels der Samenkanälchen führen. Da die Spermienbildung mit sehr hohen Zellteilungsraten (Mitose, Meiose) einhergeht, ist das Keimepithel gegenüber Zellgiften besonders empfindlich. Solche Schädigungen können zu mannigfaltigen Veränderungen bis zum vollständigen Fehlen der Spermien führen (siehe auch Spermiogramm).
Eine unzureichende Bildung von Androgenen wird als Hypogonadismus bezeichnet. Dieser kann angeboren sein, durch Erkrankungen des Hodens sekundär entstehen oder in einem Gonadotropin-Mangel (z. B. Unterfunktion der Hypophyse, Olfaktogenitales Syndrom) begründet sein.
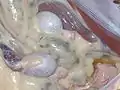 Abdominaler Kryptorchismus bei einem Hausschaf („Nierenbock“)
Abdominaler Kryptorchismus bei einem Hausschaf („Nierenbock“)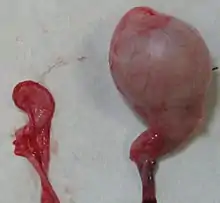 Hodenhypoplasie bei einer Katze, rechts im Bild der normal entwickelte Hoden.
Hodenhypoplasie bei einer Katze, rechts im Bild der normal entwickelte Hoden. Deutliche linksseitig ausgeprägte Varikozele.
Deutliche linksseitig ausgeprägte Varikozele.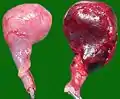 Nach Drehung entfernter Hundehoden (links: gesundes Organ)
Nach Drehung entfernter Hundehoden (links: gesundes Organ)
Untersuchung
Die Hodentastuntersuchung ist eine bei Mensch und Tieren mit Hodensack wichtige Grundlagenuntersuchung. Hier werden das Vorhandensein, Größe, Lage und Konsistenz des Hodens geprüft. Als bildgebendes Verfahren wird vor allem die Ultraschalluntersuchung angewendet. Die Bestimmung des Hodenvolumens erfolgt entweder durch Vergleich mit der sogenannten Prader-Kette oder mittels Ultraschallvermessung. Bei der Diagnostik der Hydrozele hat die Diaphanoskopie noch einen gewissen Stellenwert. Zur Entnahme von Gewebeproben kann eine Hodenbiopsie durchgeführt werden. Bei Tieren mit in der Bauchhöhle gelegenen Hoden wird neben der Ultraschalluntersuchung vor allem die Endoskopie eingesetzt.
Eine funktionelle Untersuchung ist die Erstellung eines Spermiogramms. Hier werden Anzahl, Gestalt und Beweglichkeit der Spermien beurteilt. Die Bestimmung des Gehalts von Inhibin B im Blut wird als Marker für die Sertoli-Zell-Funktion und Fruchtbarkeit genutzt, die Aussagekraft ist allerdings umstritten.
Zum Nachweis von mit bildgebenden Verfahren nicht nachweisbarem Hodengewebe kann der Leydig-Zell-Stimulationstest durchgeführt werden.[29]
Kastration

Als Kastration wird die Unterbindung der Hodenfunktion bezeichnet. Sie kann durch operative Entfernung des Hodens (Orchidektomie), Unterbindung der Hodengefäße („unblutige Kastration“), Bestrahlung oder chemische Substanzen erfolgen. Kastrationen werden beim Menschen vor allem bei Hodenkrebs durchgeführt. Chirurgisch entfernte Hoden werden aus kosmetischen Gründen meist durch eine Hodenprothese ersetzt.
Die Kastration spielt als Symbol der Entmachtung auch in der Mythologie vieler Kulturen eine Rolle (vgl. auch Kastrationsangst). In der ägyptischen Mythologie entreißt Horus seinem Kontrahenten Seth die Hoden. In der griechischen Mythologie entfernt erst Kronos seinem Vater Uranos die Hoden und wird später selbst von seinem Sohn Zeus entmannt. Zur Entsagung weltlicher Gelüste war die Selbstentmannung der Galloi (Priester) im Kybele-Kult der Phryger, der sich auch auf das antike Griechenland und Rom verbreitete, üblich, ebenso bei den Hijras in Indien. Im Judentum ist die Kastration, sowohl von Menschen als auch Tieren, dagegen strikt verboten. Im Christentum war die Kastration ebenfalls verpönt. Eunuchen durften nicht zum Priester geweiht werden, es gab jedoch Strömungen, in denen die Selbstkastration als Ritual vollzogen wurde (siehe Skopzen).
Historisch wurden auch Sklaven, Kriegsgefangene, Sänger oder die Bewacher von Harems (siehe Palasteunuch) kastriert. Die nichtmedizinisch begründete Kastration war insbesondere auf die Unterbindung der durch das Testosteron hervorgerufenen sekundären Geschlechtsmerkmale (Stimmlage, Sexualverhalten) gerichtet. Kastraten waren im europäischen Musikleben des 17. und 18. Jahrhunderts beliebt und genossen oft hohes Ansehen. Zu den berühmtesten Kastraten des 18. Jahrhunderts zählen Senesino, Farinelli, Caffarelli und Antonio Bernacchi.
Kastrierte Männer können sich nicht selbst fortpflanzen. Ähnlich wie freiwillig enthaltsam lebende Kleriker wurden sie als verlässlicher eingeschätzt und in verschiedenen Gesellschaften als Funktionäre und Diener eingesetzt.[30] Die freiwillige Kastration von Sexualstraftätern ist in Deutschland sowie in einigen Bundesstaaten der USA noch eine, wenn auch umstrittene, Therapiemethode.
In der Tiermedizin werden Kastrationen, neben medizinischen Indikationen (Hodenkrebs, Prostata- und Analdrüsenerkrankungen), vor allem zur Vermeidung von Nachwuchs, zur besseren Handhabbarkeit von Haustieren (Wallach, Ochse), zur Erhöhung der Mastleistung und Fleischqualität, bei Hausschweinen auch zur Vermeidung des „Ebergeruchs“ des Fleisches durchgeführt. Kastrationen bei Tieren wurden vermutlich bereits zu Beginn der Jungsteinzeit durchgeführt.[30] Die Kastration ist eine der wenigen nach dem Tierschutzgesetz (§ 6) in Deutschland heute noch erlaubten nichtmedizinisch indizierten Organentfernungen, bei sehr jungen Tieren sogar ohne Schmerzausschaltung, was allerdings nicht unumstritten ist.
Kulturgeschichtliche Bedeutung

In der Japanischen Mythologie werden Tanuki, dem Marderhund ähnliche Dämonen (Yōkai), als Glücksymbol häufig mit übergroßen Hoden dargestellt. Im antiken Griechenland wurden Genitalien von Tieren, insbesondere Stieren (Taurobolium), als Opfer dargebracht. Hoden galten als Symbol der Manneskraft und auch der schöpferischen Potenz. Nach Taylor[30] hatten sie bis in das späte 16. Jahrhundert noch eine stärkere Symbolkraft als der Penis.
Botanik

Den Pflanzen, die in ihrer Erscheinungsform männlichen Genitalien ähneln, wurde im Aberglauben eine aphrodisierende und fruchtbarkeitssteigernde Wirkung zugeschrieben. Aufgrund der Ähnlichkeit der beiden Wurzelknollen der Knabenkräuter mit den Hoden benannte sie der griechische Philosoph Theophrastos von Eresos Orchis, die griechische Bezeichnung für Hoden. Ihr Verzehr sollte angeblich der Geburt eines Knaben förderlich sein („Knabenkraut“). Orchis war später für die gesamte Familie der Orchideen namensgebend.
Der Name Avocado leitet sich von dem indianischen Wort ahuacatl (Hoden) ab, der auf die hodenähnliche Form der Frucht dieses Baumes Bezug nimmt.
In der Kunst
In der Kunst spielen Hoden, im Gegensatz zum Phallus, außerhalb der Erotik und Pornografie keine zentrale Rolle. „Blut und Hoden“,[31] ein phonologisches Wortspiel zur Blut-und-Boden-Ideologie, wird in der Kunstkritik häufig abwertend verwendet.
Eine der Figuren in Thomas Manns Tristan ist Herr Klöterjahn („Klöten“ ist der niederdeutsche Ausdruck für Hoden, ein Symbol für Lebenstüchtigkeit und Vitalität). Im 2002 erschienenen Roman Sanningen om Sascha Knisch (dt. Titel Die Wahrheit über Sascha Knisch. 2003) des schwedischen Autors Aris Fioretos sind die Hoden das Leitmotiv. Der deutsche Film Eierdiebe thematisiert das Thema Hodenkrebs und Verlust eines Hodens.

Das Wappen des italienischen Adelshauses Colleoni aus Bergamo zeigt mehrere Paar Hoden und stellt vermutlich eine Anspielung auf coglione, eine italienische Bezeichnung für Hoden, dar. Eine Statue des Bartolomeo Colleoni mit diesem Wappen am Sockel betet die Hauptfigur im ersten Band von Heinrich Manns Romandreiteiler Die Göttinnen oder Die drei Romane der Herzogin von Assy an.[32]
Als Lebensmittel

Hoden werden in vielen Regionen als Nahrungsmittel verarbeitet. Deutschland war das einzige Land in der EU, in dem Hoden als Lebensmittel verboten waren. Nach der EU-Verordnung Nr. 853/2004 vom 29. April 2004[33][34] gelten jedoch Hoden als einzige Geschlechtsorgane als Lebensmittel, alle anderen sind als ungeeignet zum Genuss (Konfiskate) eingestuft.
Sonstiges
- Der US-Amerikaner Gregg Miller erhielt für die Entwicklung von Hodenprothesen für kastrierte Hunde 2005 den Ig-Nobelpreis für Medizin.
- Volkswagen hatte im März 2006 in den USA den Golf GTI auf Plakaten mit „Turbo-Cojones“ beworben.[35][36][37] Im Englischen steht der Begriff Cojones übertragen für Mut und Kühnheit, im Spanischen, wo cojones für „Hoden“ und umgangssprachlich für „Schneid“ oder „Mut“ steht, bedeutet die Wortkombination aber wörtlich „Turbo-Hoden“. Nach Protesten wurde die Werbeaktion zurückgezogen.
- Die beutelförmigen, hühnereigroßen Drüsen (Kastorsäcke) unter dem Schambein des Bibers wurden früher auch als „Hoden“ bezeichnet.[38]
- Never Mind the Bollocks, Here’s the Sex Pistols, Lied und Covertitel eines Albums der englischen Punkband Sex Pistols aus 1977. Um den Begriff Bollocs Hoden wurde wegen Obszönität prozessirert.
Literatur
- A. J. P. van den Brock: Gonaden und Ausführungswege. In: Bolk u. a. (Hrsg.): Handbuch der vergleichenden Anatomie der Wirbeltiere. Band 6, Urban & Schwarzenberg, Berlin 1933, S. 1–154.
- W. Busch, A. Holzmann (Hrsg.): Veterinärmedizinische Andrologie. Schattauer, Stuttgart 2001, ISBN 3-7945-1955-8.
- U. Gille: Männliche Geschlechtsorgane. In: F.-V. Salomon u. a. (Hrsg.): Anatomie für die Tiermedizin. Enke, Stuttgart 2004, ISBN 3-8304-1007-7, S. 389–403.
- R. Hautmann, H. Huland: Urologie. Springer, Berlin 2006, ISBN 3-540-29923-8.
- H.-G. Liebich: Funktionelle Histologie der Haussäugetiere. 4. Auflage. Schattauer, Stuttgart 2003, ISBN 3-7945-2311-3.
- J. D. Neill (Hrsg.): Knobil and Neill’s Physiology of Reproduction. 3. Auflage. Academic Press, Amsterdam 2005, ISBN 0-12-515400-3.
- P. E. Petrides: Endokrine Funktionen IV. Hypothalamisch-hypophysäres System und Zielgewebe. In: G. Löffler, P. E. Petrides (Hrsg.): Biochemie und Pathobiochemie. 7. Auflage, Springer, Berlin 2003, ISBN 3-540-42295-1, S. 865–908.
- U.-N. Riede u. a.: Männliches Genitalsystem. In: U.-N. Riede u. a. (Hrsg.): Allgemeine und spezielle Pathologie. Thieme, Stuttgart 1989, ISBN 3-13-683302-3, S. 768–779.
- B. Vié: Testicules. Fête de paires, mythologie, les dessous, d’une curiosité culinaire, les attributs du sujet, lexique. Edition de l’Epure, Paris 2005, ISBN 2-914480-58-X (Zahlreiche Kochrezepte, angereichert mit kulturgeschichtlichen Informationen).
- R. Wehner, W. Gehring: Zoologie. 23. Auflage, Thieme, Stuttgart 1995, ISBN 3-13-367423-4.
- U. Welsch: Sobotta Lehrbuch Histologie. Urban & Fischer, München 2002, ISBN 3-437-42420-3.
Weblinks
Einzelnachweise
- Walther Graumann: CompactLehrbuch Anatomie. Band 3, Schattauer, Stuttgart 2004, ISBN 3-7945-2063-7, S. 265.
- H. Sosnik: Studies on the size of human male gonad in biomorphosis, alcohol intoxication, and cirrhosis–a review and own findings. In: Gegenbaurs Morphologisches Jahrbuch. Band 134, Nr. 5, 1988, S. 733–761, PMID 3224804.
- David A. E. Spalding: Whales of the West Coast. Harbour Publishing, 1999, ISBN 1-55017-199-2.
- I. Gerendai u. a.: Innervation and serotoninergic receptors of the testis interact with local action of interleukin-1beta on steroidogenesis. In: Autonomic Neuroscience. 7. Juli 2006, PMID 16829209.
- I. Ducic, A. L. Dellon: Testicular pain after inguinal hernia repair: an approach to resection of the genital branch of genitofemoral nerve. In: Journal of the American College of Surgeons. Band 198, Nr. 2, Februar 2004, S. 181–184, PMID 14759772.
- F. D. Brown u. a.: Bidder’s organ in the toad Bufo marinus: effects of orchidectomy on the morphology and expression of lamina-associated polypeptide 2. In: Development Growth and Differentiation. Band 44, Nr. 6, Dezember 2002, S. 527–535, PMID 12492511.
- C. F. Farias: Bidder’s organ of Bufo ictericus: a light and electron microscopy analysis. In: Micron. Band 33, Nr. 7–8, 2002, S. 673–679, PMID 12475564.
- G. Michel: Geschlechtssystem. In: F.-V. Salomon (Hrsg.): Lehrbuch der Geflügelanatomie. Fischer-Verlag, Stuttgart 1993, ISBN 3-334-60403-9, S. 197–226.
- R. P. Amann, S. S. Howards: Daily spermatozoal production and epididymal spermatozoal reserves of the human male. In: Journal of Urology. Band 124, Nr. 2, August 1980, S. 211–215, PMID 6772801.
- C. Petersen, O. Soder: The sertoli cell–a hormonal target and 'super' nurse for germ cells that determines testicular size. In: Hormone Research Band 66, Nr. 4, 2006, S. 153–161, PMID 16804315 (Volltext).
- M. Fijak, A. Meinhardt: The testis in immune privilege. In: Immunological Reviews. Band 213, Oktober 2006, S. 66–81, PMID 16972897.
- R. S. Swerdloff u. a.: Suppression of spermatogenesis in man induced by Nal-Glu gonadotropin releasing hormone antagonist and testosterone enanthate (TE) is maintained by TE alone. In: Journal of Clinical Endocrinology and Metabolism. Band 83, Nr. 10, Oktober 1998, S. 3527–3533, PMID 9768659.
- K. L. Matthiesson: Effects of testosterone and levonorgestrel combined with a 5alpha-reductase inhibitor or gonadotropin-releasing hormone antagonist on spermatogenesis and intratesticular steroid levels in normal men. In: The Journal of Clinical Endocrinology and Metabolism. Band 90, Nr. 10, Oktober 2005, S. 5647–5655, PMID 16030154.
- Peter Y. Liu u. a.: Determinants of the Rate and Extent of Spermatogenic Suppression during Hormonal Male Contraception: An Integrated Analysis. In: The Journal of Clinical Endocrinology and Metabolism. Band 93, Nr. 5, S. 1774–1783, doi:10.1210/jc.2007-2768.
- Improvac bei vetpharm.uzh.ch
- C. Tilmann, B. Capel: Cellular and Molecular Pathways Regulating Mammalian Sex Determination. In: Recent Progress in Hormone Research. Band 57, 2002, S. 1–18.
- C. Dournon u. a.: Temperature sex-reversal in amphibians and reptiles. In: International Journal of Dev Biology. Band 34, Heft 1. März 1990, S. 81–92. PMID 2393628
- E. Nieschlag u. a.: Reproductive functions in young fathers and grandfathers. In: Journal of Clinical Endocrinology and Metabolism. Band 55, 1982, S. 676–681.
- H. Bürgi, C. Hedinger: Histologische Hodenveränderungen im hohen Alter. In: Schweizerische medizinische Wochenschrift. Band 47, 1959, S. 1236–1239.
- A. von Kolliker: Beiträge zur Kenntnis der Geschlechtsverhältnisse und der Samenflüssigkeit wirbelloser Tiere, nebst einem Versuche über das Wesen und die Bedeutung der sogenannten Samentiere. Berlin 1841.
- A. H. J. La Valette St. George: Über die Genese der Samenkörper. In: Archiv für mikroskopische Anatomie. Band 12, 1876, S. 797–825.
- J. Brökelmann: Fine structure of germ cells and Sertoli cells during the cycle of the seminiferous epithelium in the rat. In: Zellforschung und mikroskopische Anatomie. Band 59, 1963, S. 820–850, PMID 14015736.
- P. J. Gardner, E. A. Holyoke: Fine structure of the seminiferous tubule of the Swiss mouse. I. The limiting membrane, Sertoli cell, spermatogonia, and spermatocytes. In: Anatomical Record. Band 150, Dezember 1964, S. 391–404, PMID 14248309.
- A. A. Berthold: Transplantation der Hoden. In: Archiv für Anatomie und Physiologie. Physiologische Abteilung. Band 16, 1849, S. 42–46.
- F. Mildenberger: Verjüngung und „Heilung“ der Homosexualität. Eugen Steinach in seiner Zeit. In: Sex-Forschung. Band 15, 2002, S. 302–322.
- P. Bouin, P. Ancel: Recherches sur les Cellules interstitielles du testicule chez les mammifères. In: Archives de zoologie expérimentale et générale. Serie 4, Band 1, 1903, S. 437–523.
- K. David u. a.: Über kristallinisches Hormon aus Hoden (Testosteron). In: Zeitschrift für Physiologische Chemie. Band 233, 1935, S. 281–282.
- A. Lampel: Kommentar. In: Aktuelle Urologie. Band 35, 2004, S. 6–8. (Volltext) (Memento vom 14. November 2007 im Internet Archive)
- Axel Wehrend: Leitsymptome Gynäkologie und Geburtshilfe beim Hund. Enke, Stuttgart 2010, ISBN 978-3-8304-1076-8, S. 57.
- G. Taylor: Castration: An Abbreviated History of Western Manhood. Routledge, 2002, ISBN 0-415-93881-3.
- W. Bittorf: Blut und Hoden. In: Der Spiegel. Nr. 44, 1976, S. 228–232 (online – 25. Oktober 1976).
- Peter Philipp Riedl: Epochenbilder--Künstlertypologien. Beiträge zu Traditionsentwürfen in Literatur und Wissenschaft 1860 bis 1930. Vittorio Klostermann, 2005, ISBN 3-465-03410-4, (S. 570).
- Verordnung (EG) Nr. 853/2004 des Europäischen Parlaments und des Rates vom 29. April 2004 mit spezifischen Hygienevorschriften für Lebensmittel tierischen Ursprungs
- Hygienevorschriften für Lebensmittel tierischen Ursprungs. Zusammenfassung der Gesetzgebung. In: EUR-Lex. Amt für Veröffentlichungen der Europäischen Union, abgerufen am 28. Oktober 2021.
- Miriam Jordan: Good Taste Lost In Ad Translation. Auf: articles.sun-sentinel.com vom 19. März 2006 (englisch).
- ‘Turbo-Cojones’, el eslogan de Volkswagen que molesta en EEUU. Auf: elmundo.es vom 21. März 2006 (spanisch).
- Photo des Plakats. Auf: secure.flickr.com vom 20. März 2006.
- Dieter Lehmann: Zwei wundärztliche Rezeptbücher des 15. Jahrhunderts vom Oberrhein. Teil I: Text und Glossar. Horst Wellm, Pattensen/ Han. 1985; jetzt (= Würzburger medizinhistorische Forschungen. Band 34). Königshausen & Neumann, Würzburg, ISBN 3-921456-63-0, S. 194.