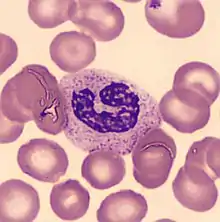
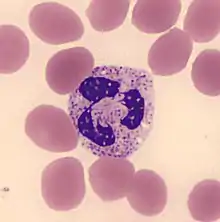
Neutrophiler Granulozyt
Neutrophile Granulozyten, auch polymorphkernige neutrophile Leukozyten (PMNL) und kurz Neutrophile genannt, sind spezialisierte Immunzellen der Wirbeltiere. Beim Menschen sind sie mit einem Anteil von 50–65 % die häufigsten weißen Blutkörperchen (Leukozyten). Sie sind Teil der angeborenen Immunabwehr und dienen der Identifizierung und Zerstörung von Mikroorganismen.
Drei Mechanismen sind bekannt, mit denen sie Mikroorganismen bekämpfen können. Als Phagozyten („Fresszellen“) können sie sie aufnehmen und verdauen. Außerdem enthalten die namengebenden Granula verschiedene Substanzen, etwa freie Radikale, Wasserstoffperoxid und Stickstoffmonoxid, die freigesetzt werden können und dann Mikroorganismen abtöten. Schließlich können Neutrophile in einem Vorgang, der als NETose bezeichnet wird, sogenannte „Neutrophile Extracellular Traps“ (englisch für neutrophile außerzelluläre Fallen, abgekürzt NETs) bilden. Diese Strukturen aus Chromatin können manche Mikroorganismen binden und dadurch unschädlich machen.[1]
Erklärung und Herkunft des Namens
Der Namensbestandteil „Granulozyt“ bezieht sich auf zahlreiche Granula (Vesikel) im Cytoplasma die hier ebenso wie bei Eosinophilen und Basophilen Granulozyten auftreten.
Die drei Zelltypen unterscheiden sich in ihrem Färbeverhalten bei der Pappenheim-Färbung: Während die Granula der Eosinophilen (lateinisch „Eosin liebend“) durch den sauren Farbstoff Eosin rot bis orange erscheint und die Granula von Basophilen durch basische Farbstoffe dunkelviolett gefärbt wird, nehmen die Granula der Neutrophilen einen dazwischen liegenden hellvioletten Farbton an, da sie von sauren und basischen Stoffen schwach gefärbt werden. Es kommen hier jedoch keine neutralen (ungeladenen) Farbstoffe zur Anwendung.[2][3]
Der Namensbestandteil „neutrophil“ leitet sich auch nicht von der Pappenheim-Färbung ab: Diese wurde erst 1908 vorgestellt.[4] „Neutrophile Granulationen“ in „Leukocyten mit polymorphem Kern“ wurden aber schon früher beschrieben, etwa in einem Histologie-Lehrbuch von 1906.[5]
Die Bezeichnung „neutrophil“ geht zurück auf Paul Ehrlich, der 1880 den Begriff „neutrophile oder ε-Körnung“ einführte.[6] Schon in vorigen Arbeiten hatte er verschiedene Körnungen oder Granulationen beschrieben, und diese „in Ermangelung einer rationellen Systematik“ nach dem griechischen Alphabet bezeichnet. Wichtigstes Unterscheidungsmerkmal war ihm die unterschiedliche Anfärbbarkeit: α-Granulation war eosinophil, ließ sich aber nicht durch basische Farbstoffe darstellen. Das umgekehrte Verhalten zeigte „γ-Granulation“, also basophile Granula, die er in Mastzellen fand. Bei der Untersuchung normalen menschlichen Blutes stellte er fest, das „constant eine gewisse nicht bedeutende Anzahl eosinophiler Zellen führte“, Zellen mit basophiler Granula jedoch nicht vorkamen. (Tatsächlich ist heute bekannt, dass basophile Granulozyten sehr selten sind.)[6]
Die meisten Leukozyten zeigten in Ehrlichs Versuchen jedoch keine mit basischen oder sauren Farbstoffen darstellbare Granula. Er versuchte daher Färbungen mit „neutralen Pigmenten“, die er durch Mischung von sauren und basischen Farbstoffen gewann. Dazu empfahl er eine Lösung so hergestellt, „... dass man zu 5 Volumen einer gesättigten Säurefuchsinlösung allmälig unter Umschütteln 1 Volumen einer starken Methylenblaulösung und sodann noch weitere 5 Volumen destillirten Wassers zusetzt, einige Tage stehen lässt und dann filtrirt“. Angewandt auf Blutausstriche beobachtete er in der bei weitem überwiegenden Mehrzahl der Leukozyten eine „ausserordentlch dichte, violett gefärbte Körnung“ im Cytoplasma, aber nicht im Zellkern. Er beobachtete auch, dass diese Zellen „polymorphe Kernfiguren“ oder mehrere kleine, stark färbbare Zellkerne hatten, wogegen die andere, meist kleiner Gruppe der Leukozyten einen großen, plumpen, ovoiden, schwach färbbaren Kern hatte und wenig Cytoplasma. Neben den „polynucleären“ (= vielkernigen) neutrophilen Granulozyten hat er also nur eine weitere größere Gruppe unterschieden, die „mononucleären“, die nach heutigem Verständnis die Lymphozyten und die Makrophagen beinhalten.[6]
Da er auch Zellen beobachtete, denen er eine Mittelstellung oder eine Übergangsform zwischen den beiden Gruppen zusprach, nahm er an, „dass die polynucleären Zellen durch eine progressive Metamorphose der mononucleären Elemente entstehen“.[6] Dies ist jedoch, wie heute bekannt ist, nicht der Fall.
Struktur
Neutrophile sind kugelförmige Zellen mit einem Durchmesser von 9 bis 15 µm (Mikrometer). Charakteristisch für ausgereifte Neutrophile ist der aus drei bis fünf Segmenten bestehende Kern. Das Cytoplasma von Neutrophilen enthält zwei Arten von Granula: Die „spezifischen“ Granula, die auch als sekundäre Granula bezeichnet werden, enthalten Enzyme wie Lysozym, Kollagenase, Laktoferrin, Elastase, Plasminogenaktivatoren, Neuraminidase und Cathepsin G. Diese Granula lassen sich nicht mit basischen und sauren Farbstoffen färben, was sie ebenfalls in namensgebender Weise von Basophilen und Eosinophilen unterscheidet. Die „azurophilen“ Granula entsprechen den Lysosomen und werden auch primäre oder unspezifische Granula genannt. Sie enthalten, neben Bestandteilen wie sauren Hydrolasen und antimikrobiellen Enzymen, auch Substanzen wie Defensine, Myeloperoxidase, und Cathelicidine, wodurch sie wirksam gegen einige Bakterien, Viren und Pilze vorgehen können.
Bei Kaninchen, Meerschweinchen, Chinchillas und Frettchen sind die Neutrophilengranula azidophil und färben sich mit dem Farbstoff Eosin an, so dass man hier auch von Pseudo-Eosinophilen oder Heterophilen spricht.[7]
Reifung
Ein erwachsener Mensch produziert mehr als 1011 (Hundert Milliarden) Neutrophile pro Tag. Sie werden im Knochenmark gebildet. Junge Neutrophile weisen einen stabförmigen Kern auf, weshalb sie als Stabkernige bezeichnet werden; analog dazu werden ausgereifte Neutrophile mit ihren drei bis fünf Kernsegmenten als Segmentkernige bezeichnet. Sollten Neutrophile innerhalb von 6 bis 8 Stunden nach Eintritt in die Blutbahn nicht in Kontakt mit Infektionen und/oder Entzündungsreaktionen kommen, verlassen sie die Blutbahn, erfahren einen programmierten Zelltod (Apoptose) und werden durch Makrophagen in Leber oder Milz abgebaut. Neutrophile haben im Allgemeinen eine Lebensdauer von einem Tag bis vier Tagen.
Funktion
Neutrophile zirkulieren im Blut und wandern im Falle einer Infektion am Ort des Geschehens aus der Blutbahn in das Gewebe aus. Dies gilt in gleichem Maße für Monozyten. Dort nehmen sie die infektionsauslösenden Mikroben auf und verdauen sie. Um infiziertes und/oder entzündetes Gewebe zu erreichen, verlassen beide in einem durch Adhäsionsmoleküle und Chemokine (lösliche „Lockstoffe“) vermittelten mehrstufigen Prozess den Blutstrom und dessen Gefäße. Dabei wandern sie durch die Interzellular-Räume der endothelialen Zellen in postkapillaren Venolen. Der Vorgang der Rekrutierung von Neutrophilen und Monozyten zum Infektionsherd lässt sich in vier Schritte unterteilen:
- Selectin-vermitteltes „Entlang“-Rollen am Gefäß-Endothelium: Makrophagen, die vor Ort Mikroben verdaut haben, schütten Cytokine wie Interleukin-1 (IL-1) und Tumornekrosefaktor (TNF) aus. Diese induzieren bei in der Nähe liegenden Endothelzellen[8] die Zunahme von Selectinen (P-Selectin und E-Selectin) auf der Oberfläche. Neutrophile und Monozyten besitzen auf ihrer Oberfläche das L-Selectin als Adhäsionsmolekül und die für P- und E-Selectin spezifischen Kohlenhydrat-Liganden. Die entstehenden Selectin-Selectin-Interaktionen sind sehr schwach und werden durch die Scherkräfte des Blutstroms unterbrochen. Das führt zu einem langsameren „Entlang“-Rollen von Neutrophilen und Monozyten auf dem Endothelium, indem sie sich permanent an die Oberfläche binden und wieder lösen.
- Chemokin-vermittelte Verstärkung der Integrin-Affinität: Ausgeschüttete Cytokine wie IL-1 und TNF induzieren in Makrophagen, endothelialen und anderen Zelltypen die Produktion von Chemokinen. Sie werden an der Oberfläche des Epithel-Lumen gebunden und dadurch konzentriert. „Vorbei“-rollende Neutrophile und Makrophagen erkennen diese mit spezifischen Chemokin-Rezeptoren. Dies führt dazu, dass Integrine auf deren Oberfläche von einer geringen Affinität zu einer hohen Affinität wechseln. Zusätzlich lagern sich diese Integrine zusammen und führen zu einer stärkeren Bindung an die Endothel-Oberfläche und ein verlangsamtes „Rollen“.
- Stabile Integrin-vermittelte Adhäsion an das Endothelium: Parallel zur Integrin-Affinitätsänderung auf Neutrophilen und Monozyten werden auf deren Zelloberfläche Liganden wie VCAM-1 (engl. vascular cell adhesion molecule-1) und ICAM-1 (engl. intercellular adhesion molecule-1) exprimiert, die an Integrine des Endothels binden. Auch diese Liganden-Produktion wird durch Chemokine induziert. Zusammen mit den in 2. beschriebenen Effekten führt dies zu einer festen Bindung an das Endothelium. Hierdurch finden Umlagerungen des Cytoskeletts statt, und die Leukozyten positionieren sich abgeflacht auf dem Endothelium.
- Durchwanderung des endothelialen Gewebes: Neutrophile und Monozyten folgen nun den Konzentrationsgradienten der lokalen Chemokine und wandern zwischen den endothelialen Zellen zum infizierten Gewebe. Für diesen Vorgang werden Teile der extrazellulären Matrix (EZM) der Endothelzellen aufgelöst, um genügend Freiraum für die durchwandernden Leukozyten zu bieten. Diese schütten hierfür ihre spezifischen Granula aus, deren Proteasen die Auflösung ermöglichen.

Durch diese Prozesse akkumulieren Neutrophile und Monozyten am Infektionsort, wodurch die Hauptkomponente einer Entzündung gegeben ist. Durch zeitliche Unterschiede der induzierten Chemokin-Rezeptor- und Integrin-Expression werden innerhalb von Stunden bis Tagen zuerst Neutrophile zum Infektionsort rekrutiert, innerhalb von Tagen bis Wochen erst Monozyten. Bei einer Infektion steigt im Blut die Konzentration von Neutrophilen an (Neutrophilie), was durch eine Zunahme von „Stabkernigen“ (ein Merkmal junger Neutrophiler) eine gesteigerte Neubildung beweist. Am Infektionsort angekommen, werden Mikroben durch Neutrophile und Makrophagen aufgenommen und zerstört, ein Prozess, der Phagozytose genannt wird.
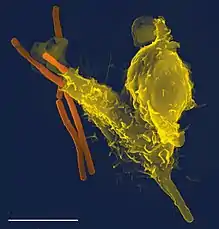
Neutrophile Granulozyten haben zudem die Fähigkeit, Bakterien mittels einer freigesetzten fibrillären Matrix aus Granula-Proteinen und Chromatin zu binden. Dies verhindert einerseits die weitere Verbreitung von Bakterien und fördert andererseits das Zerstören der dort festgesetzten Bakterien.[9] Diese Netze werden engl. „Neutrophil Extracellular Traps“ (NETs) bezeichnet. Dieser Vorgang wird in Anlehnung an die beiden anderen Zelltodarten Nekrose und Apoptose in der deutschen Literatur zunehmend als Netose bezeichnet[10] und stellt somit eine der drei Formen des Zelltodes dar. Bakterien, die DNAse produzieren, können sich dem Abwehrmechanismus durch Schneiden der fibrillären Matrix entsprechend entziehen.
NETs – Neutrophil Extracellular Traps
Neutrophil Extracellular Traps, abgekürzt NETs (zu Deutsch neutrophile extrazelluläre Fallen, wobei die Abkürzung NET als Wort auch an Netz erinnert) sind Netzwerke extrazellulärer Fasern, die Pathogene binden und hauptsächlich aus der DNA neutrophiler Granulozyten bestehen.[9]
Es ist lange bekannt, dass neutrophile Granulozyten, die an vorderster Front gegen Infektionen kämpfen, zwei unterschiedliche Strategien haben, um eindringende Pathogene zu bekämpfen: Phagozytose der Mikroben oder Sekretion antimikrobieller Substanzen in die Umgebung. Im Jahr 2004 wurde die Bildung von NETs als neuer Mechanismus beschrieben. Dabei töten Neutrophile extrazelluläre Pathogene und schädigen dabei körpereigene Zellen nur minimal. Bei einer In-vitro-Aktivierung mit Phorbol Myristat Acetat (PMA), Interleukin-8 (IL-8) oder Lipopolysaccharid (LPS) werfen Neutrophile granuläre Proteine und Chromatin aus, um durch einen aktiven Prozess eine extrazelluläre, faserige Matrix zu bilden, die NETs.[9] NETs machen Pathogene durch antimikrobielle Proteine, die an die nukleäre DNA gebunden sind, wie neutrophile Elastase und Histone, unschädlich. Analysen mittels Immunfluoreszenz bestätigten, dass NET-Proteine azurophiler Granula wie neutrophile Elastase, Cathepsin G und Myeloperoxidase enthalten. Außerdem sind Proteine spezifischer Granula, wie Laktoferrin, tertiäre Granula, wie Gelatinase, jedoch kein CD63, Aktin, Tubulin und auch keine anderen zytoplasmatischen Proteine enthalten. NETs sorgen für eine hohe, lokale Konzentration antimikrobieller Substanzen. Sie binden, immobilisieren und töten Mikroben extrazellulär. Der Prozess ist unabhängig von der Aufnahme durch Phagozytose. Zusätzlich zu ihren antimikrobiellen Eigenschaften scheinen NETs eine physikalische Barriere darzustellen, die eine weitere Verbreitung des Pathogens verhindert. Außerdem hindert die Immobilisierung granulärer Proteine durch die NETs potentiell schädliche Proteine, wie Proteasen, in ihrer Ausbreitung. Dies reduziert den Schaden in den Geweben, die an das Gebiet der Inflammation angrenzen. Aufnahmen mittels hochauflösender Elektronenmikroskopie zeigten, dass NETs aus DNA-Strängen und globulären Proteindomänen mit einem Durchmesser von 15–17 nm und von 25 nm bestehen. Diese verbinden sich zu größeren Strukturen mit einem Durchmesser von 50 nm. Allerdings können NETs im Blutstrom auch viel größere Strukturen bilden, die mehrere hundert Nanometer lang und breit werden können.[11] Da NETs in den Blutgefäßen den Blutfluss stören könnten, läuft die NETose in Plasma und Serum deutlich schwächer ab.
Es wurde gezeigt, dass nicht nur Bakterien, sondern auch pathogene Pilze wie Candida albicans Neutrophile zur NETose veranlassen und sowohl die hyphalen als auch die hefeförmigen Zellen einfangen und töten.[12] Auch im Zusammenhang mit Plasmodium-falciparum-Infektionen bei Kindern wurde die Bildung von NETs dokumentiert.[13]
NETs könnten auch eine schädliche Wirkung auf den Organismus haben, weil die Exposition extrazellulärer Histonkomplexe zur Entwicklung von Autoimmunkrankheiten, wie Lupus erythematodes beitragen könnten.[14] NETs können auch an inflammatorischen Krankheiten beteiligt sein. So fand man NETs bei Patienten mit Präeklampsie, einer inflammatorischen Erkrankung in der Schwangerschaft, von der bekannt war, dass Neutrophile aktiviert sind.[15] Auch bei Kindern mit Malaria konnte die Beteiligung von NETs an der Induktion der antinukleären Antikörper nachgewiesen werden.[13]
Während man ursprünglich davon ausgegangen war, dass NETs im Gewebe in Verbindung mit bakterieller oder Pilzinfektion gebildet werden, wurde gezeigt, dass NETs während einer Sepsis auch in den Blutgefäßen, besonders den Lungenkapillaren und den Lebersinusoiden, gebildet werden können. Intravaskuläre NET-Bildung ist stark kontrolliert und wird durch Thrombozyten reguliert, die gefährliche Infektionen mittels TLR4 erkennen, dann an Neutrophile binden und die Bildung von NETs aktivieren. Thrombozyten-induzierte NETose verläuft sehr schnell (innerhalb von Minuten), und die Neutrophilen überleben. NETs, die in Blutgefäßen gebildet werden, können Bakterien im Blutstrom immobilisieren. Das Einfangen der Bakterien konnte direkt in Fließkammern in vitro gezeigt werden, und intravitale Mikroskopie ergab, dass die Bakterien in den Lebersinusoiden und den Lungenkapillaren zu finden sind (Orte an denen Blutplättchen Neutrophile binden).[11]
Diese Beobachtungen lassen vermuten, dass NETs eine wichtige Rolle in der Pathogenese infektiöser, inflammatorischer und thrombotischer Erkrankungen spielen.[16][17][18]
Primäre Erkrankungen
Die septische Granulomatose führt trotz einer funktionsfähigen Wanderung zum Infektionsort und der Aufnahme von Mikroben bei Neutrophilen zu einem Defekt im Abbau, dem „Verdau“. Somit stehen Neutrophile als Teil der Immunantwort nicht mehr zur Verfügung, wodurch Infektionen einen kritischen Verlauf nehmen können.
Siehe auch
Literatur
- Abul K. Abbas, Andrew H. Lichtman, Shiv Pillai: Cellular and Molecular Immunology. 6. Auflage. Saunders Elsevier, Philadelphia 2007. ISBN 0-7216-0008-5
- S. Massberg et al.: Reciprocal coupling of coagulation and innate immunity via neutrophil serine proteases. In: Nature PG / Nature Medicine, 16, 1. August 2010, S. 887–896, doi:10.1038/nm.2184. „also implicated in thrombotic processes“. (englisch)
Weblinks
- Video: Neutrophile Granulozyten - Homo sapiens. Institut für den Wissenschaftlichen Film (IWF) 1961, zur Verfügung gestellt von der Technischen Informationsbibliothek (TIB), doi:10.3203/IWF/E-402.
Einzelnachweise
- B. Amulic, C. Cazalet, G. L. Hayes, K. D. Metzler, A. Zychlinsky: Neutrophil function: from mechanisms to disease. In: Annual Review of Immunology. Band 30, 2012, S. 459–489, ISSN 1545-3278. doi:10.1146/annurev-immunol-020711-074942. PMID 22224774. (Review).
- Ulrich Welsch, Wolfgang Kummer: Lehrbuch Histologie, 4. Aufl. 2014, Urban & Fischer, München, S. 211
- Maria Mulisch, Ulrich Welsch (Hrsg.): Romeis Mikroskopische Techniken. 18. Auflage. Spektrum Akademischer Verlag, Heidelberg 2010, ISBN 978-3-8274-1676-6, S. 274 - 276.
- Pappenheim, A. (1908): Panoptische Universalfärbung für Blutpräparate. Medizinische Klinik, Nr. 32: 1244 - 1245. Zitiert nach: Ricarda Dinser: Der Beitrag Artur Pappenheims zur Hämatologie um die Jahrhundertwende, Dissertation, 2001 (PDF-Datei; 2,16 MB)
- Philipp Stöhr: Lehrbuch der Histologie und der mikroskopischen Anatomie des Menschen mit Einschluss der mikroskopischen Technik. 12. Auflage. Verlag von Gustav Fischer, Jena 1906, S. 116 und 133–134.
- P. Ehrlich: Methodologische Beiträge zu Physiologie und Pathologie der verschiedenen Formen der Leukocyten. In: Zeitrischft für klinische Medizin. Band 1, 1880, S. 553–560.
- Jutta Hein: Blutentnahme und -untersuchung bei Kleinsäugern. In: Kleintierpraxis 56 (2011), S. 482–494.
- Lichtman, Andrew H., Pillai, Shiv, Preceded by: Abbas, Abul K.: Cellular and molecular immunology. Hrsg.: Abul K. Abbas. Ninth edition Auflage. Elsevier, Philadelphia, PA 2018, ISBN 978-0-323-52323-3, S. 608.
- V. Brinkmann, U. Reichard, C. Goosmann, B. Fauler, Y. Uhlemann, D. S. Weiss, Y. Weinrauch, A. Zychlinsky: Neutrophil extracellular traps kill bacteria. In: Science Band 303, Nummer 5663, März 2004, S. 1532–1535, ISSN 1095-9203. doi:10.1126/science.1092385. PMID 15001782.
- Unbekannte Waffe unseres Imunsystems entdeckt (Memento vom 16. Oktober 2014 im Internet Archive)[], max-wissen.de
- S. R. Clark, A. C. Ma, S. A. Tavener, B. McDonald, Z. Goodarzi, M. M. Kelly, K. D. Patel, S. Chakrabarti, E. McAvoy, G. D. Sinclair, E. M. Keys, E. Allen-Vercoe, R. Devinney, C. J. Doig, F. H. Green, P. Kubes: Platelet TLR4 activates neutrophil extracellular traps to ensnare bacteria in septic blood. In: Nature Medicine. Band 13, Nummer 4, April 2007, S. 463–469, ISSN 1078-8956. doi:10.1038/nm1565. PMID 17384648.
- C. F. Urban, U. Reichard, V. Brinkmann, A. Zychlinsky: Neutrophil extracellular traps capture and kill Candida albicans yeast and hyphal forms. In: Cellular microbiology. Band 8, Nummer 4, April 2006, S. 668–676, ISSN 1462-5814. doi:10.1111/j.1462-5822.2005.00659.x. PMID 16548892.
- V. S. Baker, G. E. Imade, N. B. Molta, P. Tawde, S. D. Pam, M. O. Obadofin, S. A. Sagay, D. Z. Egah, D. Iya, B. B. Afolabi, M. Baker, K. Ford, R. Ford, K. H. Roux, T. C. Keller: Cytokine-associated neutrophil extracellular traps and antinuclear antibodies in Plasmodium falciparum infected children under six years of age. In: Malaria Journal. Band 7, 2008, S. 41, ISSN 1475-2875. doi:10.1186/1475-2875-7-41. PMID 18312656. PMC 2275287 (freier Volltext).
- A. Hakkim, B. G. Fürnrohr, K. Amann, B. Laube, U. A. Abed, V. Brinkmann, M. Herrmann, R. E. Voll, A. Zychlinsky: Impairment of neutrophil extracellular trap degradation is associated with lupus nephritis. In: Proceedings of the National Academy of Sciences. Band 107, Nummer 21, Mai 2010, S. 9813–9818, ISSN 1091-6490. doi:10.1073/pnas.0909927107. PMID 20439745. PMC 2906830 (freier Volltext).
- A. K. Gupta, P. Hasler, W. Holzgreve, S. Gebhardt, S. Hahn: Induction of neutrophil extracellular DNA lattices by placental microparticles and IL-8 and their presence in preeclampsia. In: Human immunology. Band 66, Nummer 11, November 2005, S. 1146–1154, ISSN 0198-8859. doi:10.1016/j.humimm.2005.11.003. PMID 16571415.
- T. A. Fuchs, A. Brill, D. Duerschmied, D. Schatzberg, M. Monestier, D. D. Myers, S. K. Wrobleski, T. W. Wakefield, J. H. Hartwig, D. D. Wagner: Extracellular DNA traps promote thrombosis. In: Proceedings of the National Academy of Sciences. Band 107, Nummer 36, September 2010, S. 15880–15885, ISSN 1091-6490. doi:10.1073/pnas.1005743107. PMID 20798043. PMC 2936604 (freier Volltext).
- A. Brill, T. A. Fuchs, A. S. Savchenko, G. M. Thomas, K. Martinod, S. F. De Meyer, A. A. Bhandari, D. D. Wagner: Neutrophil extracellular traps promote deep vein thrombosis in mice. In: Journal of thrombosis and haemostasis: JTH. Band 10, Nummer 1, Januar 2012, S. 136–144, ISSN 1538-7836. doi:10.1111/j.1538-7836.2011.04544.x. PMID 22044575. PMC 3319651 (freier Volltext).
- J. I. Borissoff, H. ten Cate: From neutrophil extracellular traps release to thrombosis: an overshooting host-defense mechanism? In: Journal of thrombosis and haemostasis: JTH. Band 9, Nummer 9, September 2011, S. 1791–1794, ISSN 1538-7836. doi:10.1111/j.1538-7836.2011.04425.x. PMID 21718435.