Glykoproteine
Glykoproteine oder Glycoproteine sind Makromoleküle, die aus einem Protein und einer oder mehreren kovalent gebundenen Kohlenhydratgruppen (Zuckergruppen) bestehen. Die Kohlenhydratgruppen werden gewöhnlich als posttranslationale Modifikation an Asparagin-, Serin-, Threonin- oder Hydroxylysin-Resten kovalent gebunden. Dieser Vorgang heißt Glykosylierung (Anlagerung von Zuckern). Die gebundenen Kohlenhydratreste variieren stark in ihrer Größe und reichen von Monosacchariden über Di- und Oligosaccharide bis zu Polysacchariden. Der Kohlenhydratanteil in Glykoproteinen kann wenige Prozent (Ribonukleasen, Thyreoglobulin) bis zu 85 Prozent (Blutgruppenantigene) betragen.
Eigenschaften
Im Organismus können Glykoproteine zahlreiche Funktionen erfüllen. Sie dienen als strukturelle Bestandteile (Strukturproteine) von Zellmembranen, als Gleitmittel (z. B. als Bestandteil von Schleim) und zur Zellinteraktion (Membranproteine). Außerdem gehören manche Hormone (z. B. Thyreotropin, hCG) und Bestandteile des Immunsystems (Immunglobuline, Interferone) zu den Glykoproteinen. Kleine Glykoproteine werden auch als Glykopeptide bezeichnet.
Glykoproteine sind in der Natur weit verbreitet und man nimmt an, dass es wahrscheinlich mehr Proteine mit kovalent gebundenen Kohlenhydraten als Kohlenhydrat-freie Proteine gibt. Zuckerreste können bei der Proteinfaltung helfen bzw. die Stabilität der Proteine erhöhen. Häufig tragen Proteine, die in den extrazellulären Raum ragen (Transmembranproteine) oder extrazelluläre Funktionen wahrnehmen, Kohlenhydratreste. Alle Exportproteine sowie Membranproteine sind oder waren während ihrer Biosynthese Glykoproteine. Glykoproteine spielen daher auch eine wichtige Rolle bei Erkennungsreaktionen durch das Immunsystem, besonders in Säugetieren. Beispiele hierfür sind Antikörper und die Proteine des MHC, die mit T-Zellen bzw. T-Zell-Rezeptoren interagieren.
Lösungen von Glykoproteinen sind häufig sehr viskos. Im menschlichen Blutplasma wurden viele verschiedene Plasmaproteine isoliert, von denen lediglich Albumin und Präalbumin keine Zuckerreste haben.
Vorkommende Kohlenhydrate
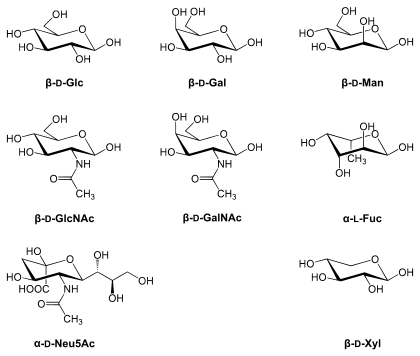
In menschlichen Glykoproteinen spielen nur acht Zucker eine bedeutende Rolle. Diese sind
- L-Fucose (Fuc) (Fucosylierung),
- D-Galactose (Gal),
- D-Mannose (Man),
- D-Glucose (Glc),
- D-Xylose (Xyl),
- D-N-Acetylglucosamin (GlcNAc),
- D-N-Acetylgalactosamin (GalNAc),
- D-N-Acetylneuraminsäure (Neu5Ac) findet sich hauptsächlich am Ende der Oligosaccharidketten, üblicherweise gebunden an Galactose oder N-Acetylgalactosamin.
Während der Synthese von Glykoproteinen werden die Zucker zumeist von Nukleotiden gewonnen.
Häufig enthalten Glykoproteine auch Sulfate, die normalerweise an Galactose, N-Acetylgalactosamin oder N-Acetylglucosamin gebunden sind.
Bindung
Die Bindung der Oligosaccharide an das Protein kann auf verschiedene Arten erfolgen.
N-glykosidische Bindung
Hier erfolgt die Bindung des Zuckers an den Stickstoff der freien Säureamidgruppe von Asparagin (N im Ein-Buchstaben-Code der Aminosäuren). Die N-Glykosylierung wird im Endoplasmatischen Retikulum (ER) durchgeführt. N-Glykoside stellen die bedeutendste Gruppe der Glykoproteine dar, und eine Vielzahl der Plasmaproteine, aber auch membrangebundene Proteine zählen dazu.
Typisch für die N-Glykosylierung ist die Synthese einer von der Aminosäuresequenz des Zielproteins unabhängig gebildeten Zucker-Vorstufe an dem Trägermolekül Dolichol, das in der Membran des ER vorliegt. Dolichol ist ein Isoprenoid aus 10–20 Isopren-Einheiten, das am Ende eine OH-Gruppe trägt, die wiederum mit einem Diphosphat verknüpft ist. Die Oligosaccharid-Vorstufe wird am terminalen Phosphatrest gebildet und besteht aus 14 Hexosen, deren Abfolge unter allen Eukaryoten evolutionär konserviert ist. Die ersten sieben Zucker werden auf cytosolischer Seite zusammengebaut: zuerst werden zwei N-Acetyl-Glucosamine an das Dolichol-Phosphat angehängt, dann fünf Mannose-Reste. Als Donoren wurden die Zucker-Nukleotide UDP-N-Acetyl-Glucosamin und GDP-Mannose identifiziert. Die Vorstufe aus sieben Zuckern wird durch ein Transportprotein aus der Gruppe der Phospholipidtranslokatoren (Flippasen) durch die ER-Membran gebracht, sodass sie jetzt zur ER-Innenseite orientiert ist. Vier Mannose-Reste werden der Struktur hinzugefügt, danach drei Glucose-Reste. Die Monosaccharide für diesen letzten Schritt stammen ebenfalls von einem Dolichol-Phosphat. Die Vorstufe aus 14 Zuckern kann nun auf ein geeignetes Protein übertragen werden. Die minimale Glykolysierungssequenz ist dabei -Asn-X-Ser/Thr- (X=beliebige Aminosäure außer Prolin).
N-glykosidisch gebundene Glykoproteine werden nach dem Anteil der enthaltenen Monosaccharide in drei Gruppen unterschieden: mannosereicher Typ (High-Mannose), komplexer Typ (Complex) und Hybrid. Der mannosereiche Typ zeichnet sich durch einen überwiegenden Anteil an Mannose-Resten aus, Saccharide vom komplexen Typ können jedes andere Saccharid neben Mannose enthalten. Hybrid bezeichnet eine Mischform aus beiden Typen.
O-glykosidische Bindung
Hier erfolgt die Bindung des Zuckers an die Hydroxygruppe von Serin, Threonin, Hydroxyprolin oder Hydroxylysin. Die O-Glykosylierung erfolgt im Golgi-Apparat.
Membranproteine
Die Zuckerreste von Membranproteinen sind ausschließlich zur extrazellulären Membranseite orientiert und bilden die Glykokalyx. Der Grad der Glykosylierung von Membranproteinen schwankt von Zelltyp zu Zelltyp; pro Glykoprotein können ein bis zu einige hundert Zuckerreste vorkommen.
Tierische Membranen sind mit durchschnittlich drei Prozent (w/w) relativ wenig glykosyliert. Dagegen enthalten pflanzliche Membranen bis zu zwanzig Prozent (w/w) Zuckerreste, die überwiegend an Membranproteine gebunden sind (der Rest an Lipide).
Siehe auch
Literatur
- Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Biochemie. 6 Auflage, Spektrum Akademischer Verlag, Heidelberg 2007. ISBN 978-3-8274-1800-5.
- Donald Voet, Judith G. Voet: Biochemistry. 3. Auflage, John Wiley & Sons, New York 2004. ISBN 0-471-19350-X.
- Bruce Alberts, Alexander Johnson, Peter Walter, Julian Lewis, Martin Raff, Keith Roberts: Molecular Biology of the Cell, 5. Auflage, Taylor & Francis 2007, ISBN 978-0815341062.