JAK-STAT-Signalweg
Der JAK-STAT-Signalweg ist ein spezieller Signalübertragungsmechanismus in einigen vielzelligen Organismen. Er trägt zur Regulation der Zellentwicklung, Wachstumskontrolle und Homöostase bei. JAK = Januskinase, STAT = Signal Transducers and Activators of Transcription (STAT-Proteine).
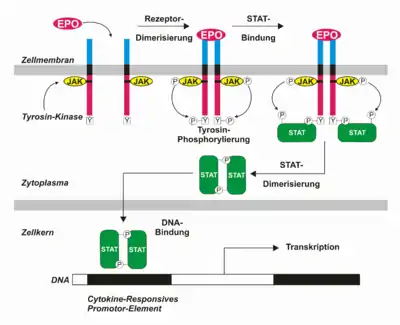
Der JAK-STAT-Signalweg bietet für eukaryotische Zellen eine Möglichkeit, die Information extrazellulärer Signalpeptide von der Zellmembran intrazellulär zu den Promotoren der Zielgene im Zellkern weiterzuleiten. Ursprünglich entdeckt wurde er bei der Behandlung von Zellen mit Interferonen, die insbesondere von weißen Blutzellen als Antwort auf virale Infektionen sezerniert werden. Aus der Gruppe der Zytokine sind neben Interferonen auch Interleukine, sowie aus der Gruppe der Hormone Erythropoietin, Prolaktin und Wachstumshormon typische Liganden für die beteiligten Zytokinrezeptoren. Der JAK-STAT-Signalweg ist in Schleimpilzen, Würmern, Fliegen und Vertebraten vertreten, nicht jedoch in Pilzen und Pflanzen.
JAKs stellen die Tyrosinkinaseaktivität am aktivierten Zytokinrezeptor bereit
Im Allgemeinen werden extrazelluläre Signalpeptide wie Wachstumsfaktoren auf Zielzellen von spezifischen transmembranen Rezeptoren mit intrinsischer (eigener) Tyrosinkinaseaktivität gebunden. Im Gegensatz dazu besitzen die meisten Zytokinrezeptoren des JAK-STAT Weges keine intrinsische Tyrosinkinaseaktivität. Anstelle dessen wird diese von rezeptorassoziierten zytoplasmatischen Proteinen der Januskinase (JAK, früher auch Just Another Kinase) Familie bereitgestellt. JAKs sind evolutionär konserviert, wobei vier verschiedene Varianten in Säugetierzellen zu finden sind (JAK1, JAK2, JAK3 und TYK2). Die Bedeutung von JAKs, insbesondere im Immunsystem, wird durch erbliche Immunodefizienzen unterstrichen, in denen die Rezeptor-Kinase-Assoziation oder die Kinaseaktivität durch Mutationen gestört ist. JAKs binden an spezifische Stellen intrazellulärer Rezeptordomänen und katalysieren ihre gegenseitige ligandeninduzierte Tyrosinphosphorylierung, was ihre Kinaseaktivität erhöht. Anschließend kommt es zur Phosphorylierung von Tyrosinen des Rezeptors.
JAKs phosphorylieren und aktivieren STATs
Die neu entstandenen Phosphotyrosine am Rezeptor sind für die Weiterleitung des Signals entscheidend. Sie stellen Bindungsstellen für Src-homology 2 (SH2) Domänen dar, die Bestandteil aller Signaltransduktoren und Aktivatoren der Transkription (STATs) sind und in der Nähe des Carboxyterminus liegen. Nach Bindung der STATs über ihre SH2-Domäne an den phosphorylierten Rezeptor werden auch sie von den JAKs an einem Tyrosin (Y701 in STAT1) phosphoryliert, so dass auch auf ihrer Oberfläche Bindungsstellen für SH2-Domänen entstehen. Dieses Tyrosin befindet sich carboxyterminal, einige Aminosäurereste von der SH2-Domäne entfernt. Nach Dissoziation vom Rezeptor werden die Phosphotyrosine zweier STATs reziprok erkannt, wobei die SH2-Domäne eines STAT jeweils das Phosphotyrosin des anderen bindet und ein aktiviertes Dimer entsteht.
Auch STATs sind wie JAKs evolutionär konserviert. In Säugetieren gehören ihrer Familie sieben Mitglieder an (STAT1, STAT2, STAT3, STAT4, STAT5a, STAT5b und STAT6). Bei Aktivierung des Rezeptors kommt es abhängig von Rezeptor und Ligand zur Homo- oder Heterodimerisierung bestimmter STATs. Ebenso sind liganden- und rezeptorspezifische JAKs beteiligt. So führt Interferon γ unter Beteiligung von JAK1 und JAK2 zur Homodimerisierung von STAT1 und Interferon α/β unter Beteiligung von JAK1 und TYK2 zur Heterodimerisierung von STAT1 und STAT2.
Aktivierte STATs wirken im Kern als Transkriptionsfaktoren
Das von den aktivierten Dimeren exponierte nukleäre Lokalisationssignal (NLS) führt unmittelbar zu deren Translokation in den Kern, wo sie ihrer Aufgabe als Transkriptionsfaktoren nachgehen. Der JAK-STAT Signalweg stellt demnach eine direkte Route in den Kern dar und kommt ohne second messenger aus. Die an der Plasmamembran aktivierten latenten Transkriptionsfaktoren sind direkt an weiteren Ereignissen im Nukleus beteiligt. Für die Erkennung spezifischer Promotorsequenzen ist die DNA-Bindungsdomäne (DBD) verantwortlich. Sie liegt von der SH2-Domäne aus gesehen N-terminal und ist mit dieser über eine so genannte Linkerdomäne verbunden. Die meisten Dimere erkennen ein 8-10 Basenpaar langes palindromisches DNA-Element mit der Konsensussequenz 5'-TT(N4-6)AA-3'. Üblicherweise wird diese als GAS-Sequenz bezeichnet, was ihre ursprüngliche Charakterisierung als γ-Interferon-Aktivierungssequenz die von STAT1-Homodimeren erkannt wird, widerspiegelt. Nach Bindung des STAT-Dimers am Promoter steigt dessen Transkriptionsrate stark an, was die Fähigkeit der STATs belegt, weitere Coaktivatoren zu rekrutieren, die Chromatinmodifikationen und die Kommunikation mit generellen Transkriptionsfaktoren vermitteln.
Literatur
- J. E. Darnell Jr., Proc. Natl. Acad. Sci. USA 94, 11767 (1997)
- W. J. Leonard, Int. J. Hematol. 73, 271 (2001)
- T. Decker, D. J. Lew, J. Mirkovitch, J. E. Darnell Jr., EMBO J. 10, 927 (1991)