Hypoxie-induzierter Faktor
Hypoxie-induzierter Faktor (HIF) ist ein Transkriptionsfaktor und Hypoxie-induzierbarer Faktor, der die Versorgung der Zelle mit Sauerstoff reguliert, indem er eine Balance zwischen Sauerstoffbedarf und Sauerstoffversorgung herstellt. Seine Entdeckung wurde 2019 mit dem Nobelpreis für Physiologie oder Medizin prämiert.[1]
| Hypoxie-induzierter Faktor 1, α-Untereinheit | ||
|---|---|---|
| ||
| nach PDB 1H2K | ||
|
Vorhandene Strukturdaten: 1d7g, 1h2k, 1h2l, 1h2m, 1l3e, 1l8c, 1lm8, 1lq8, 2ilm, 4ZPR | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 826 Aminosäuren; 92,7 kDa | |
| Isoformen | 2 | |
| Bezeichner | ||
| Gen-Namen | HIF1A ; HIF-1alpha; HIF1-ALPHA; MOP1; PASD8 | |
| Externe IDs | ||
| Vorkommen | ||
| Übergeordnetes Taxon | Chordatiere | |
| Orthologe | ||
| Mensch | Maus | |
| Entrez | 3091 | 15251 |
| Ensembl | ENSG00000100644 | ENSMUSG00000021109 |
| UniProt | Q16665 | Q61221 |
| Refseq (mRNA) | NM_001530 | NM_010431 |
| Refseq (Protein) | NP_001521 | NP_034561 |
| Genlocus | Chr 14: 61.23 – 61.28 Mb | Chr 12: 75 – 75.05 Mb |
| PubMed-Suche | 3091 | 15251 |
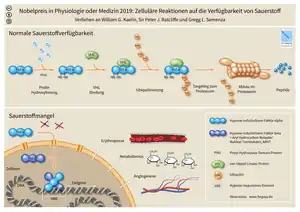
HIF besteht aus einer labilen α-Untereinheit, die in den drei Isoformen HIF-1α, HIF-2α und HIF-3α existiert, und einer β-Untereinheit.
Bei normaler Sauerstoffversorgung (Normoxie) ist die α-Untereinheit an zwei spezifischen Prolyl-Resten hydroxyliert. Diese Hydroxylierung führt dazu, dass HIFα über das Von-Hippel-Lindau-Tumorsuppressor-Protein (pVHL) abgebaut wird.
Bei mangelnder Sauerstoffversorgung (Hypoxie) ist die Hydroxylierung von HIF-α gehemmt. Der so stabilisierte Transkriptionsfaktor aktiviert das Erythropoetin-Gen und eine Reihe weiterer Gene, die zur Anpassung der Zelle an eine mangelnde Sauerstoffversorgung erforderlich sind. Weiterhin deuten verschiedene Experimente auf HIF-induzierte Expression von Wachstumsfaktoren der Gruppe Vascular Endothelial Growth Factor (VEGF) hin.[2][3]
Gewebereparatur, Regeneration und Verjüngung
Unter normalen Umständen wird HIF-1a nach einer Verletzung oder bei Zellstress aller Art durch Prolylhydroxylasen (PHDs) abgebaut. Im Juni 2015 fanden Wissenschaftler heraus, dass die fortgesetzte Hochregulierung von HIF-1a über PHD-Inhibitoren verlorenes oder beschädigtes Gewebe bei Säugetieren mit einer Reparaturreaktion regeneriert. Die Herunterregulierung von Hif-1a hingegen führt zu einer Heilung mit einer Narbenreaktion bei Säugetieren mit einer vorherigen regenerativen Reaktion auf den Gewebeverlust. Die Regulierung von HIF-1a kann entweder den Schlüsselprozess der Regeneration von Säugetieren ausschalten oder einschalten.[4] Wenig später wurde die regenerative Wirkung einer HIF-1a Modulation auf gealterte Hautzellen beschrieben[5][6] und an Patienten ein verjüngender Effekt gealterter Gesichtshaut belegt.[7] HIF Modulation wurde auch mit einer positiven Wirkung bei anlagebedingtem Haarausfall in Verbindung gebracht.[8][9] Das 2016 vom Mediziner Dominik Duscher und Pharmakologen Dominik Thor in Wien gegründete Biotech Unternehmen Tomorrowlabs GmbH[10] macht sich diesen Mechanismus zunutze. Basierend auf dem zum Patent angemeldeten HSF ("HIF stärkender Faktor") Wirkstoff wurden Produkte entwickelt, die Haut- und Haarregeneration fördern sollen.[11][12][13]
Einzelnachweise
- Medizin-Nobelpreis 2019: Der Sauerstoffsensor des Lebens. Abgerufen am 3. Dezember 2020.
- K. M. Mohamed, A. Le u. a.: Correlation between VEGF and HIF-1alpha expression in human oral squamous cell carcinoma. In: Experimental and molecular pathology Band 76, Nummer 2, April 2004, S. 143–152. doi:10.1016/j.yexmp.2003.10.005. PMID 15010293.
- D. Shweiki, A. Itin u. a.: Vascular endothelial growth factor induced by hypoxia may mediate hypoxia-initiated angiogenesis. In: Nature Band 359, Nummer 6398, Oktober 1992, S. 843–845. doi:10.1038/359843a0. PMID 1279431.
- Scientist at LIMR leads study demonstrating drug-induced tissue regeneration. Abgerufen am 3. Dezember 2020 (englisch).
- Andrea Pagani, Matthias M. Aitzetmüller, Elizabeth A. Brett, Viktoria König, Raphael Wenny: Skin Rejuvenation through HIF-1α Modulation. In: Plastic and Reconstructive Surgery. Band 141, Nr. 4, April 2018, ISSN 0032-1052, S. 600e, doi:10.1097/PRS.0000000000004256 (lww.com [abgerufen am 3. Dezember 2020]).
- Andrea Pagani, B. Manuela Kirsch, Ursula Hopfner, Matthias M. Aitzetmueller, Elizabeth A. Brett: Deferiprone Stimulates Aged Dermal Fibroblasts Via HIF-1α Modulation. In: Aesthetic Surgery Journal. 1. Juni 2020, ISSN 1527-330X, doi:10.1093/asj/sjaa142, PMID 32479616 (nih.gov [abgerufen am 3. Dezember 2020]).
- Dominik Duscher, Zeshaan N. Maan, Michael S. Hu, Dominik Thor: A single-center blinded randomized clinical trial to evaluate the anti-aging effects of a novel HSF™-based skin care formulation. In: Journal of Cosmetic Dermatology. Band 19, Nr. 11, 2020, ISSN 1473-2165, S. 2936–2945, doi:10.1111/jocd.13356 (wiley.com [abgerufen am 3. Dezember 2020]).
- Khosrow Siamak Houschyar, Mimi R. Borrelli, Christian Tapking, Daniel Popp, Behrus Puladi: Molecular Mechanisms of Hair Growth and Regeneration: Current Understanding and Novel Paradigms. In: Dermatology. Band 236, Nr. 4, 2020, ISSN 1018-8665, S. 271–280, doi:10.1159/000506155, PMID 32163945 (karger.com [abgerufen am 3. Dezember 2020]).
- Hoffungsvoller Ansatz für Anti-Aging Skin Care und Haarregeneration. Abgerufen am 3. Dezember 2020.
- Tomorrowlabs: Tomorrowlabs. Abgerufen am 3. Dezember 2020.
- Tomorrowlabs - Anti-Aging mit patentiertem Wirkprinzip. In: Lifechange.AT. 2. Oktober 2017, abgerufen am 3. Dezember 2020 (deutsch).
- Kosmetikbranche: Wie das Beauty-Start-up Tomorrowlabs den Markt erobert. Abgerufen am 3. Dezember 2020.
- Ein Protein gegen das Altern und für das Geldverdienen. Abgerufen am 3. Dezember 2020.
Literatur
- Percy, Melanie J. et al.: A Gain-of-Function Mutation in the HIF2A Gene in Familial Erythrocytosis. In: N Engl J Med. Nr. 358, 2008, S. 162–168 (Abstract).
- Frontiers in Nephrology: Thomas O. Daniel et al.: Integrating Renal Hypoxic Signals in Development and Disease. In: J Am Soc Nephrol. Nr. 14, 2003, S. 2693–2694 (Artikel). – Serie von Übersichtsartikeln zu Grundlagen und medizinischer Bedeutung des Sauerstoff-Sensor-Systems.