Hämatopoese
Die Hämatopoese oder Blutbildung ist die Bildung der Zellen des Blutes aus blutzellbildenden Stammzellen. Viele Blutkörperchen haben eine begrenzte Lebensdauer (Erythrozyten: ca. 30–120 Tage, Thrombozyten: ca. 3–10 Tage), deshalb ist eine ständige Erneuerung erforderlich. Bei einem erwachsenen Menschen werden daher täglich Milliarden reife Blutzellen gebildet.[1]
| Übergeordnet |
| Organentwicklung |
| Untergeordnet |
| Myelopoese Lymphopoese Embryonale Hämatopoese Adulte Hämatopoese |
| Gene Ontology |
|---|
| QuickGO |
Schreibweisen
Es existieren vier verschiedene Versionen des Wortes, die als korrekt angesehen und in Publikationen verwendet werden: Hämatopoese, Hämatopoiese, Hämopoese, und Hämopoiese. Im Deutschen ist die Form ohne Binnen-i (-poese), im Englischen die Form mit Binnen-i (-poiesis) gebräuchlicher. Im Englischen wird außerdem e oder ae statt ä geschrieben (Amerikanisches Englisch: hematopoiesis oder Britisches Englisch: haematopoiesis). Der Genitivstamm Hämato- ist Hämo- vorzuziehen.
Beschreibung
Embryonale Hämatopoese
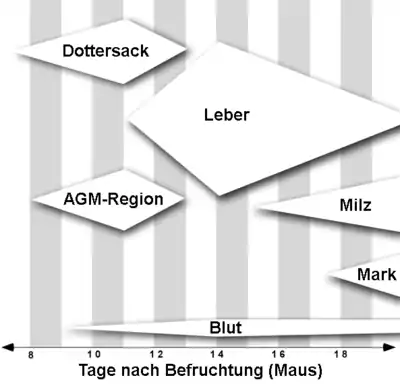
Die ersten Orte der Blutbildung, die bei Mensch und Maus gefunden wurden, sind die sogenannten Blutinseln im Dottersack. Als erste mesodermale Differenzierung treten zunächst homogene Zellaggregate auf, die wohl aus Hämangioblasten bestehen. Die äußeren Zellen dieser Aggregate differenzieren dann zu Endothel, innen entstehen Erythrozyten, so dass also gefüllte Blutgefäße gebildet werden. Diese frühen, ‚primitiven‘ Erythrocyten enthalten noch Zellkerne, im Gegensatz zu den später im Körper vorkommenden. Daneben entstehen auch erste Megakaryozyten und Makrophagen. Blutinseln sind bereits in den frühesten Stadien der Organogenese, kurz nach der Gastrulation, aktiv.[2] Etwas später als die ersten primitiven Erythrozyten-Vorläufer entstehen im Dottersack auch bleibende myeloerythroide Vorläufer, die jedoch in die Leber wandern müssen, um weiter zu differenzieren. Ob im Dottersack jedoch auch echte hämatopoetische Stammzellen entstehen, aus denen alle Arten von Blutzellen entstehen können, ist bisher unklar.[3]
Bevor die späteren hämatopoetischen Organe Thymus, Milz und Knochenmark ausgebildet werden, übernimmt vorübergehend die fetale Leber die Funktion als blutzellbildendes Organ, in der neben anderen Blutzelltypen erstmals kernlose, ‚reife‘ Erythrozyten entstehen. In der fötalen Leber werden hämatopoetische Stammzellen erhalten und vermehrt, sie reifen dort auch, so dass später eine Besiedelung des Knochenmarks möglich ist. Eine Neubildung findet aber weder hier noch in den späteren hämatopoetischen Organen statt. Alle diese Organe müssen daher von hämatopoetischen Stammzellen besiedelt werden, die an anderer Stelle entstanden sind und über den Blutfluss an ihre Zielorgane finden.
Diese Stammzellen werden zuerst in der AGM-Region des frühen Embryos gebildet. Die Buchstaben stehen für Aorta, Gonaden und Mesonephros. In dieser Region, die die dorsale Aorta, das umgebende Mesenchym und die Urogenitalleiste umfasst,[3] findet jedoch keine Differenzierung in spätere Blutzellstadien statt. Für die AGM-Region konnte gezeigt werden, dass die Stammzellen hier nicht aus Hämangioblasten gebildet werden, sondern aus spezialisierten Endothelzellen (hemogenic endothelial cells), die die Aorta auskleiden.[4] Hämatopoetische Stammzellen werden daneben auch im Dottersack gebildet. Je nach Bildungsort scheinen sie sich funktionell zu unterscheiden, da bisher nur für jene aus der AGM-Region gezeigt werden konnte, dass sie auch lymphoide Zellen erzeugen können. Es wird daher diskutiert, dass das Knochenmark als bleibendes Organ der Hämatopoese nur von Stammzellen aus der AGM-Region besiedelt werden könnte. Für die Plazenta wurde in Mäusen gezeigt, dass dort ebenfalls hämatopoetische Stammzellen entstehen.[5] Ein weiterer möglicher Bildungsort ist die Allantois.[2]
Bei der Maus kommt es nach 11,5–12,5 Tagen nach der Befruchtung zu einer Wanderung der hämatopoetischen Stammzellen aus Dottersack, AGM-Region und Plazenta über den Blutkreislauf in die Leber. Für 5–6 Tage kommt es hier zu einer schnellen Vermehrung der Stammzellen sowie zur Differenzierung zu verschiedenen Vorläuferzellen. Erst ein bis zwei Tage vor Ende der etwa 20-tägigen Trächtigkeit wandern sowohl Stamm- als auch Vorläuferzellen ins Knochenmark ein. Kurz danach stellen die Stammzellen ihre Teilungsaktivität weitgehend ein und teilen sich nur noch sehr selten. Im weiteren Leben kommt es zu einer Wanderung hämatopoetischer Stammzellen durch das Blutgefäßsystem, Gewebe und zurück ins Knochenmark auf niedrigem Niveau.[1]
Die fötale Milz ist wie die fötale Leber zeitweise ein hämatopoetisches Organ, bei der Maus vom letzten Drittel der Trächtigkeit bis einige Wochen nach der Geburt. Hier findet kaum Vermehrung der hämatopoetischen Stammzellen statt, wohl aber deren Differenzierung zu reifen Blutzellen.[2]
Beim Menschen findet die Hämatopoese bis zum 3. Embryonalmonat im Mesenchym des Dottersacks statt (mesoblastische Periode). Ab dem 2. Embryonalmonat läuft die Blutbildung beim Fetus in der Leber ab (hepatische Periode), ab dem 4. Fetalmonat auch in der Milz und im Thymus (hepatolineale Periode), ab dem 6. Fetalmonat in Milz und Knochenmark (lienomyelopoetische Periode), ab dem 6. bis 7. Monat vor allem im Knochenmark (myelopoetische Periode), außer bei Lymphozyten.
Adulte Hämatopoese
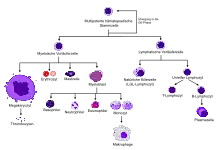
Die Bezeichnung ‚adulte‘, also erwachsene Hämatopoese ist insofern irreführend, als sie bereits ab der Geburt stattfindet. Als Abgrenzung zur embryonalen, also vorgeburtlichen Hämatopoese ist der Begriff jedoch eingeführt und wird daher auch hier entsprechend verwendet. Nach der Geburt erfolgt die Hämatopoese im Knochenmark (myelotisches System) und im lymphatischen System. Blutkörperchen entstehen aus Stammzellen, die nach dem Heranreifen aus dem Knochenmark in das Blut übertreten. Ein Teil der Stammzellen ist pluripotent, d. h., sie können sowohl in myeloische als auch in lymphatische Zellen ausreifen, bereits weiter differenzierte sind hingegen determiniert (committed) und können sich nur in eine oder zwei bestimmte Richtungen differenzieren.
Die Stammzellen verschiedener Stadien können über die An- (+) oder Abwesenheit (−) verschiedener Oberflächenmarker (Proteine, die von außen an die Zellmembran gebunden sind) durch Immunphänotypisierung voneinander unterschieden werden. Die am wenigsten differenzierten Stammzellen, die ‚long-term-repopulating cells‘ (Langzeit-repopulierende Zellen) zeichnen sich beispielsweise in der Maus durch die Marker-Kombination KIT+ Sca-1+ CD34− aus. Diese Zellen teilen sich nur sehr selten. Sie können sich in der nächsten Stufe in ‚short term repopulating cells‘ differenzieren (c-kit+ Sca-1+ CD34+), die sich häufiger teilen.[2] Aus diesen wiederum gehen ‚common lymphoid precurser‘ (CLP, gemeinsame lymphoide Vorläufer) und ‚common myeloid precursor‘ (CMP, gemeinsame myeloide Vorläufer) hervor.
Treten unreife Blutzellen-Vorstufen ins Blut über, wird dies als Kernverschiebung bezeichnet.
Blutzell-Linien
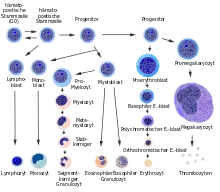
Als Myelopoese bezeichnet man den Zweig der Hämatopoese, in dem aus pluripotenten Stammzellen Erythrozyten, Thrombozyten, Granulozyten, Osteoklasten, Makrophagen und Mastzellen gebildet werden. Sie findet ausschließlich im Knochenmark statt. Der andere Zweig der Hämatopoese wird als Lymphopoese bezeichnet.[6] Sie kommt auch außerhalb des Knochenmarks in den lymphatischen Organen vor.
Nach der Art der gebildeten Blutzellen und ihrer Zellabstammung unterscheidet man weiter:
- die Erythropoese: Bildung von Erythrozyten
- die Thrombopoese: Bildung von Thrombozyten
- die Megakaryopoese: Bildung von Megakaryozyten
- die Leukopoese: Bildung von Leukozyten
- die Granulopoese: Bildung von Granulozyten
- die Lymphopoese: Bildung von Lymphozyten
- die Monopoese: Bildung von Monozyten
Etymologie
Das Wort Hämatopoese leitet sich vom altgriechischen αἷμα haíma „Blut“ (dessen Stamm im Genetiv αἷματος haímatos erkennbar ist; daher Wortbildung hämat-) sowie ποίησις poíēsis „Machen“, „Tätigkeit, die etwas hervorbringt“ ab. Wörtlich bedeutet Hämatopoese also Blutbildung. Der erste Bestandteil von Myelopoese ist auf μυελός myelós „Mark“ zurückzuführen.[7]
Siehe auch
Ältere Literatur
- Ludwig Heilmeyer, Herbert Begemann: Blut und Blutkrankheiten. In: Ludwig Heilmeyer (Hrsg.): Lehrbuch der Inneren Medizin. Springer-Verlag, Berlin/Göttingen/Heidelberg 1955; 2. Auflage ebenda 1961, S. 376–449, hier: S. 388–392 (Blutbildung und -untergang).
Einzelnachweise
- D. J. Laird, U. H. von Andrian, A. J. Wagers: Stem cell trafficking in tissue development, growth, and disease. In: Cell. Band 132, Nr. 4, Februar 2008, S. 612–630, doi:10.1016/j.cell.2008.01.041, PMID 18295579.
- A. Cumano, I. Godin: Ontogeny of the hematopoietic system. In: Annual review of immunology. Band 25, 2007, S. 745–785, doi:10.1146/annurev.immunol.25.022106.141538, PMID 17201678.
- H. K. Mikkola, S. H. Orkin: The journey of developing hematopoietic stem cells. In: Development (Cambridge, England). Band 133, Nr. 19, Oktober 2006, S. 3733–3744, doi:10.1242/dev.02568, PMID 16968814.
- M. F. de Bruijn, X. Ma, C. Robin, K. Ottersbach, M. J. Sanchez, E. Dzierzak: Hematopoietic stem cells localize to the endothelial cell layer in the midgestation mouse aorta. In: Immunity. Band 16, Nr. 5, Mai 2002, S. 673–683, PMID 12049719 (elsevier.com).
- K. E. Rhodes, C. Gekas, Y. Wang u. a.: The emergence of hematopoietic stem cells is initiated in the placental vasculature in the absence of circulation. In: Cell stem cell. Band 2, Nr. 3, März 2008, S. 252–263, doi:10.1016/j.stem.2008.01.001, PMID 18371450.
- H. Hahn u. a.: Medizinische Mikrobiologie und Infektiologie. Springer, 2008, ISBN 978-3-540-46359-7, S. 40. (online)
- Wilhelm Gemoll: Griechisch-Deutsches Schul- und Handwörterbuch. München/ Wien 1965.