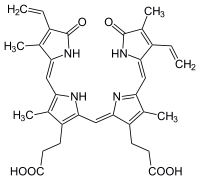Hämoxygenase
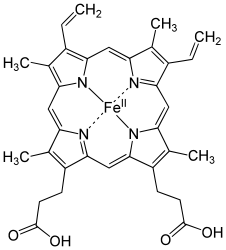
Hämoxygenase (HMOX) ist der Name für das Enzym, das Häm zu Eisen (in Form von Fe3+-Ionen), Biliverdin und Kohlenstoffmonoxid oxidiert und abbaut. Es kommt in Säugetieren im glatten endoplasmatischen Retikulum der Zellen, aber auch in Cyanobakterien und Rotalgen vor. Mutationen am HMOX-Gen beim Menschen können sehr selten Hämoxygenase-Mangel verursachen. Das Enzym ist nicht nur unverzichtbar für den Porphyrin-Abbau, sondern ist auch an der Signaltransduktion beteiligt.
| Hämoxygenase | ||
|---|---|---|
 | ||
|
Vorhandene Strukturdaten: s. UniProt | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 288 Aminosäuren | |
| Bezeichner | ||
| Gen-Namen | HMOX1 ; HMOX2 | |
| Externe IDs | ||
| Enzymklassifikation | ||
| EC, Kategorie | 1.14.99.3, Dioxygenase | |
| Reaktionsart | Oxidation | |
| Substrat | Häm + 4 NADPH/H+ + 3 O2 | |
| Produkte | Biliverdin + Fe2+ + 4 NADP+ + CO + 3 H2O | |
| Vorkommen | ||
| Homologie-Familie | HOX2 | |
| Übergeordnetes Taxon | Lebewesen | |
Hämoxygenase existiert in Säugetieren in bis zu drei Isoformen, beim Menschen in zwei, der induzierbaren Isoform Hämoxygenase-1 (HO-1) und konstitutiven Isoform Hämoxygenase-2 (HO-2). Hämoxygenase-1 ist ein Protein mit einer molaren Masse von 32 kDa. Hämoxygenase-1 wird in Geweben von Säugetieren durch eine große Anzahl von Stimuli hochreguliert, wie TGF-β, Platelet-derived growth factor (PDGF), Vascular Endothelial Growth Factor (VEGF), Stromal cell-derived factor 1 (SDF-1), NO, Peroxinitrit, Lipidperoxide, Sauerstoffmangel (Hypoxie), Oxidativer Stress, Zytokine und andere. Hämoxygenase-2 wird konstitutiv, d. h. unabhängig von inneren und äußeren Faktoren in Gehirn, Endothel und Hoden gebildet (exprimiert). Der Abbau von Häm durch das Hämoxygenase-System ist die hauptsächliche Quelle für die Bildung von Kohlenstoffmonoxid im Körper, der die Funktion eines Gasotransmitters hat.
| ||
Die Hämoxygenase katalysiert die Oxidation von Häm zu Biliverdin unter der Freisetzung von Eisenionen und Kohlenmonoxid. Dabei arbeitet das Enzym am Häm-Molekül „regiospezifisch“. Es wird ausschließlich das α-Isomer des Biliverdins freigesetzt, das in der Folge durch die NADPH-Cytochrom-P450-Oxidoreduktase zum α-Isomer des Bilirubins abgebaut wird. Die Reaktion wird durch die NADPH-abhängige Reduktion des Eisens im Häm-Komplex vervollständigt.
Biologische Bedeutung
Hämoxygenase-1 und das Stoffwechselprodukt Kohlenstoffmonoxid nehmen im Körper wichtige Funktionen wahr: Sie fördern die Gefäßneubildung (proangiogenetische Wirkung) und hemmen Entzündungsvorgänge (antiinflammatorische Wirkung), oxidativen Stress (antioxidative Wirkung), vermehrte Bindegewebsbildung (antifibrotische Wirkung) sowie programmierten Zelltod (antiapoptotische Wirkung). VEGF und SDF-1 üben ihre proangiogenetische Wirkung dadurch aus, dass sie Hämoxygenase induzieren. Eine massive Anzahl präklinischer und klinischer Untersuchungen beschreibt die antiinflammatorische Wirkung des Enzyms[2]. Einzelnen Untersuchungen zur Folge könnte die HO-1 jedoch auch bestimmte chronische Entzündungen fördern, und damit als Schnittstelle zwischen Übergewicht und Folgeerkrankungen fungieren[3].
HO-1 in der Darm-Mucosa baut das mit der Nahrung aufgenommene Häm ab.
Medizinische Bedeutung
Embryonalentwicklung
In der Embryonalentwicklung ist die Bildung neuer Gefäße, und damit das Hämoxygenase/Kohlenstoffmonoxid-System von entscheidender Bedeutung. In der Präeklampsie ist die Konzentration vom Hämoxygenase-1 in der Plazenta vermindert, bei den betroffenen Schwangeren ist in der ausgeatmeten Luft die Konzentration an Kohlenstoffmonoxid verringert. Raucherinnen, die eine erhöhte Konzentration an Kohlenstoffmonoxid im Blut aufweisen, erkranken seltener an Präeklampsie. Hämoxygenase-1 und Kohlenstoffmonoxid hemmen in der Präeklampsie die Freisetzung antiangiogenetischer Mediatoren wie Soluble fms-like tyrosine kinase-1 (sFlt1) und Soluble endoglin (sEng).
Tumor-Angiogenese
Verschiedene Tumoren, darunter Nierenzellkarzinom und Prostatakarzinom exprimieren große Mengen an Hämoxygenase-1. Hämoxygenase fördert in Tumoren die Gefäßneubildung und hemmt den programmierten Zelltod von Tumorzellen. In Tiermodellen führt eine Hemmung der Hämoxygenase zu einer Verminderung des Tumorwachstums.
Wundheilung
Voraussetzung für die Wundheilung ist die Bildung neuer Gefäße (Neovaskularisation). Mäuse mit verminderter Bildung von Hämoxygenase-1 weisen Wundheilungsstörungen auf.
Diabetes
Das Enzym Hämoxygenase-1 (HO-1) ist in der Forschung über Diabetes Typ 2 ins Augenmerk getreten. Es ist in beträchtlichen Mengen vorhanden, wenn der Körper gestresst oder krank ist. Regelmäßige Bewegung und richtige Ernährung würden HO-1 nicht in krankmachende Mengen steigen lassen. Demnach hebe Bewegungsmangel den Spiegel des HO-1 an, was den Gesundheitszustand verschlechtert und HO-1 wiederum vermehrt produziere.[4]
Eine Studie gab Hinweise auf einen hohen HO-1-Spiegel als ein Prädiktor für das metabolische Syndrom.[5]
Bindegewebsbildung
Hämoxygenase-1 hemmt eine krankhafte Vermehrung des Bindegewebes (Fibrose). Mäuse mit verminderter Bildung von Hämoxygenase-1 weisen bei Behinderung des Harnabflusses (Harnwegsobstruktion) in den betroffenen Nieren eine vermehrte Fibrose, eine vermehrte Expression von TGF-β1, eine verstärkte Entzündungsreaktion sowie einen vermehrten Übergang von Epithelzellen in Bindegewebszellen (Epitheliale-mesenchymale Transition (EMT)) auf.[6] Induktion von Hämoxygenase-1 durch Hämin hemmt die Nierenfibrose über einen antiapoptotischen Signalweg; Zink-Protoporphyrin, ein Hemmstoff der Hämoxygenase-1, hebt diesen antifibrotischen Effekt partiell auf.[7]
Literatur
- J Dulak et al.: Heme oxygenase-1 and carbon monoxide in vascular pathobiology: focus on angiogenesis. In: Circulation. Jan 15, 117(2), 2008, S. 231–241, PMID 18195184 (ahajournals.org).
Weblinks
Einzelnachweise
- Verena Engelke, Adina Rocher,Peter Imming: Gasotransmitter. Paradoxon Kohlenmonoxid. Pharmazeutische-Zeitung, 33/2010
- Motterlini, R. and L. E. Otterbein (2010). "The therapeutic potential of carbon monoxide." Nature Reviews Drug Discovery 9(9): 728-U724
- Pospisilik J. Andrew et al. HO-1 macht Dicke krank, Max Planck Gesellschaft, vom 3. Juli 2014
- Ursula Biermann: MEDIZIN – Ein Enzym als möglicher Auslöser von Diabetes, in Deutschlandfunk „Forschung aktuell“ vom 9. Juli 2014
- Jais A u. a.: Heme Oxygenase-1 Drives Metaflammation and Insulin Resistance in Mouse and Man, Cell, Band 158, Nr. 1, S. 25–40, Juli 2014
- JH Kie et al.: Heme Oxygenase-1 Deficiency Promotes Epithelial-Mesenchymal Transition and Renal Fibrosis. In: J Am Soc Nephrol. Nr. 19, S. 1681–1691, PMID 18495963.
- JH Kim et al.: Heme oxygenase-1 protects rat kidney from ureteral obstruction via an antiapoptotic pathway. In: J Am Soc Nephrol. 17(5), May, 2006, S. 1373–1381, PMID 16597687 (Artikel).