α-Helix
Als α-Helix wird in der Biochemie eine häufige Ausprägung der Sekundärstruktur eines Proteins bezeichnet. Sie gehört zu den stabilsten natürlichen Konformationen einer Aminosäuresequenz und ist in der Sekundärstruktur nahezu allgegenwärtig.
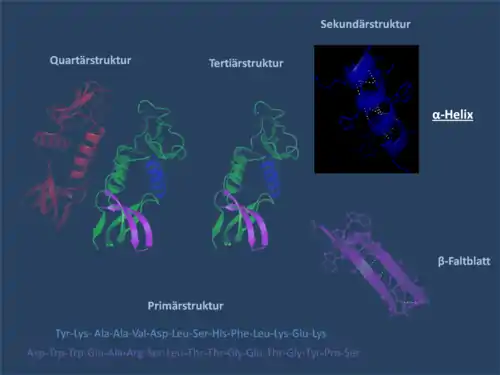
Unter der Sekundärstruktur eines Proteins wird die räumliche Struktur der Aminosäurekette ohne Berücksichtigung der Seitengruppen verstanden. Die Sekundärstruktur eines Proteins geht aus dessen Primärstruktur (Aminosäuresequenz) hervor. Übergeordnete Strukturebenen sind die Tertiärstruktur und die Quartärstruktur. Die dreidimensionale Struktur eines Proteins ist entscheidend für dessen selektive Funktion (siehe Proteinstruktur).
Geschichte
Ende der 1930er Jahre begann William Astbury Kristallstrukturanalysen an kristallinen Peptiden durchzuführen. Dabei wurde festgestellt, dass sich bestimmte räumliche Merkmale regelmäßig wiederholen, bei denen Wasserstoffbrücken innerhalb des Moleküls vermutet wurden.[1][2][3] Ihm war jedoch die Planarität der Peptidbindung noch nicht bekannt. Die häufigsten räumlichen Strukturen wurden später α-Helix und β-Faltblatt genannt. Linus Pauling, Robert Brainard Corey und Herman Branson schlugen 1951 ein Modell der α-Helix vor.[4][5] Das α in „α-Helix“ enthält keine wissenschaftliche Aussage, sondern bringt nur zum Ausdruck, dass die α-Helix vor dem β-Faltblatt gefunden wurde. Der von G. N. Ramachandran entwickelte Ramachandran-Plot erlaubte deren Identifikation anhand der Diederwinkel der im Protein aufeinanderfolgenden Aminosäuren, ähnlich wie auch der später entwickelte Janin-Plot.
Struktur
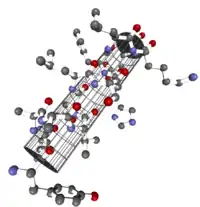
Die α-Helix ist eine rechtshändig gedrehte Spirale (bevorzugt von L-Aminosäuren) mit durchschnittlich 3,6 Aminosäureseitenketten pro Umdrehung. Pro Windung wird eine Länge von p = 0,54 nm (5,4 Å) erzielt. Dieser Fortschritt wird als Ganghöhe bezeichnet. Sie ist das Produkt aus Schiebung (auch Translation genannt) (0,15 nm) und Resten pro Windung (3,6).[6] Dieser Abstand zwischen den Resten ist der Grund dafür, dass Aminosäuren, die in der Primärstruktur drei oder vier Stellen voneinander entfernt sind, sich in der Helixstruktur in unmittelbarer Nähe befinden. Stabilisiert wird die α-Helix durch eine Wasserstoffbrückenbindung zwischen dem Carbonylsauerstoff der n-ten und dem Amidproton der (n+4)-ten Aminosäure desselben Moleküls.
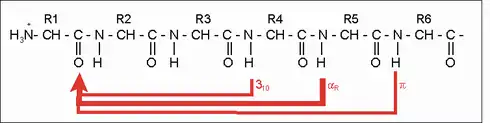
Die CO- und NH-Gruppen müssen zur Ausbildung der Wasserstoffbrückenbindung dicht beieinander liegen. Die engste Konfiguration liefert ein aufgewickelter Strang, bei der die beiden Gruppen übereinander liegen. Die Seitenketten zeigen dabei nach außen. Die Aminosäure Prolin („Strukturbrecher“) lässt sich nicht ohne Weiteres in die Helix einfügen (nur an den Positionen 1–4, vom Aminoende aus gesehen, ist dies möglich). Folglich kommt es an Stellen, an denen Prolin auftritt, zu Abweichungen von der regelmäßigen Struktur. α-Helices sind sehr stabil und können als starre Zylinder eine Art Skelett des Proteins bilden. Daher werden sie in Proteinstrukturen häufig nicht als Helices, sondern als Zylinder abgebildet. Ein Protein mit überwiegender Helixstruktur ist das Myoglobin, ein mit dem Hämoglobin verwandtes Muskelprotein.
Eine α-Helix ist oftmals nur im Kontext eines Proteins stabil, weshalb bei isolierten α-Helices oftmals zusätzliche stabilisierende Bindungen eingeführt werden, z. B. durch Ersatz der Wasserstoffbrückenbindung durch eine C-C-Bindung, durch eine Quervernetzung der Aminosäureseitenketten oder durch Ausbildung von Disulfidbrücken.[7][8][9][10]
Geometrie der Helix und Helix-Helix-Wechselwirkungen
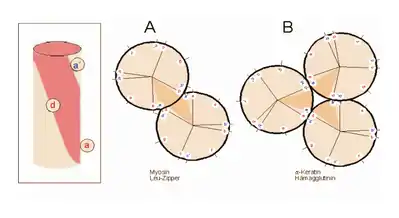
Teil A zeigt ein „coiled coil“ aus zwei, Teil B ein solches aus drei α-Helices (Projektion). Darüber hinaus wurden „tetrahelix bundle“-Strukturen beschrieben.
α-Helices sind die Grundlage typischer Faserproteine (α-Keratin, der Grundsubstanz der Haare, Myosin, einer Komponente der Muskelfasern usw.) aber auch, wie am Beispiel des Myoglobins eingeführt, strukturgebende Komponenten von löslichen, globulären Proteinen. Einzelne Helices können diese Aufgabe im Allgemeinen nicht übernehmen, wohl aber geordnete Aggregate aus zwei, drei, vier oder mehr Individualhelices.
Die Zusammenlagerung zu einer solchen „Superhelix“ (en. supercoil) beruht auf hydrophoben Wechselwirkungen in amphipathischen Helices. Das sind Helices, deren eine Seite hydrophil (dem Wasser zugewandt) und deren andere Seite hydrophob und damit zu Wechselwirkungen befähigt ist. Die Struktur der Helix bewirkt, dass das „hydrophobe Band“ nicht parallel zur Helixachse verläuft, sondern die Helix in Form einer gedehnten, linksgängigen Spirale umgibt. Wenn sich die hydrophoben Bänder von zwei oder mehr Helices nähern, entsteht die englisch als Coiled-Coil bezeichnete Superhelix.
Helix-Vorhersage
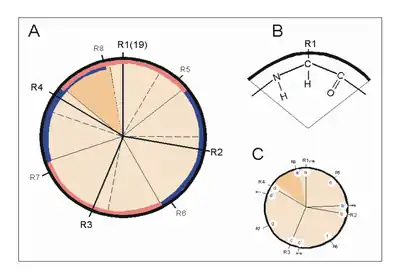
Erste Bemühungen zur Vorhersage von Protein-Sekundärstrukturen gehen auf die 1960er Jahre zurück und konnten mit dem Aufkommen der modernen Röntgenstrukturanalyse kontinuierlich verfeinert werden. Ein überaus hilfreicher, rationaler Ansatz zur Vorhersage der α-Helix verbindet sich mit dem Namen Marianne Schiffer und schließt an die obigen Überlegungen an. Nach dem n+/-3,4 Kriterium kann sich ein Rest n mit Resten paaren, die drei bzw. vier Positionen entfernt sind. Sind z. B. die Reste 1, 4 und 5 hydrophob, so können sie wechselwirken und damit eine Helixstruktur stabilisieren. Gleiches gilt für die Reste 6, 3 und 2 usw. Dieses Vorhersageschema zeigte zunächst für Insulin und Myoglobin seinen Wert.
Mit der Veröffentlichung weiterer Röntgenstrukturanalysen wich der „helical-wheel“-Ansatz zunehmend statistischen Verfahren. Ein früher Ansatz dieser Art geht auf Chou und Fasman (1974, 1978) zurück.
Die nachfolgende Tabelle gibt die Helixpotentiale (Pα) von Aminosäureresten wieder. Pα entspricht der relativen Häufigkeit, mit der die Aminosäure in der Helix vertreten ist. Bei einem Pα deutlich über 1 wird eine Aminosäure als „Helixbildner“ bezeichnet, bei einem Pα deutlich unter 1 als „Helixbrecher“.[11]
| Aminosäure | Pα |
|---|---|
| Glu | 1,59 |
| Ala | 1,41 |
| Leu | 1,34 |
| Met | 1,30 |
| Gln | 1,27 |
| Lys | 1,23 |
| Arg | 1,21 |
| Phe | 1,16 |
| Ile | 1,09 |
| His | 1,05 |
| Trp | 1,02 |
| Asp | 0,99 |
| Val | 0,90 |
| Thr | 0,76 |
| Asn | 0,76 |
| Cys | 0,66 |
| Tyr | 0,61 |
| Ser | 0,57 |
| Gly | 0,43 |
| Pro | 0,34 |
Zusammenfassung der Helix-Parameter
| A – Relation der Reste zueinander | |||
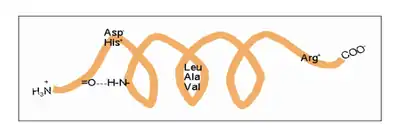
| n + 4 | Reste 1 und 5 | H-Brücke | -C=O···HN- |
| n +/− 3, 4 | Reste 1 und 4 oder 5 | gleiche Seite | „hydrophober Bogen“, α-Potenzial |
| n + 18 | Reste 1 und 19 | ekliptisch | 5 × 3,6 = 18; „repeat unit“ |
| n + 7 | Reste 1 und 8 | „fast ekliptisch“ | 2 × 3,6; „Heptadenrepeat“ |
| B – Physikalische Parameter | |||
| n = 3,6 | Reste pro Windung | ||
| d = 1,5 A | axiale Verschiebung je Rest | ||
| p = 5,4 Å = n x d | “Pitch” (Abstand zwischen den Windungen) | ||
| a = 100° = 360° / n | Winkel (Sektor) je Aminosäure | ||
Andere Ausprägungen der Sekundärstruktur

Neben der α-Helix und dem β-Faltblatt existieren weitere Arten der Sekundärstruktur (Sekundärstrukturmotive). Andere häufig vorkommende Motive sind:
Die nicht zu einem Motiv gehörenden Teile der Primärstruktur eines Proteins werden Zufallsschleifen (Random-Coil-Strukturen) genannt. Diese Strukturen sind ebenfalls maßgeblich an der Ausbildung der gesamten Proteinstruktur beteiligt.
Literatur
- M. Schiffer, A. B. Edmundson: Use of helical wheels to represent the structures of proteins and to identify segments with helical potential. In: Biophysical Journal. 7, 1967, S. 121–135.
- P. Y. Chou, G. D. Fasman: Empirical predictions of protein conformation. In: Annual Review of Biochemistry. 47, 1978, S. 251–276.
- C. Cohen, D. A. D. Parry: α-Helical coiled-coils – a widespread motif in proteins. In: Trends in biochemical sciences. 11, 1986, S. 245–248.
- S. Kamtekar, J. M. Schiffer, H. Xiong, J. M. Babik, M. H. Hechtr: Protein design by binary patterning of polar and nonpolar amino acids. In: Science. 262, 1993, S. 1680–1685.
Weblinks
Einzelnachweise
- William T. Astbury, S. Dickinson, K. Bailey: The X-ray interpretation of denaturation and the structure of the seed globulins. In: The Biochemical journal. Band 29, Nummer 10, Oktober 1935, S. 2351–2360.1, PMID 16745914. PMC 1266766 (freier Volltext).
- William T. Astbury: The structural proteins of the cell. In: The Biochemical journal. Band 39, Nummer 5, 1945, S. lvi, PMID 21020817.
- W. T. Astbury, R. Reed, L. C. Spark: An X-ray and electron microscope study of tropomyosin. In: The Biochemical journal. Band 43, Nummer 2, 1948, S. 282–287, PMID 16748402. PMC 1274681 (freier Volltext).
- Linus Pauling, Robert Brainard Corey, Herman R. Branson: The structure of proteins; two hydrogen-bonded helical configurations of the polypeptide chain. In: Proceedings of the National Academy of Sciences. Band 37, Nummer 4, April 1951, S. 205–211, PMID 14816373. PMC 1063337 (freier Volltext).
- J. M. Scholtz, R. L. Baldwin: The mechanism of alpha-helix formation by peptides. In: Annual review of biophysics and biomolecular structure. Band 21, 1992, S. 95–118, doi:10.1146/annurev.bb.21.060192.000523. PMID 1525475. rbaldwin.stanford.edu (PDF; 602 kB)
- Jeremy M. Berg, John L. Tymoczko, Lubert Stryer: Stryer Biochemie. 7. Auflage. Springer Spektrum, Heidelberg 2014, ISBN 978-3-8274-2988-9, S. 40.
- A. Winter, A. P. Higueruelo, M. Marsh, A. Sigurdardottir, W. R. Pitt, T. L. Blundell: Biophysical and computational fragment-based approaches to targeting protein-protein interactions: applications in structure-guided drug discovery. In: Quarterly reviews of biophysics. Band 45, Nummer 4, November 2012, S. 383–426, doi:10.1017/S0033583512000108. PMID 22971516.
- L. K. Henchey, A. L. Jochim, P. S. Arora: Contemporary strategies for the stabilization of peptides in the alpha-helical conformation. In: Current opinion in chemical biology. Band 12, Nummer 6, Dezember 2008, S. 692–697, doi:10.1016/j.cbpa.2008.08.019. PMID 18793750. PMC 2650020 (freier Volltext).
- R. J. Platt, T. S. Han, B. R. Green, M. D. Smith, J. Skalicky, P. Gruszczynski, H. S. White, B. Olivera, G. Bulaj, J. Gajewiak: Stapling mimics noncovalent interactions of γ-carboxyglutamates in conantokins, peptidic antagonists of N-methyl-D-aspartic acid receptors. In: The Journal of biological chemistry. Band 287, Nummer 24, Juni 2012, S. 20727–20736, doi:10.1074/jbc.M112.350462. PMID 22518838. PMC 3370255 (freier Volltext).
- P. Barthe, S. Rochette, C. Vita, C. Roumestand: Synthesis and NMR solution structure of an alpha-helical hairpin stapled with two disulfide bridges. In: Protein science: a publication of the Protein Society. Band 9, Nummer 5, Mai 2000, S. 942–955, doi:10.1110/ps.9.5.942. PMID 10850804. PMC 2144636 (freier Volltext).
- Jeremy M. Berg: Stryer Biochemie. 6. Auflage. Spektrum Akademischer Verlag, Heidelberg 2007, S. 56.
- PDB Community Focus: Julian Voss-Andreae, Protein Sculptor. In: Protein Data Bank Newsletter. 32, Winter, 2007, wwpdb.org (PDF)
- L. Moran, R. A. Horton, G. Scrimgeour, M. Perry: Principles of Biochemistry. Pearson, Boston MA 2011, ISBN 978-0-321-70733-8, S. 127.