Ferrocen
Ferrocen (Benennung nach IUPAC: Bis(η5-cyclopentadienyl)eisen)[3], mit der Halbstrukturformel [Fe(Cp)2] oder auch [Fe(C5H5)2], ist ein Metallocen, das heißt, eine metallorganische Verbindung mit aromatischen Ringsystemen, in deren Zentrum sich ein Eisenatom (lateinisch ferrum) befindet. Als erste chemische Verbindung wurde Ferrocen Sandwichverbindung genannt, weil sich zeigte, dass die beiden Cyclopentadienylringe auf gegenüberliegenden Seiten des Eisenatoms liegen.
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
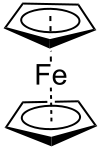 | |||||||||||||||||||
| Ekliptische Konformation | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | Ferrocen | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C10H10Fe | ||||||||||||||||||
| Kurzbeschreibung |
orangefarbene Nadeln mit campferartigem Geruch[1] | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 186,04 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
fest | ||||||||||||||||||
| Dichte |
1,49 g·cm−3 (20 °C)[1] | ||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt |
249 °C[1] | ||||||||||||||||||
| Löslichkeit | |||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Toxikologische Daten | |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | |||||||||||||||||||
Geschichte
Ferrocen wurde 1951 von Thomas J. Kealy und Peter L. Pauson an der Duquesne University, bei dem Versuch Fulvalen durch die Reaktion von Cyclopentadienylmagnesiumbromid mit Eisen(III)-chlorid herzustellen, zufällig entdeckt. Sie erhielten bei der Umsetzung unter anderem orangefarbene Kristalle, die überraschenderweise luftstabil waren und leicht sublimiert werden konnten.[4]
Unabhängig davon und ebenfalls 1951 hatte eine Arbeitsgruppe um Samuel A. Miller (mit John A. Tebboth sowie John F. Tremaine) bei der British Oxgen Company die gleiche Substanz durch die Reaktion von Cyclopentadien-Dampf mit frisch reduziertem Eisen bei 300 °C hergestellt und beschrieben.[5][6]
Die ersten auf Infrarotspektroskopie beruhenden Strukturvorschläge von Geoffrey Wilkinson und Robert B. Woodward, damals beide an der Harvard University, konnten 1952 durch Röntgen-Kristallstrukturanalyse von Ernst Otto Fischer und Wolfgang Pfab (beide damals TU München) bestätigt werden.[7] Da Woodward postulierte, dass die Cyclopentadienylringe im Fe(C5H5)2 einer elektrophilen Substitution zugänglich sein sollten, führten Whitning und Rosenblum die erste Friedel-Crafts-Acylierung am Cyclopentadienylring im Ferrocen durch.[8] Aufgrund dieses Verhaltens schlugen sie den Namen Ferrocene vor, mit der Endung -ene (analog zu benzene, englisch für Benzol), die die Aromatizität der Verbindung unterstreicht.[6]
Ernst Otto Fischer und Geoffrey Wilkinson erhielten 1973 den Nobelpreis für Chemie für ihre Arbeiten über metallorganische Verbindungen, die auch die Bindungsverhältnisse im Ferrocen erklärten.
Gewinnung und Darstellung
Neben den geschichtlichen Synthesevarianten ist Ferrocen im Labor leicht zugänglich über die Umsetzung von Cyclopentadien mit Eisen(II)-chlorid in einem inerten Lösemittel und einem Überschuss von Kaliumhydroxid, welches sowohl als Deprotonierungsreagenz für das Cyclopentadien, als auch als Dehydratisierungsmittel dient:[9]
Eigenschaften

Physikalische Eigenschaften
Ferrocen bildet orangefarbene Kristallnadeln mit einem Schmelzpunkt von 173 °C und einem Siedepunkt von 249 °C, ab 100 °C tritt jedoch bereits eine merkliche Sublimation ein.[9] In Wasser ist Ferrocen nicht löslich, in unpolaren Lösungsmitteln wie n-Hexan oder Toluol hingegen gut. Es besitzt große thermische und chemische Stabilität. Ferrocen lässt sich durch Vakuumsublimation gut reinigen, da es für einen Feststoff einen relativ hohen Dampfdruck hat.
Bindungsverhältnisse
Ferrocen setzt sich formal aus einem Eisen(II)-Kation und zwei Cyclopentadienylanionen (C5H5−) zusammen. Insgesamt ergibt sich also ein ungeladener Komplex.
Die Bindungsverhältnisse lassen sich vereinfacht dadurch erklären, dass die Cyclopentadienylanionen als Aromaten über ein delokalisiertes π-Elektronensystem verfügen. Jeder der beiden Liganden kann dem Eisen(II)-Kation sechs π-Elektronen zur Verfügung stellen. Da das Eisen(II)-Kation sechs Elektronen besitzt und zwölf Elektronen von den Liganden erhält, besitzt es im Komplex 18 Elektronen. Damit erreicht es, der 18-Elektronen-Regel folgend, die energetisch günstige Edelgaskonfiguration von Krypton.
Der Abstand der Cyclopentadienylringe beträgt 332 pm, was dem Van-der-Waals-Kontakt zweier π-Systeme entspricht, z. B. dem Abstand der Schichten im Graphit von 330 pm oder auch im Bis(benzol)chrom mit 322 pm.
Der Fe-C-Abstand beträgt 204,5 ± 1 pm, der C-C-Abstand 140,3 ± 2 pm. Es kristallisiert bei Raumtemperatur im monoklinen Kristallsystem in der Raumgruppe P21/a (Raumgruppen-Nr. 14, Stellung 3) mit den Gitterparametern a = 1056,1 pm, b = 759,7 pm c = 595,2 pm und β = 121,02° mit zwei Formeleinheiten pro Elementarzelle.[10]
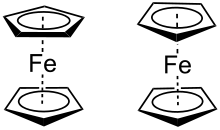
Die ekliptische Konformation („auf Deckung“) ist gegenüber der gestaffelten Konformation der Ringe bevorzugt.[11] Ferrocen kristallisiert bei Raumtemperatur in monokliner, bei T < 164 K in trikliner und bei T < 110 K in orthorhombischer Modifikation. In der monoklinen Form wird durch Fehlordnung eine gestaffelte Konformation (D5d) individueller Sandwichmoleküle vorgetäuscht. Die trikline Form weicht um 9° von der ekliptischen Anordnung (D5) ab, die orthorhombische Form (D5h) ist exakt ekliptisch gebaut.[12][13]
Ekliptisch ist Ferrocen auch in der Gasphase, die Rotationsbarriere ist jedoch sehr klein. Das an allen Positionen der Fünfringe methylsubstituierte Decamethylferrocen [Cp(CH3)5]2Fe realisiert hingegen im Kristall und in der Gasphase die gestaffelte Konformation. In Cobaltocen Cp2Co und Nickelocen Cp2Ni stehen die Cp-Fünfringe auf Lücke (gestaffelt).
Verwendung
Ferrocen kann Heizöl (einzelnen Premiumheizölqualitäten) und theoretisch auch Diesel beigemischt werden, um eine bessere Sauerstoffbindung und somit eine effektivere und sauberere Verbrennung zu erreichen. Die Verbrennungstemperatur des Öls wird durch das Additiv nicht erhöht. Substituierte Ferrocene dienen als Monomere für die Herstellung von Polyferrocenen.
In der Cyclovoltammetrie wird Ferrocen wegen seiner reversiblen Oxidation zum Ferrocenium-Ion oft als Referenzsubstanz (E0 = 0,400 V gegen eine Wasserstoffelektrode)[14][15] in nicht wässrigen Lösungen verwendet. Diese Verwendung geht auf eine um 1960 aufgestellte Hypothese von Stehlow zurück, die besagt, dass Ferrocen gut für den Vergleich von Redoxpotentialen in verschiedenen organischen Lösungsmitteln geeignet ist, weil der elektrostatische Anteil der Solvatationsenthalpie des Ferricenium-Ions sehr klein ist und deshalb die freie Solvatationsenthalpie des Ferrocen-Moleküls der des Ferrocenium-Ions sehr ähnlich ist. Gleiches gilt für das Cobaltocen/Cobaltocenium-System, so dass das Redoxpotential des Cobaltocens in vielen verschiedenen Lösungsmitteln einen Wert von −1,32 V vs. Fc annimmt. Aus diesem Grund wurde Ferrocen neben Bis(benzol)chrom 1984 als IUPAC-Potentialstandard für die Angabe von Potentialen in organischen Lösungsmitteln festgelegt.[16] Problematisch ist allerdings die Umrechnung von Redoxpotentialen, die mit Ferrocen kalibriert wurden, auf die Potentialskala der SHE in wässriger Phase, da für das Redoxpotential (Fc vs. SHE) viele sehr verschiedene Werte in der Literatur existieren. Der Grund für diese stark schwankenden Angaben ist die Unlöslichkeit von Ferrocen in wässriger Phase, die Realisierung der SHE in organischer Phase und die intrinsische Unmöglichkeit der genauen potentiostatischen Messung von Redoxpotentialen zwischen Halbzellen, die mit unterschiedlichen Elektrolytsystemen befüllt sind, da die anionischen und kationischen Verteilungskoeffizienten nicht unabhängig voneinander bestimmbar sind und deshalb der Spannungsabfall, der an der Grenzfläche auftritt, unbekannt ist.
Neuere Arbeiten verweisen auf vorteilhafte Eigenschaften des Decamethylferrocens als Referenzsystem in organischer Phase, da dieses ähnlich wie Bisbiphenylchrom eine größere Abschirmung gegen das Lösungsmittel besitzt.[17] Die Abhängigkeit des Redoxpotentials vom Lösungsmittel ist noch geringer einzuschätzen als beim Ferrocen/Ferricenium-System, da aber Decamethylferrocen ebenso unlöslich in Wasser ist wie Ferrocen, liefert auch dieser Ansatz keine zufriedenstellende Lösung der Probleme beim Vergleich von Redoxpotentialen in wässriger und organischer Phase.
Seit den 1990er-Jahren werden Ferrocen-Derivate als Medikamente untersucht, vor allem als Zytostatika und Antimalariamittel.[18]
Im Gegensatz zu Decamethylferrocen bildet Ferrocen kein stabiles, isolierbares Dikation.
Einzelnachweise
- Eintrag zu Ferrocen in der GESTIS-Stoffdatenbank des IFA, abgerufen am 5. März 2014. (JavaScript erforderlich)
- Eintrag zu Ferrocen. In: Römpp Online. Georg Thieme Verlag, abgerufen am 15. April 2014.
- Eintrag zu sandwich compounds. In: IUPAC (Hrsg.): Compendium of Chemical Terminology. The “Gold Book”. doi:10.1351/goldbook.S05468.
- Thomas J. Kealy, Peter L. Pauson: A New Type of Organo-Iron Compound. In: Nature. Band 168, Nr. 4285, 1951, S. 1039–1040, doi:10.1038/1681039b0.
- Samuel A. Miller, John A. Tebboth, John F. Tremaine: 114. Dicyclopentadienyliron. In: Journal of the Chemical Society. 1952, S. 632–635, doi:10.1039/JR9520000632.
- Peter L. Pauson: Ferrocene—how it all began. In: J. Organomet. Chem. 2001, S. 637–639, 3–6 (englisch, caltech.edu [PDF; 103 kB]).
- Pierre Laszlo, Roald Hoffmann: Ferrocen. Objektive Geschichte oder eine Rashomon-Erzählung? In: Angewandte Chemie. Band 112, Nr. 1, 2000, S. 127–128, doi:10.1002/(SICI)1521-3757(20000103)112:1<127::AID-ANGE127>3.0.CO;2-2.
- R. B. Woodward, M. Rosenblum, M. C. Whiting: A NEW AROMATIC SYSTEM. In: J. Am. Chem. Soc. Band 74, Nr. 13, 1952, S. 3458–3459, doi:10.1021/ja01133a543 (englisch).
- William L. Jolly: Bis(cyclopentadienyl)iron (Ferrocene). In: William L. Jolly (Hrsg.): Inorganic Syntheses. Band 11. McGraw-Hill Book Company, Inc., 1968, S. 120–122 (englisch).
- Jack D. Dunitz, Leslie Orgel, Alexander Rich: The Crystal Structure of Ferrocene. In: Acta Crystallographica. Band 9, Nr. 4, 1956, S. 373–375, doi:10.1107/S0365110X56001091.
- Norman Neill Greenwood, Alan Earnshaw: Chemie der Elemente. 1. Auflage. VCH Verlag, Weinheim 1988, ISBN 3-527-26169-9, S. 408–409.
- Paul Seiler, Jack D. Dunitz: A new interpretation of the disordered crystal structure of ferrocene. In: Acta Crystallographica Section B. Band 35, Nr. 5, 1979, S. 1068–1074, doi:10.1107/S0567740879005598.
- Paul Seiler, Jack D. Dunitz: The structure of triclinic ferrocene at 101, 123 and 148 K. In: Acta Crystallographica Section B. Band 35, Nr. 9, 1979, S. 2020–2032, doi:10.1107/S0567740879008384.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 84. Auflage. (Internet-Version: ), CRC Press/Taylor and Francis, Boca Raton, FL, Physical constants of organic compounds, S. 3-282 – 3-283.
- H.-M. Koepp, H. Wendt, H. Stkehlow: Der Vergleich der Spannungsreihen in verschiedenen Solventien. II. In: Zeitschrift für Elektrochemie, Berichte der Bunsengesellschaft für physikalische Chemie, Band 64, Nr. 4, S. 483–491, Juni 1960. doi:10.1002/bbpc.19600640406 (zurzeit nicht erreichbar).
- Gerhard Gritzner, Jaroslav Kůta: Recommendations on reporting electrode potentials in nonaqueous solvents. Recommendations 1983. In: Pure and Applied Chemistry. Band 56, Nr. 4, 1984, S. 461–466 (iupac.org [PDF]). PDF (Memento des Originals vom 5. März 2014 im Internet Archive) Info: Der Archivlink wurde automatisch eingesetzt und noch nicht geprüft. Bitte prüfe Original- und Archivlink gemäß Anleitung und entferne dann diesen Hinweis.
- Indra Noviandri, Kylie N. Brown, Douglas S. Fleming, Peter T. Gulyas, Peter A. Lay, Anthony F. Masters, Leonidas Phillips: The Decamethylferrocenium/Decamethylferrocene Redox Couple: A Superior Redox Standard to the Ferrocenium/Ferrocene Redox Couple for Studying Solvent Effects on the Thermodynamics of Electron Transfer. In: The Journal of Physical Chemistry. Band 103, Nr. 32, 1999, S. 6713–6722, doi:10.1021/jp991381+.
- Malay Patra, Gilles Gasser: The medicinal chemistry of ferrocene and its derivatives. In: Nature Reviews Chemistry. Band 1, Nr. 9, 6. September 2017, ISSN 2397-3358, S. 1–12, doi:10.1038/s41570-017-0066 (nature.com [abgerufen am 12. Juni 2020]).


