Berliner Blau
Berliner Blau ist ein lichtechtes, tiefblaues, anorganisches Pigment, das als luft- und wasserstabiler Feststoff vorliegt. Es handelt sich um eine metallorganische Verbindung, in der Eisenionen in den Oxidationsstufen +2 und +3 vorliegen und über das Cyanid-Anion ([C≡N]−) verbunden sind. Das wesentliche Strukturelement des Berliner Blaus ist die Sequenz Fe(II)-[C≡N]-Fe(III) in einem dreidimensionalen, polymeren Gerüst.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
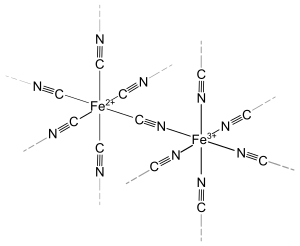 | ||||||||||||||||||||||
| wesentliches Strukturelement des Berliner Blaus (ohne Gegenionen oder Wassermoleküle) | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Berliner Blau | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | Fe4[Fe(CN)6]3 | |||||||||||||||||||||
| Kurzbeschreibung |
dunkelblauer, geruchloser Feststoff[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
V03AB31 | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 859,23 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Dichte | ||||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
praktisch unlöslich in Wasser[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Berliner Blau kommt in einer als „unlöslich“ und einer als „löslich“ bezeichneten Form vor, wobei die Struktur der beiden gleich ist. Die allgemeine Summenformel lautet Mnm+[Fe(III)Fe(II)(CN)6]3 · 15 H2O. Es handelt sich um ein kubisch flächenzentriertes Gitter, in dem beim löslichen Berliner Blau Alkali- oder Ammoniumionen die Plätze in den Oktaederlücken des Gitters einnehmen (M = Na, K, NH4, n = 3, m = 1) und der Ladungskompensation des Komplexes dienen, beim unlöslichen Berliner Blau übernehmen Eisen(III)-Ionen diese Funktion (M = Fe, n = 1, m = 3). Dabei liegen die löslichen Varianten in wässriger Lösung in Form kolloidaler Lösungen vor, es handelt sich nicht um eine echte Löslichkeit unter Dissoziation der Verbindung.
Der Berliner Farbenhersteller Johann Jacob Diesbach stellte um 1706 erstmals Berliner Blau her. Es erlangte sofort kommerzielle Bedeutung als Pigment für die Ölmalerei und die Färbung von Stoffen. Durch die Veröffentlichung der Rezeptur im Jahr 1724 nahmen mehrere Firmen die Herstellung von Berliner Blau unter vielen weiteren Namen auf.
Berliner Blau gilt als die erste synthetische Koordinationsverbindung. Seine tiefblaue Farbe verdankt es Metall-Metall-Charge-Transfer-Übergängen, die im gelb-roten Bereich Strahlung absorbieren und das blaue Licht als Komplementärfarbe reflektieren.
Die Namen Blausäure und Cyanid (von altgriechisch κυανός kyanos „dunkelblau“) leiten sich von der Farbe des Berliner Blaus ab. Die Bezeichnung Prussiate, bei denen ein Cyanoligand im Komplex durch einen anderen Liganden ersetzt ist, etwa Nitroprussid, leitet sich von der Bezeichnung Preußischblau ab. Berliner Blau ist der Namensgeber für die sogenannten Berliner-Blau-Analoga, eine Klasse mikroporöser anorganischer Feststoffe mit einer breiten Palette von katalytischen, elektronischen, optischen und magnetischen Eigenschaften. Auch über dreihundert Jahre nach der Erstsynthese ist Berliner Blau ein Forschungsobjekt, über das in jedem Jahr viele wissenschaftliche Artikel veröffentlicht werden.
Aufgrund seiner einfachen Herstellung aus einer Lösung von Eisen(III)-Salz und gelbem Blutlaugensalz wird es vorwiegend als preiswertes Farbmittel verwendet. Berliner Blau ist praktisch ungiftig und wird als Gegenmittel bei Vergiftungen mit radioaktivem Caesium oder Thallium eingesetzt. Die Therapie nutzt die Ionenaustauscheigenschaften und die hohe Affinität der Verbindung für bestimmte Metallkationen. Es steht auf der Liste der unentbehrlichen Arzneimittel der Weltgesundheitsorganisation, die in einem Gesundheitssystem benötigt werden.
Nomenklatur
Berliner Blau wurde unter vielfältigen Bezeichnungen angeboten. Die Bezeichnungen nehmen Bezug auf die Namen der Erfinder oder Hersteller, die Herstellungsorte, die Farbnuancen, die Anwendungen oder die chemischen Komponenten und Verfahren. Die Varianten können sich im Farbstich unterscheiden.[4] Alle Namen bezeichnen blaue Pigmente auf Basis des Fe(II)/Fe(III)-Cyanokomplexes und unterscheiden sich in ihrer Zusammensetzung nur unwesentlich. Die Art und Menge der verwendeten Alkalimetall- oder Ammoniumionen beeinflusst die Hervorbringung bestimmter Farbnuancen.[5] Historisch wurde das Pigment als Blausalz in den Handel gebracht.[6] Im Colour Index wird Berliner Blau als C.I. Pigment Blue 27 nach der Farbe und nach der Struktur als C. I. 77510 für kaliumdotiertes Eisenblau beziehungsweise C.I. 77520 für das Ammonium-Natrium-Eisenblau geführt.[7]
Diesbachblau ist nach dem Namen des eigentlichen Erfinders benannt. Turnbulls Blau wurde 1828 durch John Turnbull jr. entwickelt und über die schottische Firma Turnbull & Ramsay in Glasgow vertrieben.[8] Es handelt sich bei Turnbulls Blau um ein aus rotem Blutlaugensalz mit überschüssigen Eisen(II)-Ionen gebildetes Blaupigment. Die Gewinnung erfolgt durch das Umsetzen von Eisen(II)-Salzen mit Kaliumhexacyanidoferrat(III) in wässriger Lösung. Zunächst wurde angenommen, dass der sich bildende dunkelblaue Niederschlag eine andere Zusammensetzung als das durch Umsetzen von Eisen(III)-Salzen mit Kaliumhexacyanidoferrat(II) (gelbes Blutlaugensalz) gewonnene Berliner Blau aufwies. Mittels EPR- und Mößbauerspektroskopie konnte jedoch festgestellt werden, dass die Reaktionsprodukte weitgehend identisch sind, da folgendes Gleichgewicht besteht:[9][10][11]
Miloriblau bezeichnet gekochte Sorten des Pigments, die einen etwas wärmeren rotstichigen Farbton aufweisen und erstmals von der Firma Milori de France hergestellt wurden. Diese hatte nach Diesbach ein Blaupigment auf einem anderen Verfahrensweg gewonnen, das im Vergleich zum Preußischblau etwas schwächer in seiner Farbstärke ist. Der Name Miloriblau hat sich bis heute erhalten. Vossenblau wurde nach der L. Vossen & Co G.m.b.H. bei Düsseldorf benannt, die ab 1905 exklusiv den Vertrieb durchführte.
Französischblau oder Pariser Blau bezieht sich auf den Firmensitz der Firma A. Milori. Preußisch Blau, auch Preußischblau, sowie Zwickauer Blau beziehen sich ebenfalls auf Produktionsstandorte.
Der Name Bronzeblau bezieht sich auf den bronzierenden roten Farbstich, der sich bei verschiedenen Bindemitteln zeigt. Insbesondere bezieht sich Bronzeblau auf den rötlichen Glanz der ungemahlenen, schwarzblauen Brocken.[12]
Chinesisch Blau oder Chinablau hat seinen Namen von dekorativem Porzellan. Diese Produktionsvariante des Pigmentes ergibt die reinsten und brillantesten Farbtöne mit einem Grünstich. Es ergibt den besten Vollton und die höchste Deckkraft, allerdings hat es die härteste Struktur und den höchsten Ölbedarf. Sächsischblau bezieht sich auf die Farbe der Uniformen der sächsischen Armee, die mit Berliner Blau gefärbt wurden. Tonerblau oder Tintenblau bekam diesen Namen wegen der Nutzung zum Abtönen des rötlichen (braunen) Farbstichs von Ruß.
Aus der Struktur beziehungsweise Zusammensetzung des Pigments leiten sich die Namen Eisenblau, Eisencyanblau, Eisenhexacyanidoferrat, Stahlblau, Eisencyanürcyanid, Ferrozyanblau und Ferriferrocyanidblau sowie Stahlblau ab. Pottascheblau bezieht sich auf die Verwendung von Pottasche bei der Herstellung. Bis zum Ersten Weltkrieg war das Kation des Komplexsalzes vorwiegend Kalium. Als zu Beginn des 20. Jahrhunderts der Preis von Pottasche stark anstieg, wurde das Ammoniumsalz mit gleich guten Eigenschaften hergestellt. Eisenblau bezeichnet auch ein altertümliches Pigment aus dem Mineral Vivianit.
Luisenblau, Modeblau, Wasserblau sind Produktnamen für abgewandelte Farbmittel in der Textilfärberei und mögen als Namen für Modefarben entstanden sein. Das rotstichigste Pigment ist Miloriblau, die grünstichigste Variante ist das Chinesisch Blau.
Im französischen Sprachraum sind die Bezeichnungen Bleu de prusse oder Bleu de Milori geläufig, im englischen Sprachraum die Bezeichnungen iron blue, toning blue oder Prussian blue.
Geschichte
Erste Synthesen

Wahrscheinlich um 1706 stellte Johann Jacob Diesbach, ein Berliner Farbenhersteller, erstmals Berliner Blau her.[13][14] Die früheste bekannte schriftliche Nennung des Pigments erfolgt in einem Brief vom 31. März 1708, von Johann Leonhard Frisch an Gottfried Wilhelm Leibniz, den Präsidenten der Preußischen Akademie der Wissenschaften.[15] Im August 1709 benannte er das Pigment als Preußisch blau, im November desselben Jahres änderte er die Bezeichnung in Berlinisch Blau.[15] Frisch war verantwortlich für die frühe Vermarktung des Pigments. Er behauptete von sich, das Pigment durch eine Säurebehandlung verbessert zu haben. Frisch ist der Verfasser der ersten Publikation zum Berliner Blau in Notitia Coerulei Berolinensis nuper inventi von 1710.[16] Diesbach stand etwa ab 1701 in Frischs Diensten.
Neben Diesbach wird Johann Konrad Dippel mit der Erfindung in Verbindung gebracht. Wie verlässlich die entsprechende Angabe durch Georg Ernst Stahl und die damit verbundene Geschichte der ersten zufälligen Herstellung des Pigments ist, kann heute schlecht beurteilt werden. Demnach war Diesbach mit der Herstellung eines roten Farbstoffs beschäftigt, als ihm die Pottasche (Kaliumcarbonat) zur Ausfällung des Farbstoffs ausging. Von seinem Kollegen Johann Konrad Dippel ließ er sich deshalb einen Ersatzstoff geben (verunreinigt mit „Dippels Tieröl“), der jedoch entgegen seinen Erwartungen ein blaues Pigment ausfällte.[17] Das Rezept konnte einige Zeit geheim gehalten werden, bis es schließlich der Engländer John Woodward 1724 in den Philosophical Transactions veröffentlichte.[18][19] Die Informationen dazu hatte er vom Berliner Apotheker Caspar Neumann.[20]
Verwendung in der Malerei und Textilfärbung
Berliner Blau diente anfangs als Pigment für Kunstmaler, die damit das relativ teure Ultramarin aus Lapislazuli ersetzten.[21] Das 1709 durch Pieter van der Werff in Rotterdam geschaffene Gemälde „Die Grablegung Christi“ (Bildergalerie Sanssouci, Potsdam) stellt den frühesten bisher bekannten Nachweis der Verwendung des Pigments in der Malerei dar. Um 1710 wurde es von Malern am Preußischen Hof vielfach genutzt und erreichte Paris, wo es durch Antoine Watteau und später von seinen Nachfolgern Nicolas Lancret und Jean-Baptiste Pater verwendet wurde.[13]
Ein von Pierre-Joseph Macquer entwickeltes Färbeverfahren, wobei das Berliner Blau mittels Gelben Blutlaugensalzes direkt auf der Woll-, Baumwoll- oder Seidenfaser abgeschieden wurde, verbesserte die Farbechtheit erheblich und führte ab den 1760er Jahren zu einem Aufschwung der Berliner-Blau-Produktion.[21] Die Erfindung verschaffte Macquer die Berufung zum Generalinspektor der Färbereien. Die erhöhte Nachfrage führte zwischen 1756 und 1799 zur Gründung von elf Berliner-Blau-Fabriken in Deutschland.[21] Die Fabriken deckten ihren Energiebedarf und die Versorgung mit Pottasche weitgehend durch die Verbrennung von Holz. Die Verarbeitung von tierischen Abfällen ging mit einer Geruchsbelästigung einher, die einen gewissen Abstand zur Wohnbebauung erforderte. Daher lagen diese Fabriken oft in der Nähe von Wäldern.[21] Damit begann Mitte des 18. Jahrhunderts die anorganisch-chemische Produktion in Deutschland. Die industrielle Produktion von Berliner Blau beschrieb Theodor Fontane in seinem Roman Frau Jenny Treibel, eine Berliner Familie, die im Besitz großer Fabriken zur Produktion von Berliner Blau war. Vorbild dieser Literaturgestalt ist die Unternehmerfamilie Kunheim (Chemische Fabriken Kunheim u. Co. AG und ab 1925 Rhenania-Kunheim-Verein Chemischer Fabriken AG), mit der Fontanes Schwester Jenny Sommerfeld befreundet war.[22]
Die Herstellung erfolgte unter weitgehendem Luftausschluss durch Pyrolyse stickstoffhaltiger tierischer Produkte wie Blut, Klauen oder Wolle in einer Schmelze von Pottasche bei einer Temperatur von etwa 900 bis 1000 °C in eisernen Gefäßen. Dabei bildete sich das Zielprodukt Kaliumcyanid, freigesetztes Ammoniak konnte zu Salmiak oder Hirschhornsalz weiter verarbeitet werden. Die Schmelze wurde in Wasser gelöst, wobei das Kaliumcyanid mit dem als Nebenprodukt vorhandenen Eisen(II)-sulfid zu gelbem Blutlaugensalz reagierte.[21]
Export
Die Schwedische Ostindien-Kompanie exportierte 1759 zunächst geringe Mengen Berliner Blaus nach China und Indien. Ab 1775 wurden größere Mengen nach China exportiert und zehn Jahre später hatte sich der Export bereits vervierfacht.[23]
Gegen Ende des 18. Jahrhunderts wurde Berliner Blau von Holländern und Chinesen nach Japan exportiert, wo es Bero, Bero-Ai oder Beroin genannt wurde und im traditionellen japanischen Farbholzschnitt verwendet wurde. Die Japaner stoppten 1810 den Import aus China. Die Niederländer nahmen den Handel 1818, die Chinesen 1824 wieder auf.[23] Berliner Blau lässt sich auf zwei japanischen Gemälden der Edo-Zeit, davon eines aus den 1760er Jahren und das andere aus dem Jahr 1817, nachweisen.[23] Bekannte Werke wie die von Katsushika Hokusai ab 1830 geschaffene Serie 36 Ansichten des Berges Fuji verwenden oft Berliner Blau.[24]
Moderne Entwicklungen
Der deutsche Pharmakologe Horst Heydlauf untersuchte 1968 die Wirkung von Berliner Blau als Mittel gegen Thalliumvergiftungen. Heydlauf zeigte, dass die Thalliumionen in das Gitter von Berliner Blau eingelagert werden und so vom Körper ausgeschieden werden können. Die Wirksamkeit wurde seitdem umfassend bestätigt.[25] Der gleiche Effekt zeigte sich auch für Caesiumionen. Zum Einsatz von Berliner Blau als Gegenmittel kam es 1987 in Brasilien, als beim Goiânia-Unfall etwa 250 Personen mit radioaktivem Caesium-137 kontaminiert wurden, das aus einem entwendeten Strahlentherapiegerät eines stillgelegten Krankenhauses herausgebrochen worden war. Die Ärzte behandelten 29 stark kontaminierte Personen mit Berliner Blau, von denen 25 die Caesiumvergiftung überlebten.[26]
Von Holocaustleugnern wurde in den 1980er und 1990er Jahren behauptet, dass das Fehlen von Eisenblau in den Gaskammern des KZ Auschwitz-Birkenau ein Beweis dafür wäre, dass dort keine Menschen mittels Zyklon B getötet wurden. Der Chemiker Richard Green stellte fest, dass in den dafür vorgelegten Gutachten wesentliche Einflüsse auf die Bildung von Eisenblau nicht beachtet wurden.[27] Des Weiteren waren mit einer präzise kalibrierten Methode lösliche Cyanide in den Gaskammern nachweisbar. Vergleichsproben aus nicht begasten Gebäuden im KZ Auschwitz-Birkenau enthielten diese Cyanide nicht.[28]
Moderne Forschungsrichtungen beinhalten unter anderem mit anderen Übergangsmetallen dotierte Analoga von Berliner Blau, deren magnetische und elektrochemische Eigenschaften, ihre Fähigkeit als Gasspeicher zu wirken, oder deren Ionenaustauscheigenschaften. Des Weiteren wird der Einsatz anderer Liganden untersucht wie etwa Dicyanamid oder größere Polycyanospezies wie Tetracyanochinodimethan.[29]
Vorkommen
Berliner Blau gilt als das erste moderne Pigment, das in dieser Form nicht in der Natur vorkommt. Einer der Hauptbestandteile, das Kaliumhexacyanidoferrat(II), kommt dagegen als seltenes Mineral Kafehydrocyanit vor.[30]
Gewinnung und Darstellung

Die Herstellung erfolgt, indem eine Lösung von Kaliumhexacyanidoferrat(II) mit einem in Wasser gelösten Eisen(III)-Salz oder eine Lösung von Kaliumhexacyanidoferrat(III) mit einem in Wasser gelösten Eisen(II)-Salz versetzt wird. So entsteht in beiden Fällen bei einem Molverhältnis von 1:1 das gleiche kolloidal gelöste „lösliche Berliner Blau“ („lösliches Turnbulls Blau“).[5]
Erst bei Zugabe überschüssiger Eisen(III)- oder Eisen(II)-Ionen bildet sich ein blauer Niederschlag, der als „unlösliches Berliner Blau“ oder „unlösliches Turnbulls Blau“[5]
bezeichnet wird und als Farbpigment verwendet werden kann. Der Partikeldurchmesser liegt je nach Herstellungsverfahren zwischen 0,01 und 0,2 μm.[9] Die intensive blaue Farbe entsteht durch den Charge-Transfer-Übergang zwischen den Fe2+- und den Fe3+-Ionen.[31]
Industrielle Produktion
Die direkte Reaktion wird in der Pigmentproduktion seltener benutzt. Dieser Reaktionsweg wird meist für die Herstellung von Präparaten genutzt. Eisen- und Hexacyanidoferrat-Ionen werden in Wasser vermischt.
Zunächst fällt kolloidales Berliner Blau aus, mit einem Überschuss von Eisenionen bildet sich Berliner Blau.
Die industrielle Produktion nutzt den indirekten Weg über den Umsatz zum sogenannten Berliner Weiß. Häufiger werden statt der kaliumhaltigen Rohstoffe die Ammoniumsalze genutzt.[5]
Das erhaltene Berliner Weiß, der sogenannte Weißteig, wird mit Schwefelsäure bei 75–100 °C ausgezogen und mit Natriumdichromat oder Natriumchlorat oxidiert.[9]
Das Produkt wird gewaschen und gefiltert oder abgepresst und bei 15 bis 30 °C getrocknet. Anschließend wird das Pigment auf die erforderliche Korngröße ausgerieben und verpackt. Das fertige Produkt enthält noch 4–7 % absorbiertes und hydratisiertes Wasser. Das sehr fein gemahlene Herstellungsergebnis ist das gut in Wasser dispergierbare und beständige „lösliche“ Berliner Blau. Unterschiedliche Nachbehandlungen ergeben eine breite Produktpalette für die angestrebten Einsatzzwecke. Eine weitere Behandlung mit anionischen, nichtionischen oder kationischen Tensiden kann zu einer drastischen Änderung von Ölbedarf, Struktur und Glanz führen.
Für das Pigment Berliner Blau werden bei der Bildung noch weitere Substanzen, wie Kaliumchlorid zugesetzt. Diese Substanzen beeinflussen die Fällung physikalisch und bilden im Filterkuchen lösliche Salze. Dadurch bilden sich keine kompakten Agglomerate. Für die Anwendung als Farbpigment sollte das anorganische Produkt „weich“ sein, mit diesem Fachbegriff ist feinkörnig gemeint. Ein „weiches“ Pigment lässt sich im Bindemittel leichter dispergieren.
Mitte der 1980er Jahre erreichte die Jahresproduktion von Berliner Blau in der westlichen Welt mit etwa 50.000 Tonnen pro Jahr einen Höhepunkt.[5] Im Jahr 2012 betrug die Weltjahresproduktion nur etwa 10.000 Tonnen.[32]
Historische Verfahren
Bei der Methode nach Diesbach werden Cochenilleschildläuse in Alaun und Eisensulfat gekocht. Anschließend wird das Pigment mit „Dippels Tieröl“ ausgefällt. Beim sogenannten Englischen Rezept werden gleiche Teile von Kaliumnitrat (Salpeter) und Kaliumtartrat (Backtriebmittel) in einem Schmelztiegel erhitzt. Nach Zugabe von getrocknetem Tierblut wird die Mischung weiter erhitzt. Die entstandene Masse wird mit Wasser gewaschen und mit Alaun und Eisensulfat vermischt. Eine Endbehandlung mit Salzsäure verändert die zunächst grünliche Farbe in tiefes Blau.[33]
Eigenschaften
Physikalische Eigenschaften
Unter Inertgasatmosphäre zersetzt sich Berliner Blau beim Erhitzen über die Stufen der Dehydratisierung, gefolgt von einer Änderung der Kristallstruktur und anschließender Zersetzung. Bei 400 °C bildet sich eine monokline Berliner-Blau-Phase, bei höheren Temperaturen bilden sich verschiedene Eisencarbide. Bei Temperaturen über 700 °C zersetzen sich die Eisencarbide zu Zementit (Fe3C), metallischem Eisen und Graphit.[34]
Durch Kristallstrukturanalyse konnte die Kristallstruktur des Berliner Blaus bestimmt werden. Dabei zeigte sich, dass das Wasser zum Teil koordiniert vorliegt, zum Teil in der Käfigstruktur des Berliner Blau eingelagert ist.[35] Bei einer Temperatur von 5,6 K findet im Berliner Blau ein ferromagnetischer Phasenübergang statt.[36]
Chemische Eigenschaften
Gegenüber schwachen Säuren ist Berliner Blau stabil. Der Cyanoferratkomplex wird wegen des geringen Löslichkeitsproduktes nicht zerstört und Cyanid-Ionen werden nicht freigesetzt, so dass keine freie Blausäure entsteht.
Durch Laugen wird das Pigment angegriffen, es bildet sich festes braunes Eisen(III)oxid-hydroxid und gelöstes Hexacyanidoferrat. Deshalb wird dieses Blaupigment nicht für Freskenmalereien eingesetzt.[37]
Berliner Blau wird als die erste Koordinationsverbindung bezeichnet.[38] Das wesentliche Strukturelement des Berliner Blau ist die Sequenz Fe(III)-NC-Fe(II) in einem dreidimensionalen polymerem Gerüst. Die Zuordnung der Oxidationsstufen Fe(II) zu einem Kohlenstoffoktaeder und Fe(III) zu einer Stickstoff-Wasser-Umgebung wurde durch eine Vielzahl von Infrarot-, Photoelektronen- und Mößbauerspektroskopischen Untersuchungen sowie Neutronenstreuungsstudien eindeutig nachgewiesen.[39][40] Die Struktur besteht aus den Einheiten 3 Fe(II)C6, Fe(III)N6 und 3 Fe(III)N4O2.[41] Der mittleren Abstand für Fe(II)–C wurde durch Röntgenstrukturanalyse mit 192 pm, der C–N-Abstand mit 113 pm und der Fe(III)–N-Abstand mit 203 pm bestimmt.[35]
Elektronische Eigenschaften
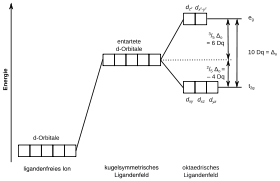
Die intensive blaue Farbe des Berliner Blau ist bedingt durch sogenannte Metall-Metall-Charge-Transfer-Übergänge.[42] Cyanid ist ein Ligand, der eine starke Ligandenfeldaufspaltung erzeugt und damit bei den Eisen(II)-Ionen im Gitter zur Ausbildung einer low-spin-Konfiguration mit Fe2+ (t2g)6(eg)0 und einem Gesamtspin von S = 0 führt.[43]
Der Isocyanid-Ligand der Eisen(III)-Ionen führt zu einer schwächeren Ligandenfeldaufspaltung. Durch die Messung der magnetischen Suszeptibilität wurde nachgewiesen, dass die Fe(III)-Ionen in einer high-spin-Konfiguration Fe3+(t2g)3(eg)2 mit einem Gesamtspin von S = 5/2 vorliegen.[43]
Durch Absorption von Licht erfolgt ein Übergang vom t2g-Orbital des Eisen(II) auf die t2g- und eg-Orbitale des Eisen(III).[31] Die erforderliche absorbierte Energie dafür liegt im rot-gelben Bereich, das blaue Licht wird als Komplementärfarbe reflektiert.
Verwendung
Farbmittel
Die größten Mengen von Berliner Blau werden für chemische Beschichtungen, für Druckfarben (als ISO-Blau), Kohlepapier und in der Kunststoffindustrie eingesetzt. Eine geringere Menge wird bei der Papierherstellung zum Bläuen (Verringerung eines Gelbstiches) verwendet.[44] In seinem Vollton ergibt dieses Pigment einen sehr dunklen, fast schwarzen Farbton; in dieser Form besitzt es eine Bedeutung für transparente Finishs auf Metallfolien, auch für Blechdruckfarben. Besonders geeignet ist die Eigenschaft im Zusammenhang mit Aluminiumpulver für glänzende Oberflächenbehandlungen. Berliner Blau wird als echtes Farbmittel zu Füllhaltertinten benutzt. Für die Kunststoffeinfärbung hat sich Berliner Blau sehr bei der Färbung von ND- und HD-Polyethylen bewährt.[26] Bei der Papierherstellung werden wasserdispergierbare Typen allgemein eingesetzt, die als lösliches Eisenblau bezeichnet werden.
Das Pigment hat eine hervorragende Farbechtheit. Neben seiner Brillanz besitzt es ein hervorragendes Deckvermögen und eine hohe Farbstärke. Die Lichtechtheit von reinem Berliner Blau ist gut, bei gering pigmentierten Pastelltönen, etwa durch das Mischen mit einem weißen Pigment wie Bleiweiß oder Zinkoxid, verblasst es stark. Spektroskopische Untersuchungen führen diese Verblassung auf eine Reduktion der Eisen(III)-Ionen an der Oberfläche des Pigments durch Belichtung zurück.[45]
Es blutet weder in Wasser, Ethanol oder Methylethylketon noch in unpolaren Mineralölen, Di-n-octylphthalat oder Leinölfirnis. Allerdings besitzt es nur eine geringe Alkalienbeständigkeit und ist gegen Säuren nur mäßig beständig. Die Wetterbeständigkeit ist stark von der Rezeptierung bestimmt.
Textilfärbung
Das Färben von Wolle, Baumwolle, Seide und Leinen wurde in zwei Schritten durchgeführt. Zunächst wurden die Textilien dazu mit einem Eisen(III)-Salz gebeizt. Dazu wurde oft Eisen(III)-sulfat mit verdünnter Salpetersäure in Wasser aufgelöst und die Textilien mehrere Stunden in der Beize gekocht. Durch diesen Vorgang zogen Eisen(III)-Ionen auf die Faser. Im zweiten Schritt wurden die Textilien in einer Lösung von gelben Blutlaugen gefärbt. Seide wurde mit einer ammoniakalischen Lösung nachbehandelt.[46]
Kunst
Berliner Blau wird aufgrund seines feinen Korns und der daraus resultierenden Lasierfähigkeit sowie seiner großen Farbstärke bis heute für Aquarell-, Öl- und Druckfarben verwendet. In der Wandmalerei indes ist es unbrauchbar, da es durch die Bildung von Eisenoxiden rasch verbraunt. Maler wie Gainsborough, Canaletto aber auch Impressionisten wie Monet oder Expressionisten wie Munch verwendeten es in der Ölmalerei.[47][48] Maler am preußischen Hof, in Rotterdam und Paris verwendeten Berliner Blau bereits 1710 in großem Umfang. Das Gemälde Die Grablegung Christi von Pieter van der Werff aus dem Jahr 1709 gilt als das älteste Gemälde, bei dem Berliner Blau verwendet wurde.[14]
Die Farbe wurde in der späten Edo-Zeit im japanischen Farbholzschnitt beliebt. Bekannt ist vor allem das von Katsushika Hokusai geschaffene Werk Die große Welle vor Kanagawa.
.jpg.webp)
 Sternennacht (van Gogh)
Sternennacht (van Gogh) Seerosen
Seerosen Sternennacht (Munch)
Sternennacht (Munch)
Das Pigment lässt sich ausreichend dispergieren und besitzt eine gute Hitzeechtheit. Abhängig von der Anwendung beträgt der Ölbedarf des Pigments zwischen 70 und 120 kg Öl für 100 kg Pigment.[4] Da alle diese Blaupigmente aus den gleichen Rohmaterialien hergestellt werden, sind die Prozess- und Herstellungsbedingungen entscheidend für die Eigenschaften und den vorgesehenen Verwendungszweck. Eine häufige Anwendung findet Miloriblau in Kombination mit Chromgelb (C.I. Pigment Yellow 34) zum sogenannten Chromgrün. Durch die Farbstärke und Deckkraft des Berliner Blaus wird ein sehr gutes Grünpigment erhalten.
Medizin
In der Medizin wird Berliner Blau bei einigen Vergiftungen – insbesondere bei Verbindungen mit Caesium und Thallium – als Mittel zur Bindung des Giftes verwendet, welches zusammen mit dem Pigment ausgeschieden wird. Die Wirksamkeit von Berliner Blau bei einer Thalliumvergiftung wurde durch mehrere Tierstudien belegt. Obwohl es dazu wenig Erfahrungen beim Menschen gibt, gilt Berliner Blau als Medikament der Wahl bei akuten Thalliumvergiftungen.[49] Zur Wirksamen Dekorporation von Thallium muss Berliner Blau über einen längeren Zeitraum eingenommen werden.[50]
Berliner Blau wurde auch unter dem Handelsnamen Radiogardase beispielsweise nach der Nuklearkatastrophe von Tschernobyl eingesetzt, um Tiere zu dekontaminieren, die radioaktives Caesium-137 aufgenommen hatten.[51] Zum umfangreichsten Einsatz von Berliner Blau in der Geschichte der Nuklearunfälle kam es im Rahmen des Goiânia-Unfalls. Dabei wurde es sowohl zur Dekontaminierung von Menschen als auch von Oberflächen verwendet.[52] Auf Graphenschaum abgeschiedenes Berliner Blau zeigte eine 99,5%ige Entfernungseffizienz für Caesium-137 aus kontaminiertem Wasser.[53]
Intelligentes Glas
Zu den intelligenten Glastechnologien gehören elektrochrome Gläser, deren Lichtübertragungseigenschaften sich ändern, wenn Spannung angelegt wird. Berliner Blau erlaubt bei dieser Anwendung einen Farbwechsel von transparent zu intensivem blau.[54] Durch Anlegen einer Spannung an elektrisch leitenden Gläsern lässt sich Berliner Blau zum Berliner Weiß, K2[Fe(II)Fe(II)(CN)6] reduzieren und das Glas verliert seine Farbe. Durch Umpolung lässt sich der Vorgang umkehren.
Analytische Chemie
Die Reaktion zum Berliner Blau ist eine sehr empfindliche Methode für den Eisennachweis. In der analytischen Chemie ist deshalb die Berliner-Blau-Reaktion als Nachweis von Eisen (oder von Cyaniden) eine verbreitete Methode. Auf Grund der hohen Empfindlichkeit wegen der hohen Farbstärke ist diese in der Mikrochemie und als Tüpfelprobe geeignet.[55] Dieser Nachweis wird in der Pathologie als Reaktion auf Eisen genutzt, um Herzfehlerzellen oder eine Siderose zu diagnostizieren. Berliner Blau wird zum Nachweis von Hämosiderin im Urin verwendet, um die Diagnose eines Glucose-6-phosphat-Dehydrogenase-Mangels zu bestätigen.[56]
Die sogenannte Berliner-Blau-Methode dient zum Nachweis von Gesamtphenolen. Dabei wird rotes Blutlaugensalz durch Phenole zum gelben Blutlaugensalz reduziert, welches mit vorhandenen freien Eisen(III)-Ionen zum Berliner Blau reagiert. Der Vergleich der Extinktion der Proben bei einer Wellenlänge von 700 nm mit einem Standard ermöglicht die Bestimmung der Gesamtphenole.[57]
Der Nachweis von Stickstoff in organischen Substanzen erfolgt durch einen Natrium-Aufschluss, wobei Natriumcyanid entsteht. Mittels nachfolgender Lassaigne-Probe, benannt nach dem französischen Chemiker Jean Louis Lassaigne, erfolgt der Nachweis des entstandenen Cyanids durch Bildung von Berliner Blau.[58]
Sonstige Anwendungen

Bei der fotografischen Drucktechnik der Cyanotypie entsteht als Pigment unter UV-Licht aus grünem Ammoniumeisen(III)-citrat und Kaliumhexacyanidoferrat(III) Berliner Blau. Das Verfahren wurde bis ins 20. Jahrhundert als einfaches Verfahren verwendet, um Kopien von technischen Zeichnungen zu erstellen, die als Blaupausen bezeichnet werden.[59] Die Technik der Blaupause wurde 1842 entdeckt. Eine erste Anwendung fand die Technik in dem Buch Photographs of British Algae: Cyanotype Impressions von Anna Atkins, einem botanischen Band, der 1844 veröffentlicht wurde und Bilder von Algen enthält.[60][61]
.jpg.webp) Cystoseire granulata
Cystoseire granulata.jpg.webp) Cystoseira foeniculacea
Cystoseira foeniculacea.jpg.webp) Fucus vesiculosus
Fucus vesiculosus
In der Metallverarbeitung und im Maschinenbau wird Berliner Blau als Paste dünn auf Metallflächen aufgetragen (tuschieren), um die Qualität geschabter Flächen beurteilen zu können.[62] Das Pigment wird heute im namensgleichen „Persischen Blausalz“ verwendet, einem Speisesalz, das als „absolut naturrein“ beworben wird, tatsächlich aber Berliner Blau enthält, das nach Ansicht der Tester von Stiftung Warentest „als Farbstoff in Lebensmitteln nichts zu suchen hat.“[63][64]
Eine weitere Anwendung ist die Sichtbarmachung von Fingerabdrücken. Dabei können auf saugenden und elektrisch leitfähige Unterlagen kathodisch Berliner Blau auf dem Spurenträger abgeschieden werden.[65]
Berliner Blau wurde als Komponente von Kirrfutter versuchsweise eingesetzt, um die Caesium-137-Belastung von Wildschweinen zu reduzieren. Diese betrug im Mittel etwa 522 Becquerel pro Kilogramm Muskelfleisch in einer Kontrollgruppe. Durch die Beifütterung mit Berliner Blau sank die Belastung um durchschnittlich 350 bis 400 Becquerel pro Kilogramm Muskelfleisch.[66]
In der Weinherstellung dient die Blauschönung der Entfernung von Metallen wie Eisen, Kupfer und Zink. Dazu wird dem Wein Kaliumhexacyanidoferrat(II) zugesetzt, welches mit vorhandenen Eisenionen zunächst zu löslichem Berliner Blau reagiert. Dieses reagiert weiter zum unlöslichen Berliner Blau, wodurch sich nach einiger Zeit ein sogenannter Blautrub absetzt.[67]
Berliner-Blau-Analoga
Die allgemeine chemische Formel für Berliner-Blau-Analoga kann als AlMn[M*m(CN)6] x H2O aufgefasst werden, wobei A einem Alkalimetall- oder Ammoniumion entspricht, M und M* stellen Übergangsmetallkationen dar. Berliner Blau und Berliner-Blau-Analoga sind poröse Koordinationspolymere, die als Strukturelement durch Cyanoliganden verbrückte Übergangsmetallionen aufweisen. Die Metallzentren M und M* weisen oft verschiedene Oxidationsstufen auf. Die Berliner-Blau-Analoga eignen sich für verschiedene Anwendungen, darunter Gasspeicherung, Batterien sowie gezielte Arzneimittelfreisetzung im Körper.[68][69][70] Der chinesische Akkumulator-Hersteller CATL hat 2021 die Serienfertigung von Natrium-Ionen-Akkumulatoren für 2023 angekündigt, die Lithium-Ionen-Akkumulatoren ersetzen könnten und bei deren Herstellung Berliner Blau eine entscheidende Rolle spielt.[71]
Super-Berliner-Blau
Durch die Ersetzung von Eisen(III) durch ein Ion wie das Trimethylzinnion ((CH3)3Sn+) wird ein metallorganisches Polymer erhalten. Der Abstand zwischen den Eisen(II)-Ionen beträgt dabei etwa ein Nanometer und ist damit doppelt so groß wie beim Berliner Blau. Die Käfiggröße beträgt damit etwa ein Kubiknanometer. Mit Ferrocen bildet Super-Berliner-Blau eine Interkalationsverbindung.[72] Das Gitter nimmt auch Gase wie Stickstoffdioxid auf und könnten damit eine industrielle Anwendung in der Rauchgasentstickung finden.[73] Die Eisencyanostruktur kann durch andere Systeme wie Rhodium(III)-Thiocyanat ([Rh(SCN)6]3-) ersetzt werden.[74]
Sicherheitshinweise
Die Resorbierbarkeit von Berliner Blau unter physiologischen Bedingungen ist außerordentlich gering, da es praktisch unlöslich in Wasser und verdünnten Säuren ist. Es ist davon auszugehen, dass weder über die Haut noch über Atemwege oder Verdauungstrakt größere Mengen aufgenommen werden. Daher kann es als praktisch untoxisch eingestuft werden. Wird es über 250 °C erwärmt, verliert der Komplex Cyanidionen, die als giftiges, gasförmiges Dicyan freigesetzt werden.[34]
Literatur
- Alexander Kraft: Berliner Blau. Vom frühneuzeitlichen Pigment zum modernen High-Tech-Material GNT-Verlag 2019, ISBN 978-3-86225-118-6.
- Hans-Peter Schramm, Bernd Hering: Historische Malmaterialien und ihre Identifizierung. o. V. Stuttgart, 1995. Reprint Ravensburg, 2000. ISBN 3-473-48067-3.
- Andreas Ludi: Prussian blue, an inorganic evergreen. In: Journal of Chemical Education, 58 (12), 1981, 1013.
- Kurt Wehlte: Werkstoffe und Techniken der Malerei. Otto Maier Verlag, Ravensburg 1967, ISBN 3-473-48359-1 (früher: ISBN 3-473-61157-3).
Weblinks
Einzelnachweise
- Eintrag zu Eisen(III)-hexacyanoferrat(II) in der GESTIS-Stoffdatenbank des IFA, abgerufen am 19. Dezember 2019. (JavaScript erforderlich)
- Franz v. Bruchhausen, Gerd Dannhardt, Siegfried Ebel, August W. Frahm, Eberhard Hackenthal, Ulrike Holzgrabe: Hagers Handbuch der Pharmazeutischen Praxis Band 8: Stoffe E-O. Springer-Verlag, 2013, ISBN 978-3-642-57994-3, S. 15 (eingeschränkte Vorschau in der Google-Buchsuche).
- Eintrag zu Prussian blue insoluble in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- Joseph A. Sisteno: Feriferrocyanide Pigments. In: Temple C. Button: Pigment Handbook. Volume I, I-C-d.
- Andreas Ludi: Berliner Blau. In: Chemie in unserer Zeit. 22, 1988, S. 123–127, doi:10.1002/ciuz.19880220403.
- Martin Hoefflmayr: Die Fabrikation des Blausalzes oder des krystallisirten Kalium-Eisen-Cyanürs im Großen. Verlag Grau, 1837, S. 49/50 (eingeschränkte Vorschau in der Google-Buchsuche).
- Berliner Blau. Eintrag im materialarchiv.ch.
- Robert Warington: On the Preparation of Prussian Blue, generally known as" Turnbull's Blue. In: Journal of the Franklin Institute, of the State of Pennsylvania, for the Promotion of the Mechanic Arts; Devoted to Mechanical and Physical Science, Civil Engineering, the Arts and Manufactures, and the Recording of American and Other Patent Inventions. 1848; S. 200.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 1649–1651.
- Jander, Blasius: Lehrbuch der analytischen und präparativen anorganischen Chemie. (13. Auflage)
- Eberhard Ehlers: Analytik I, (8. Auflage). (2012: ISBN 978-3-7692-7213-0).
- Kurt Wehlte: Werkstoffe und Techniken der Malerei. Otto Maier Verlag, Ravensburg 1967, ISBN 3-473-48359-1, S. 161 ff.
- J.Bartoll, B. Jackisch, M. Most, E. Wenders de Calisse, C. M. Vogtherr: Early Prussian Blue. Blue and green pigments in the paintings by Watteau, Lancret and Pater in the collection of Frederick II of Prussia. In: TECHNE 25, 2007, S. 39–46.
- Jens Bartoll: The Early Use of Prussian Blue in Paintings. Vortrag auf der 9th International Conference on NDT of Art, Jerusalem Israel, 25–30 Mai 2008.
- J. L. Frisch: Briefwechsel mit Gottfried Wilhelm Leibniz L. H. Fischer (Herausgeber), Berlin, Stankiewicz Buchdruck, 1896, reprint Hildesheim/New York: Georg Olms Verlag, 1976.
- Alexander Kraft: Notitia coerulei Berolinensis nuper inventi on the 300th anniversary of the first publication on Prussian blue. In: Bulletin for the history of chemistry. 36, 2011, S. 3–9.
- Georg Ernst Stahl: Experimenta, Observationes, Animadversiones, CCC Numero, Chymicae et Physicae. Berlin 1731, S. 281 ff.
- L. J. M. Coleby: A history of Prussian blue, In: Annals of Science, 1939, S. 206–211, doi:10.1080/00033793900201211.
- John Woodward: IV. Præparatio cærulei prussiaci ex germaniâ missa ad Johannem Woodward, MD Prof. Med. Gresh. RS S. In: Philosophical Transactions of the Royal Society. 33, Nr. 381, doi:10.1098/rstl.1724.0005 1724, S. 15–17 (royalsocietypublishing.org PDF).
- Alexander Kraft On two letters from Caspar Neumann to John Woodward revealing the secret method for preparation of prussian blue. In: Bulletin History Chemistry. Band 34, 2009, Heft 2, S. 134–140 (illinois.edu PDF).
- Holger Andreas: „Cyan-Industrie“–Anfänge einer Chemischen Industrie in Deutschland im 18. Jahrhundert. In: Mitteilungen der GDCh-Fachgruppe Geschichte der Chemie, Frankfurt/Main, Bd. 25, 2017, ISSN 0934-8506, S. 47–56.
- Hans Soost: Berliner Blau aus der Firma Kunheim. In: Berlinische Monatsschrift (Luisenstädtischer Bildungsverein). Heft 7, 2000, ISSN 0944-5560, S. 24–29 (luise-berlin.de).
- Katherine Eremin u. a.: Examination of pigments on Thai manuscripts: the first identification of copper citrate. In: Journal of Raman Spectroscopy. 39, 2008, S. 1057–1065, doi:10.1002/jrs.1985.
- A. Mounier u. a.: Red and blue colours on 18th–19th century Japanese woodblock prints: In situ analyses by spectrofluorimetry and complementary non-invasive spectroscopic methods. In: Microchemical Journal. 140, 2018, S. 129–141, doi:10.1016/j.microc.2018.04.023.
- Horst Heydlauf: Tierexperimentelle Untersuchungen zur Therapie der Thalliumvergiftung. In: Bericht KFK 875 des Kernforschungszentrum Karlsruhe, Institut für Strahlenbiologie, 1968, 53 Seiten.
- Klaus Roth: Berliner Blau: Alte Farbe in neuem Glanz. In: Chemie in unserer Zeit. 37, S. 150–151, doi:10.1002/ciuz.200390024.
- Richard Green: Leuchter, Rudolf & the Iron Blues (Memento vom 17. Mai 2008 im Internet Archive), 31. Dezember 1998.
- Polish Report on Cyanide compounds, Auschwitz-Birkenau (Memento vom 21. Mai 2018 im Internet Archive), Nizkor Project, 1996.
- David R. Turner, Anthony S. R. Chesman u. a.: The chemistry and complexes of small cyano anions. In: Chem. Commun., 2011, 47, S. 10189–10210, doi:10.1039/c1cc11909e.
- Webmineral - Kafehydrocyanite.
- E. A. Moore, Rob Janes: Metal-Ligand Bonding. Royal Society of Chemistry, 2004, ISBN 978-0-85404-979-0, S. 81–82.
- Alexander Kraft: Wege des Wissens: Berliner Blau, 1706–1726. In: Mitteilungen der GDCh-Fachgruppe Geschichte der Chemie, 22 (2012), S. 3–19.
- Colin Mackenzie: Fünftausend neue englische Rezepte für alle Vorfälle des Lebens oder neue vollständige Hausbibliothek, Band 2, J. B. Meßnersche Buchhandlung, Stuttgart, 1825, S. 79–81.
- Claudia Aparicio, Libor Machala, Zdenek Marusak: Thermal decomposition of Prussian blue under inert atmosphere. In: Journal of Thermal Analysis and Calorimetry. 110, 2012, S. 661–669, doi:10.1007/s10973-011-1890-1.
- H. J. Buser, D. Schwarzenbach, W. Petter, A. Ludi: The crystal structure of Prussian Blue: Fe4[Fe(CN)6] x H2O. In: Inorganic Chemistry. 16, 2002, S. 2704–2710, doi:10.1021/ic50177a008.
- Barbara Sieklucka, Dawid Pinkowicz: Molecular Magnetic Materials: Concepts and Applications. Wiley, 2016, ISBN 978-3-527-33953-2, S. 168.
- Mike Ware: Prussian Blue: Artists' Pigment and Chemists' Sponge. In: Journal of Chemical Education. 85, 2008, S. 612–620, doi:10.1021/ed085p612.
- Karl S. Hagen, Sunil G. Naik, Boi Hanh Huynh, Antonio Masello, George Christou: Intensely Colored Mixed-Valence Iron(II) Iron(III) Formate Analogue of Prussian Blue Exhibits Néel N-Type Ferrimagnetism. In: Journal of the American Chemical Society. 131, 2009, S. 7516–7517, doi:10.1021/ja901093b.
- G. Emschwiller: Spectres Infrarouges de Ferrocyanures et de Ferricyanures et Constitution des Bleus de Prusse. In: Compt. Rend., 238, 1954, S. 1414–1416.
- F. Herren, P. Fischer, A. Ludi, W. Haelg: Neutron diffraction study of Prussian Blue, Fe4[Fe(CN)6]3.xH2O. Location of water molecules and long-range magnetic order. In: Inorganic Chemistry. 19, 1980, S. 956, doi:10.1021/ic50206a032.
- H. J. Buser, A. Ludi, W. Petter, D. Schwarzenbach: Single-crystal study of Prussian Blue: Fe4[Fe(CN)6]2, 14H2O. In: Journal of the Chemical Society, Chemical Communications. 1972, S. 1299, doi:10.1039/C39720001299.
- A. F. Holleman, E. Wiberg, N. Wiberg: Lehrbuch der Anorganischen Chemie. 102. Auflage. Walter de Gruyter, Berlin 2007, ISBN 978-3-11-017770-1, S. 176.
- Jacek C. Wojdeł, Ibério de P. R. Moreira, Stefan T. Bromley, Francesc Illas: On the prediction of the crystal and electronic structure of mixed-valence materials by periodic density functional calculations: The case of Prussian Blue. In: The Journal of Chemical Physics. 128, 2008, S. 044713, doi:10.1063/1.2824966.
- L. Müller: Vom Bläuen des Papiers. In: link.springer.com. 1862, abgerufen am 30. August 2020.
- Louise Samain u. a.: Fading of modern Prussian blue pigments in linseed oil medium. In: Journal of Analytical Atomic Spectrometry. 26, 2011, S. 930–941, doi:10.1039/c0ja00234h.
- Jean-Baptiste Vitalis, Christian Heinrich Schmidt: Lehrbuch der gesammten Färberei auf Wolle, Seide, Leinen, Hanf, und Baumwolle. Verlag Bernhard Friedrich Voigt, Weimar, 1847, S. 414–415.
- Barbara H. Berrie: Prussian Blue, in Artists’ Pigments, A Handbook of Their History and Characteristics. Vol 3: E.W. Fitzhugh (Ed.). Oxford University Press, 1997, S. 191–217 (Digitalisat).
- Prussian Blue, Colourlex.
- Robert S. Hoffman: Thallium Toxicity and the Role of Prussian Blue in Therapy. In: Toxicological Reviews. 22, 2003, S. 29–40, doi:10.2165/00139709-200322010-00004.
- Manfred Metzler, Frank J. Hennecke: Toxikologie für Naturwissenschaftler und Mediziner Stoffe, Mechanismen, Prüfverfahren. 3., überarb. und aktualisierte Auflage. Weinheim 2005, ISBN 978-3-527-30989-4, S. 279–280.
- Hasso Scholz, Ulrich Schwabe: Taschenbuch der Arzneibehandlung: Angewandte Pharmakologie. Springer Verlag Berlin, Heidelberg, New York, 2005, ISBN 3-540-20821-6, S. 557.
- The Radiological Accident in Goiânia. (PDF) IAEA, 1988, abgerufen am 29. April 2016 (englisch).
- Sung-Chan Jang, Yuvaraj Haldorai, Go-Woon Lee, Seung-Kyu Hwang, Young-Kyu Han, Changhyun Roh, Yun Suk Huh: Porous three-dimensional graphene foam/Prussian blue composite for efficient removal of radioactive 137Cs. In: Scientific Reports. 5, 2015, doi:10.1038/srep17510.
- Corina Wagner, Marco Oetken: Berliner Blau - ein elektrochromes Material mit vielen Facetten. In: CHEMKON. 23, 2016, S. 111–119, doi:10.1002/ckon.201610276.
- R. Brieger u. a.: Spezielle Analyse: Erster Teil Anorganische Stoffe Organische Stoffe I. Springer-Verlag, Wien, 1932, ISBN 978-3-7091-5261-4, S. 29.
- Přemysl Poňka, Robert T. Woodworth, Herbert M. Schulman: Iron transport and storage. CRC Press, Boca Raton 1990, ISBN 0-8493-6677-1, S. 97.
- Horace D. Graham: Stabilization of the Prussian blue color in the determination of polyphenols. In: Journal of Agricultural and Food Chemistry. 40, 1992, S. 801–805, doi:10.1021/jf00017a018.
- Peter Kurzweil: Das Vieweg Formel-Lexikon: Basiswissen für Ingenieure, Naturwissenschaftler und Mediziner. Springer Fachmedien, Wiesbaden, 2019, ISBN 978-3-322-89958-3, S. 470.
- R. Brown: Cyanotypes on Fabric: A blueprint on how to produce ... blueprints! Lulu.com, ISBN 978-1-4116-9838-3, S. 9–11.
- Hope Saska: Anna Atkins: Photographs of British Algae. In: Bulletin of the Detroit Institute of Arts. 84, 2010, S. 8–15, doi:10.1086/DIA23183243.
- Photographs of British algae: cyanotype impressions. Part 1. bei digitalcollections.nypl.org.
- August Laufer: Werkstattausbildung: Erster Band, Verlag von Julius Springer, Berlin, 1921, S. 13.
- Speisesalz: Das Märchen vom Wundersalz. Stiftung Warentest, 26. September 2013.
- Exotische Salze sind nicht besser als Haushaltssalz. Spiegel Online, 26. September 2013.
- Spektrum der Wissenschaft: Mit Berliner Blau auf Tätersuche, Rachel Fischer und Marco Oetken, abgerufen am 15. Dezember 2019.
- P. Morfeld u. a.: Reduktion der 137Cäsium-Aktivität in Wildschweinen durch Zusatz von Ammonium-Eisen-Hexacyanoferrat („Berliner Blau “) zum Kirrfutter. In: Tierärztliche Praxis Großtiere. 2014, S. 1–8.
- Christoph Janiak, Hans-Jürgen Meyer, Dietrich Gudat, Philipp Kurz: Riedel Moderne Anorganische Chemie, de Gruyter, Berlin, Boston, 2018, ISBN 978-3-11-043328-9, S. 572.
- Mohamed B. Zakaria, Toyohiro Chikyow: Recent advances in Prussian blue and Prussian blue analogues: synthesis and thermal treatments. In: Coordination Chemistry Reviews. 352, 2017, S. 328–345, doi:10.1016/j.ccr.2017.09.014.
- Alma García-Ortiz, Abdessamad Grirrane, Edilso Reguera, Hermenegildo García: Mixed (Fe2+ and Cu2+) double metal hexacyanocobaltates as solid catalyst for the aerobic oxidation of oximes to carbonyl compounds. In: Journal of Catalysis. 311, 2014, S. 386–392, doi:10.1016/j.jcat.2013.12.011.
- Hyun-Wook Lee, Richard Y. Wang, Mauro Pasta, Seok Woo Lee, Nian Liu, Y. i. Cui: Manganese hexacyanomanganate open framework as a high-capacity positive electrode material for sodium-ion batteries. In: Nature Communications. 5, 2014, doi:10.1038/ncomms6280.
- CATL stellt erste Natrium-Ionen-Akkus für Autos vor bei golem.de, eingefügt am 4. August 2021
- Peter Brandt, Abdul K. Brimah, R. Dieter Fischer: Partially Reversible Intercalation of Ferrocene in a Zeolite-like Host Lattice Consisting of Fe(CN)6 and Me3Sn Units. In: Angewandte Chemie International Edition in English. 27, 1988, S. 1521–1522, doi:10.1002/anie.198815211.
- Min Ling: Adsorption of Nitrogen Dioxide in Super Prussian Blue Derivates. In: Zhangfa Tong, Sung Hyun Kim: Frontiers On Separation Science And Technology, Proceedings Of The 4th International Conference, 2004, World Scientific Publishing Co Pte Ltd., ISBN 978-981-238-916-9, S. 503–510.
- Eric Siebel, R. Dieter Fischer: Polymeric [(Me3Sn)3Rh(SCN)6]: A Novel “Super-Prussian-Blue” Derivative Containing the Nonlinear -SCN-Sn-NCS-Spacer. In: Chemistry – A European Journal. 3, 1997, S. 1987–1991, doi:10.1002/chem.19970031213.