Kosmochemie
Die Kosmochemie – auch Astrochemie genannt – befasst sich mit der Entstehung und Verteilung der chemischen Elemente und Verbindungen im Universum. Die chemischen Elemente entstehen im Inneren von Sternen (Nukleosynthese), chemische Verbindungen hingegen in kosmischen Gas- und Staubwolken, auf Planemos, Monden, Kometen, Asteroiden und ähnlichen, kälteren Objekten.

Die Kosmochemie ist ein moderner, bedeutender Zweig der Physik und Chemie und stark verknüpft mit der Astrophysik, speziell der Physik der Sterne und Supernovae. Sie spielt auch eine große Rolle in der Planetologie und beim Versuch, die Entstehung und chemische Entwicklung unseres Sonnensystems und anderer Planemos zu verstehen (bis hin zur Entstehung des Lebens – vgl. unter chemische Evolution).
Da Sterne sowie nahezu alle anderen Himmelskörper jedoch in für uns unerreichbarer Entfernung liegen, ist man bezüglich der chemischen Analyse auf bestimmte Methoden eingeschränkt, vornehmlich instrumentelle Methoden der Spektroskopie und (Spektral-)Analytik, bei der die von den Objekten bei uns eintreffende Strahlung (Ultraviolett, sichtbares Licht, Infrarot) ausgewertet wird.
Speziell befasst sich die Kosmochemie nicht mit der Nukleosynthese, sondern mit der Element- und Isotopenverteilung in unserem Sonnensystem: Ein großer Beitrag hierzu kommt von der Meteoritenforschung, da Meteoriten noch die ursprüngliche chemische Zusammensetzung aus den Anfängen der Entstehung unseres Sonnensystems aufweisen. Aber auch aus der (unbemannten) Raumfahrt sind einige wenige Proben außerirdischen Materials vom Mond, von Kometenstaub, Sonnenwind und – so hofft man – in einigen Jahren und Jahrzehnten auch Proben von anderen Planeten, Monden und Asteroiden zugänglich.
Die Kosmochemie wurde in den 1950er Jahren von Friedrich-Adolf Paneth begründet.
Beispiel: Ein „kosmochemisches“ Projekt
Die Arbeitsweise der Kosmochemie (Astrophysik, Astrochemie, Planetologie) kann an einem jüngeren Beispiel aus der unbemannten Raumfahrt verdeutlicht werden. Normalerweise arbeiten Kosmochemiker an der Auswertung einer Spektralanalyse oder Spektroskopie: Hier können sie aus Strahlungs-Spektren vom „Licht“ ferner Himmelskörper (zumeist Sterne) auf deren chemische Zusammensetzung schließen.

Seit den ersten Mondlandungen können nun auch Proben außerirdischen Materials durch Raumsonden direkt aus dem All eingefangen und auf die Erde gebracht werden, um sie direkt zu analysieren. Die NASA-Mission „Stardust“ ermöglichte es nicht nur, den Asteroiden Annefrank und den Kometen Wild 2 zu fotografieren, sondern auch Kometenstaub einzufangen. Am 2. Januar 2004 flog Stardust in einer Entfernung von 240 km und mit einer Relativgeschwindigkeit von 6,1 km/s an dem Kometen Wild 2 vorbei. Dabei schoss die Sonde mehrere Aufnahmen des Kometen und sammelte dessen Komamaterial ein. Nach ihrer Rückkehr auf die Erde, wurde die Stardust-Kapsel nach Houston ins NASA-Kontrollzentrum gebracht und dort geöffnet. In Houston prüfte man den Zustand des Aerogels, eines extrem leichten Festkörpers, in dem die Staubteilchen des Kometen Wild 2 abgebremst und transportiert wurden. Eine kleine Menge an Kometenstaub stand dann verschiedenen Gruppen von Wissenschaftlern zur Verfügung – so zum Beispiel dem Institut für Planetologie in Münster. Dort konnte man die chemische Zusammensetzung der Staubteilchen direkt untersuchen. Man verspricht sich davon neue Erkenntnisse über die Entstehung unseres Sonnensystems vor 4,6 Milliarden Jahren, denn der Komet Wild 2 hatte sich seit den Anfängen des Sonnensystems nur in den Außenbereichen bewegt (erst 1974 wurde er von der Schwerkraft des riesigen Planeten Jupiter aus seiner alten Bahn geworfen). Auf Kometen hatten Forscher der Kosmochemie bei vorangegangenen Missionen spektralanalytisch komplexe Kohlenstoffverbindungen gefunden. Sie sind zwar noch nicht mit Leben gleichzusetzen, aber vielleicht haben sie den Anstoß für die Entstehung des Lebens auf der Erde gegeben.
Die Entstehung der chemischen Elemente

Die Bildung der Atomkerne (Nuklide) und der chemischen Elemente werden ausführlich im Artikel Nukleosynthese beschrieben. Demzufolge entstanden die chemischen Elemente Wasserstoff und Helium direkt nach dem Urknall durch primordiale Nukleosynthese. Alle schwereren Atom-Arten bildeten sich anschließend im Inneren der Fixsterne (Stellare Nukleosynthese) und bei Supernova-Explosionen. Gegen Ende ihrer Brenndauer explodieren sehr massereiche Sterne und schleudern große Mengen schwerer Elemente in das All. So hat zum Beispiel die Supernova SN 2006gy in der Galaxie NGC 1260 150 Sonnenmassen gehabt und bei ihrer Explosion schätzungsweise 20 Sonnenmassen an Nickel in das Universum geblasen.
Die Verteilung der Elemente im Kosmos
Entsprechend der unter „Nukleosynthese“ beschriebenen Entstehungsgeschichte der Elemente wird die kosmochemische Häufigkeitsverteilung der Atomsorten erklärbar. Die Elementhäufigkeit unterscheidet sich zwar je nach Bereich, den man betrachtet: Das im gesamten Universum mit Abstand häufigste Element ist jedoch Wasserstoff – auf der Erde ist er eher selten, im Menschen aber wieder häufig anzutreffen.
Im Weltall dominieren Wasserstoff und Helium, da beide schon beim Urknall entstanden. Von 1000 Atomen im Universum sind 900 Wasserstoffatome, weitere 99 Atome sind Heliumatome. Nur ein Atom von 1000 ist also nicht Wasserstoff oder Helium. Alle anderen Atomsorten (bis auf Lithium, Beryllium und Bor) entstanden in Sternen (siehe oben und unter Nukleosynthese). Dabei wurden eher Atome mit gerader Protonenzahl gebildet, zum Beispiel Sauerstoff, Neon, Eisen oder Schwefel, welche im Vergleich zu anderen Elementen mit ungerader Protonenzahl demzufolge häufiger sind.
Auf jeweils 1 Billion Wasserstoffatome (H) bezogen – also jeweils 1012 H-Atome – kommen 1010,8 Heliumatome, 108,8 Sauerstoffatome, 108,6 Kohlenstoffatome und 108,0 Stickstoffatome, aber neben je etwa 107,9 Eisen- und Neonatomen und 107,4 Siliziumatomen eben auch nur 101,7 Blei-, 100,7 Gold- und 100,3 Silberatome. Anders die Metallizität der Sterne der 1. Generation (Population II) mit einem hohen Alter über 10 Milliarden Jahre: Sie weisen insgesamt 1/1000 an schwereren Elementen auf, als es der hier angegebenen „Normalverteilung“ im All entspricht.
Interstellare Materie – kosmochemisch gesehen
Interstellare Materie enthält die chemischen Elemente in ähnlichen Verteilungen wie unsere Sonne und andere Sterne der Population I.[1] Hier haben die Atome jedoch aufgrund niedrigerer Temperaturen ihre Außenelektronen, so dass chemische Verbindungen entstehen können, Gase und Stäube zwischen den Sternsystemen.
Zwischen den Sternen findet sich Wasserstoffgas (neutral) mit einer Dichte von 0,8 H-Atomen/cm3 bzw. 1,3 × 10−24 g/cm3. Manche Gebiete sind ärmer an Wasserstoff (galakt. Zentrum), an anderen Stellen gibt es Verdichtungen (Nebel, Wolken) – und gelegentlich dort sogar leuchtende Gebiete, zum Leuchten angeregt durch z. T. intensive UV-Bestrahlung benachbarter Sterne (Emissionsnebel) oder Reflexion (Reflexionsnebel).
Im Gleichgewichtszustand zwischen Produktionsgeschwindigkeit und Zerfallsrate entstehen nun in manchen Nebeln komplexe, organische Moleküle, die jedoch oft durch ionisierende, kosmische Strahlung gleich wieder zerlegt werden. Dennoch: Sie existieren, und abgeschirmt durch Staubwolken können Moleküle wie Wasser, Ammoniak, Methan und Formaldehyd (Methanal) Lebensdauern von Jahrzehnten haben, Stickstoff und Kohlenmonoxid sogar von 1000 Jahren. Auch durch Ausfrieren auf der Oberfläche der Staubkörnchen können sie lange Zeiträume überdauern (bis zu 100.000 Jahre). Schon bei Dichten von nur 50 Atomen/cm3 können durch atomare Kollisionen Moleküle wie Wasserstoff und Kohlenmonoxid, Hydroxyl-Radikal oder Monocyan (CN) entstehen.
In Meteoriten fanden Kosmochemiker sogar Alkane wie 2,6,10,14-Tetramethyl-pentadecan, Aromaten wie Benzol, Toluol, Xylole und Naphthalin, Fettsäuren mit 14–28 C-Atomen, Thiophene, p-Dichlorbenzol, Aminosäuren wie Prolin, Asparaginsäure, Glycin, Alanin und Glutaminsäure (Meteorit Murchison, 1969) und sogar Adenin und Guanin. Die Entdeckung von Aminosäuren außerirdischen Ursprungs 1970 galt als ausgemachte Sensation, sind sie doch die Grundbausteine irdischen Lebens.
Die Entstehung dieser organischen Moleküle wird über mehrere Mechanismen erklärt. Miller und Urey bestrahlten Gasmischungen aus Methan, Ammoniak und Wasser. Durch Radiolyse entstandene Ionen und Radikale bilden Ionen mit bis zu sieben C-Atomen. Über das Ethen können dann sogar Polymere heranwachsen, über Radikale wie NH2* und H2O* sogar Carboxyl- und Aminogruppen eingebaut werden und nach mehreren Mechanismen zu Aminosäuren weiterreagieren:
- dem Cyanhydrinmechanismus (Alkanal + Ammoniak + Blausäure zu: Nitril + Wasser, weitere Reaktion des Nitrils R-CH(CN)NH2 mit Wasser zur Aminosäure),
- nach Sanchez (NC-CCH + Ammoniak zu NC-CH=CH-NH2 + HCN und weiter mit Wasser unter Eliminierung von Ammoniak zum Asparagin),
- über die Fischer-Tropsch-Synthese (CO reagiert mit Wasserstoff bei 10−6 bis 10−2 atm und 450–750 Kelvin zu Methan oder höheren Alkanen und Wasser, katalysiert von Ni, Fe, Magnetit und/oder wasserhaltigen Silikaten auf den Staubkörnern – und bei einer kosmischen Mischung von C:H:O von etwa 1:2000:1,7, bei 10−4 atm und rund 400 Kelvin können sich so – in irdischen Labors nachgestellt – sogar Aminosäuren, Purine, Pyrimidine u. ä. bilden).
Noch bessere Bedingungen für den Aufbau herrschen natürlich an den durch Atmosphären geschützten Planetenoberflächen. Astrochemisch gesehen ist es also als höchst wahrscheinlich einzustufen, dass in den Tiefen des Weltalls etliche Orte zur Entstehung biochemischer Moleküle, ja zur Entstehung des Lebens selbst existieren und wohl auch schon lange Zeit existiert haben (Das Problem zur Herstellung von Kontakten zu außerirdischen Zivilisationen jedoch liegt nicht in den fehlenden, unumstößlichen Beweisen ihrer Existenz – sondern in der schier unüberbrückbaren, großen Entfernung zwischen ihnen).
Irdische Materie – kosmochemisch betrachtet
Die Häufigkeitsverteilung der Elemente im Kosmos insgesamt kann sich lokal sehr verändern. Ein solcher, diese Durchschnittsverteilung ändernder Vorgang ist die Gravitation. Sie ist die Kraft, durch die das Sonnensystem aus einer rotierenden Wolke aus Gas und Staub entstanden ist (Nebularhypothese von Pierre-Simon Laplace, ursprünglich von Immanuel Kant im Jahr 1755 in seinem Werk Allgemeine Naturgeschichte und Theorie des Himmels formuliert, zusammengenommen Kant-Laplace-Theorie).
Bildung von Erde, Planeten- und Sonnensystemen
Nach Ansichten der heutigen Zeit bewegte sich vor etwa 4,6 Milliarden Jahren an Stelle unseres Sonnensystems eine ausgedehnte Materiewolke um das Zentrum der Galaxis. Die Wolke bestand zu über 99 % aus den Gasen Wasserstoff und Helium sowie einem geringen Anteil aus nur mikrometergroßen Staubteilchen, die sich aus schwereren Elementen und Verbindungen, wie Wasser, Kohlenmonoxid, Kohlendioxid, anderen Kohlenstoffverbindungen, Ammoniak und Siliziumverbindungen zusammensetzten. Der Wasserstoff und der überwiegende Teil des Heliums war bereits beim Urknall entstanden. Die schwereren Elemente und Verbindungen wurden im Innern von Sternen erzeugt und bei deren Explosion freigesetzt. Teile der Materiewolke zogen sich infolge der eigenen Schwerkraft zusammen und verdichteten sich. Den Anstoß hierzu könnte die Explosion einer relativ nahen Supernova gegeben haben, deren Druckwellen durch die Wolke wanderten. Diese Verdichtungen führten zu der Bildung von vermutlich mehreren hundert oder gar tausend Sternen in einem Sternhaufen, der sich wahrscheinlich nach einigen hundert Millionen Jahren in freie Einzel- oder Doppelsterne auflöste.

Da bei der Kontraktion der Drehimpuls erhalten bleiben muss, hat sich eine schon minimal existierende Rotation der kollabierenden Wolke erhöht, ähnlich wie eine Eiskunstläuferin durch Anlegen der Arme eine schnelle Rotation erreicht. Die dabei entstehenden, nach außen wirkenden Fliehkräfte führten dazu, dass sich die Wolke in den Außenbereichen zu einer rotierenden Scheibe ausbildete.
Fast die gesamte Materie der Wolke stürzte jedoch in das Zentrum und bildete einen Protostern, der weiter kollabierte, bis der Kernfusionsprozess gezündet wurde: Unsere Sonne entstand. In der verbleibenden protoplanetaren Scheibe führte die Verklumpung von Staubteilchen (Koagulation) zur Bildung von Planetesimalen. Planetesimale sind die Vorläufer und Bausteine von Planeten. Sie bilden sich durch Akkretion, einen Prozess, bei dem sich mikroskopisch kleine Staubteilchen eines präsolaren Nebels (der Vorläufer eines Sonnensystems) zu größeren Teilchen zusammenballen. Stoßen solche Teilchen mit niedriger Geschwindigkeit zusammen, verkleben sie aufgrund chemischer Bindungen oder Oberflächenhaftung miteinander.
Diese bald kilometergroßen Gebilde besaßen genug Masse, um sich durch ihre Gravitation mit anderen Planetesimalen zu größeren Objekten zu vereinigen. Die schwersten Objekte übten die größten Gravitationskräfte aus, zogen Materie aus einem weiten Umkreis an und konnten so noch schneller wachsen. Der „Protojupiter“ störte schließlich mit seinem Gravitationsfeld andere Planetesimale und beeinflusste deren Wachstum. Offensichtlich verhinderte er auch die Bildung eines größeren Körpers zwischen der Mars- und Jupiterbahn, was zur Entstehung des Asteroidengürtels führte. In nur 100.000 Jahren konnten sich die Planetesimale des frühen Sonnensystems zu planetaren Körpern von der Größe des Erdmondes oder des Planeten Mars entwickeln.

Ähnliche Vorgänge der Planetensystem-Bildung müssen auch anderswo im Weltraum abgelaufen sein. Viele Exoplaneten und Planemos wurden in den letzten Jahren entdeckt. Auch hier kondensierten die flüchtigen und weniger flüchtigen Elemente im All zu chemischen Verbindungen, und viele Astronomen und Astrochemiker gehen davon aus, dass Planemos existieren, die sich in gemäßigten Temperaturzonen um ihre jeweiligen Fixsterne bewegen. Somit ist es denkbar, dass eine außerirdische Chemie auch in den unerreichbaren Tiefen des Kosmos Leben hervorgebracht hat.
Der Chemismus des Sonnensystems
Sonnensysteme entstehen durch gravitative Kontraktion von diskusförmigen, rotierenden Materiescheiben. Thermodynamische Berechnungen in Bezug auf diese vom Zentrum weg immer schneller abkühlende und immer leichtere Scheibe zeigen, dass eine Kondensation eintritt, wenn Partialdruck p(i) und Dampfdruck eines Stoffes i gleich werden. Der Partialdruck eines Elementes im kosmischen Gas ist rechnerisch gleich dem Produkt seiner Häufigkeit A(i) relativ zu der des Wasserstoffes A(H2), multipliziert mit dem Gesamtdruck Pg des Gases: p(i) = A(i)/A(H2) x Pg.
Wenn nun der Dampfdruck p eines Elementes nach Clausius-Clapeyron als Funktion der Temperatur erscheint, so wird bei Gleichsetzung von Partial- und Dampfdruck des Elementes dessen Kondensationstemperatur berechenbar (also: log po = -A/T + B, -wobei der Faktor A die durch 2,3 x R dividierte Verdampfungsenthalpie darstellt und B die durch 2,3 x R dividierte Verdampfungsentropie mit R als allgemeiner Gaskonstante).
Hier das Ergebnis dieser Berechnung, begonnen mit der höchsten Kondensationstemperatur unter stetig fortschreitender Abkühlung: das Element Osmium kondensiert bereits bei Temperaturen um 1860 K, um 1780 kondensieren Zirconium-IV-oxid und Rhenium, um 1700 Aluminiumoxid, um 1560–1500 Kalziumtitanat (Perowskit) sowie Gehlenit (ein Silikat) und Seltene Erden (U, Th, Ta, Nb), um 1390 die ferromagnetischen Metalle (Fe,Ni,Co), bei 1370–1250 Magnesiumsilikate sowie die Metalle Kupfer, Germanium und Gallium (in Legierung mit Fe) sowie Alkalisilikate (mit CaAl2Si2O8), bei 1100-700 K Silber (Ag) und unter 750 K kommt es zur Oxidation auskondensierten Eisens (zu Mineralen wie FeO+FeS).
.jpg.webp)
In etwas kühleren, von der Ursonne entfernteren Regionen kondensierten bei 600-400 K Blei, Bismut, Indium und Thallium, ab 350 K kristallisierten hydratisierte Silikate aus und – in der sonnenferneren Region der Gasriesen – bei Temperaturen unter 180 K auch Wassereis (anschließend NH4SH, bei <140 Kelvin, bei < 100 K festes Ammoniakhydrat, bei < 60 Kelvin Methanhydrat und erst bei Tiefsttemperaturen von < 20 Kelvin auch festes Methan und Argon).
Während der Kondensation tritt nun eine Fraktionierung ein, d. h. beim „Ausfrieren“ sortieren sich die Stoffe entsprechend ihrer Dichte, sowohl innerhalb kleiner Klumpen (Chondren, Meteoriten) als auch im großen Maßstab (Planetesimale: Außen spätere Gasriesen wie Jupiter und Saturn oder „Schneeklumpen“ wie die Kometen, innen kompaktere Planeten wie Merkur und Venus). Auch trennen sich die Stoffe in den glutflüssigen Urplaneten (Absinken der Metalle in den Kern, anschließendes Abkühlen der äußeren Silikatkrusten).
Somit erklärt sich der heutige chemische Aufbau unseres Sonnensystems von den inneren Gesteinsplaneten über die äußeren, kühlen Gasriesen bis hin zu fernsten Objekten im Kuipergürtel und in der Oortschen Wolke von der Kosmochemie her.
Nach Oort (1950) stammen die Kometen aus einem Reservoir von 0,1-0,01 Sonnenmassen in etwa 50000 AE Sonnenferne. In 1 AE Sonnennähe gelangt, entwickeln sie mit Expansionsgeschwindigkeiten von 500 m/s Halos und – in unmittelbarer Kernnähe – Komas, deren Gasdichte sich von 1014 Moleküle/cm3 in Kernnähe bis außen zu 100 Moleküle /cm3 erstreckt. Die Gas- und Staubteilchen werden vom Sonnenwind fortgetrieben und bilden den Ionen- und Staubschweif des Kometen.
Emissionsspektren der Komas sind eingehend untersucht worden, auch konnte Sonde Giotto die Koma des Kometen Halley schon unbeschadet durchfliegen. Im Abstand von <2 AE zeigt die Kometenkoma Banden von Cyan, von OH-Radikalen, neutralem Sauerstoff, Natrium und – näher als 1 AE zum Kern hin – Linien der Elemente Cr, Mn, Fe, Co, Ni, Cu, K und Ca, der Radikale NH und CH sowie der Gase Methylcyan, HCN und Wasser. Die CN-Radikale könnten durch Photodissoziation des Methylcyans entstanden sein, die NH*-Radikale durch Photolyse von Hydrazin oder von Aminen wie Methylamin, von Isocyansäure (HNCO), Methylenimin H2C=NH oder von Formamid. Radikale wie C2 und C3 wurden ebenfalls entdeckt. Sie entstammen wohl dem Acetylen und dem Diazomethylacetylen. Auch ionisierte Moleküle von Kohlenmonoxid, -dioxid, Wasser und Stickstoff waren nachweisbar.
In Bezug auf silikatartige Materialien lässt sich berechnen, dass Kometenstaubkörnchen durch den Strahlungsdruck der Sonne verloren gehen und ihr Durchmesser daher unter 10−6 cm liegen muss. Zunächst hielt man Kometen für „schmutzige Eisbälle“. Als jedoch im Komet Kohoutek äußerst wenig Methan gefunden wurde, kam man zu der Überzeugung, dass sie nicht aus abkühlendem, solaren Gas entstanden sein können, sondern Hauptkomponenten wie Wasser, Kohlenmonoxid, Stickstoff sowie Blausäure, Methylcyanid und Staub aufweisen – Materialien also auch aus unerreichbaren Tiefen des Weltraums, dem interstellaren Gas.
Irdische Materie
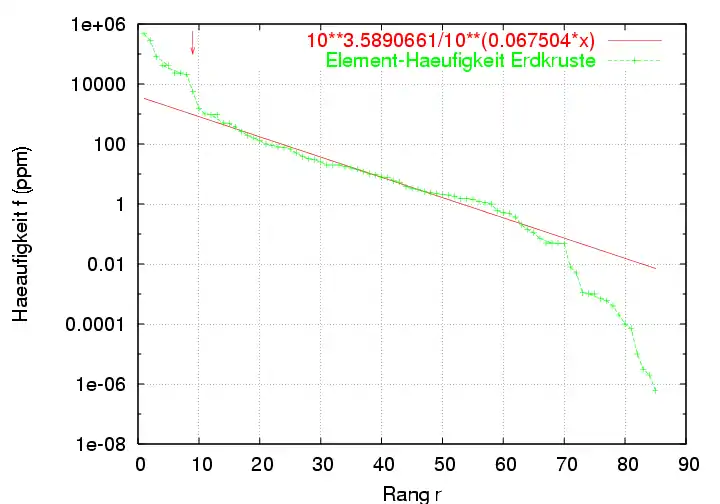
Auf der Erde ergibt sich eine andere Elementen-Verteilung als in Kometen, auf fernen Gas-Planeten oder gar im Kosmos allgemein. Betrachtet man die Erdkruste, so dominiert gebundener Sauerstoff (O) mit einem Massenanteil von 49,2 %, darauf folgen Silicium (Si, 25,7 %), Aluminium (Al 7,5 %), Eisen (Fe 4,7 %), Calcium (Ca 3,4 %), Natrium (Na 2,6 %), Kalium (K 2,4 %), Magnesium (Mg 1,9 %), Wasserstoff (H 0,9 %) und Titan (Ti 0,6 %). alle weiteren Elemente haben nur noch einen Massenanteil von weniger als 0,2 %.
Betrachtet man die ganze Erde mitsamt ihrem Kern, so ergibt sich ein etwas anderes Bild. Die häufigsten Elemente in der Gesamterde sind Eisen (Fe, 35 %) vor Sauerstoff (30 %), Silicium (15 %) und Magnesium (13 %), gefolgt von Nickel, Schwefel, Calcium, Aluminium und anderen (jeweils unter drei Prozent).
Unsere Biomasse – kosmochemisch analysiert
Der Mensch ist wiederum anders zusammengesetzt als Weltraum und Erde: Er besteht hauptsächlich aus Wasserstoff, Sauerstoff, Kohlenstoff und Stickstoff, zusammen mit Natrium, Magnesium, Kalium, Calcium, Phosphor und Schwefel machen diese Elemente 99,996 % aller Atome eines menschlichen Körpers aus (Die ersten systematischen Untersuchungen zur Elementhäufigkeit stammen von Victor Moritz Goldschmidt, nach ihm heißt die grafische Darstellung der Elementhäufigkeiten Goldschmidt-Diagramm).
Kosmochemiker gehen davon aus, dass zunächst bei der Entstehung des Sonnensystems auf der Erde und allen anderen sonnennahen Planeten wegen der relativ hohen Temperaturen und den Effekten des Sonnenwinds nur wenig oder keine leichten Elemente (inklusive Kohlenstoff, Stickstoff und Sauerstoff) „übrig“ geblieben sind. All diese Elemente, die heute den Hauptanteil an der Biosphäre ausmachen, wären nach dieser Theorie erst nach geraumer Zeit durch Kometeneinschläge aus den äußeren Bereichen des Sonnensystems angeliefert worden, nachdem sich die Protoplaneten etwas abgekühlt hatten. Da sich während der ersten einigen hundert Millionen Jahre nach Entstehung des Sonnensystems ständig große Einschlagereignisse von Himmelskörpern wiederholten, wären lebende Systeme, die sich bereits in diesen Zeiten entwickelten, immer wieder durch globale Sterilisationen vernichtet worden, die durch große Kollisionen verursacht wurden. Die Entwicklung von Leben konnte so erst starten, nachdem sich flüssiges Wasser zumindest an den tiefsten Stellen der Meere auf Dauer halten konnte.
Durch die langsame Abkühlung der Erde, den dabei auftretenden Vulkanismus (Ausgasung aus dem Erdinneren) und die globale Verteilung der Materie eingeschlagener Kometen kam es zur Etablierung einer Atmosphäre. Darin sind als Verbindungen vor allem Wasserdampf (bis zu 80 %), Kohlendioxid (bis zu 20 %), Schwefelwasserstoff (bis sieben Prozent), Ammoniak und Methan als Hauptbestandteile zu erwarten.
Der eigentliche Ursprung des Wassers ist jedoch noch nicht ganz unumstritten. Vor allem aus Wasser, Methan und Ammoniak können sich unter den Bedingungen der frühen Erde zunächst kleine organische Moleküle (Säuren, Alkohole, Aminosäuren), später auch organische Polymere (Polysaccharide, Fette, Polypeptide) bilden, die in der oxidierenden Atmosphäre nicht stabil sind.
Die hohe UV-Einstrahlung bedingte eine photochemische Zerlegung der Wasser-, Methan- und Ammoniakmoleküle, wodurch sich Kohlendioxid und Stickstoff ansammelten. Die leichten Gase wie Wasserstoff oder Helium verflüchtigten sich großteils in den Weltraum, Kohlendioxid löste sich in großen Mengen in den Ozeanen, wodurch ihr Wasser angesäuert wurde und der pH-Wert sich auf etwa 4 absenkte. Der inerte und wenig lösliche Stickstoff N2 blieb unverändert, sammelte sich mit der Zeit an und bildete vor etwa 3,4 Milliarden Jahren den Hauptbestandteil der Atmosphäre.
Die Ausfällung des Kohlendioxids mit Metallionen als Carbonate und die spätere Entwicklung von Lebewesen, die Kohlendioxid assimilierten, führte zu einer Verringerung der CO2-Konzentration und einem Wiederanstieg der pH-Werte der Gewässer. Der Sauerstoff O2 spielt die Hauptrolle erst bei der weiteren Entwicklung hin zu unserer heutigen Atmosphäre. Er wurde durch das Auftreten von Lebewesen mit oxygener Photosynthese gebildet, und zwar seit etwa 3,5 Milliarden Jahren; vermutlich waren es Cyanobakterien oder Cyanobakterien-ähnliche Prokaryoten.
Biomoleküle
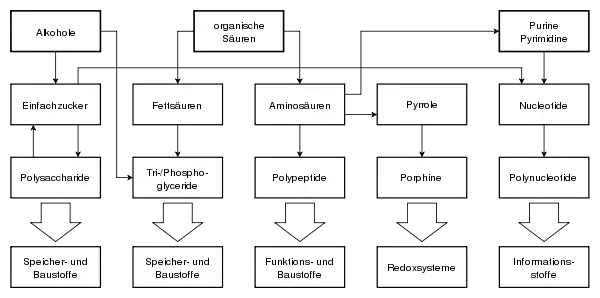
Die chemische Evolution verlief vermutlich so, dass aus den auf der entstehenden Erde angesammelten Elementen komplexe, organische Moleküle gebildet wurden – Kohlenstoffverbindungen. Die präbiotische Entstehung der komplexen organischen Moleküle kann in etwa in drei Schritte unterteilt werden:
- Entstehung einfacher organischer Moleküle (Alkohole, Carbonsäuren, Heterocyclen wie Purine und Pyrimidine) aus anorganischen Stoffen.
- Entstehung der Grundbausteine (Einfachzucker, Aminosäuren, Pyrrole, Fettsäuren, Nukleotide) komplexer organischer Moleküle aus einfachen organischen Molekülen.
- Entstehung der komplexen organischen Moleküle aus den Grundbausteinen.
Die Elementaranalyse dieser Moleküle führt zu der Frage, welche anorganischen Verbindungen zu ihrer Entstehung notwendig waren. Diese mussten in der reduzierenden Uratmosphäre der Erde vorhanden sein – in der Verteilung und unter den Reaktionsbedingungen, die chemisch das Entstehen erster Lebewesen ermöglichten.
Eine besonders intensive Form der Mitwirkung von Mineralien und Gesteinen bei der präbiotischen Synthese organischer Moleküle muss sich auf der Oberfläche von Eisensulfid-Mineralien abgespielt haben. Das Szenario für die frühe chemische Evolution des Lebens wurde seit Anfang der 1980er Jahre von Günter Wächtershäuser entwickelt.
Danach wäre das Leben auf der Erde an der Oberfläche von Eisen-Schwefel-Mineralen entstanden (der Eisen-Schwefel-Welt ESW), also auf Sulfiden, die sich heute noch durch geologische Prozesse an Tiefsee-Vulkanen bilden und zur Frühzeit der Erde noch wesentlich häufiger aufgetreten sein müssen (»black smokers«).
Schließlich bildet Ribonukleinsäure (RNA) ein Molekül von entscheidender Bedeutung für die Entstehung des Lebens. Die RNA-Welt-Hypothese wurde erstmals 1986 von Walter Gilbert vorgeschlagen. Diese Vermutung lässt sich ableiten aus der Fähigkeit der RNA zur Speicherung, Übertragung, und Vervielfältigung genetischer Informationen sowie aus ihrer Fähigkeit, als Ribozyme Reaktionen zu katalysieren. In einer Evolutionsumgebung würden diejenigen RNA-Moleküle gehäuft vorkommen, die sich selbst bevorzugt vermehren. RNA wird aufgrund diverser Eigenschaften für älter gehalten als DNA.
Siehe auch
Literatur
- E. M. Burbidge, G. R. Burbidge, W. A. Fowler, F. Hoyle: Synthesis of the Elements in Stars. In: Rev. Mod. Phys. 29. 1957, S. 547 (direkter PDF-download-Link).
- Paola Caselli, Cecilia Ceccarelli: Our astrochemical heritage, in: The Astronomy and Astrophysics Review, October 2012, 20:56, 1–68, auch online unter Arxiv.org, englisch, PDF
- C. E. Rolfs, W. S. Rodney: Cauldrons in the Cosmos. Univ. of Chicago Press, 1988
- Heinz Oberhummer: Kerne und Sterne. Barth, Leipzig 1993, ISBN 3-335-00319-5
- Wolfgang Kiesl: Kosmochemie. Springer, Wien 1979, ISBN 3-211-81527-9
- Charles R. Cowley: An introduction to cosmochemistry. Cambridge Univ. Press, Cambridge 1995, ISBN 0-521-41538-1
- César Esteban: Cosmochemistry – the melting pot of the elements. Cambridge University Press, Cambridge 2004, ISBN 0-521-82768-X
- Andrew M. Shaw: Astrochemistry – from astronomy to astrobiology. Wiley & Sons, Chichester 2006, ISBN 0-470-09136-3
- D. D. Clayton: Handbook of isotopes in the cosmos. Cambridge Univ. Press, Cambridge 2003, ISBN 0-521-82381-1
- Thomas Henning: Astromineralogy. Springer, Berlin 2003, ISBN 3-540-44323-1
Weblinks
- Astrochemistry.eu, EU online Forum im Bereich beobachtender und Laborastrochemie und -Physik
- AG Kosmochemie, Uni Köln
- The Astrochemist
- Astrochemistry Laboratory at the NASA Goddard Space Flight Center
- The Big Picture-Cosmochemistry (PDF; 2,4 MB) William M. White, Cornell University 2005, Geochemistry (pdf, 58 S., eingesehen am 1. Januar 2011; 4 MB)
Einzelnachweise
- zdf 2021: Schwarze Löcher - Ursprung unseres Lebens. Ein Film von John A. Kantara und Fabian K Wolf. Eine Produktion von Autentic in Zusammenarbeit mit ZDF, NHK, arte und 3sat
_meteorite.jpg.webp)