Thrombozytenaggregation
Als Thrombozytenaggregation wird der Vorgang der Zusammenlagerung (Aggregation) von Blutplättchen (Thrombozyten) bezeichnet. Der Vorgang gehört zur primären (zellulären) Hämostase und dient dem Verschluss von verletzten Blutgefäßen.

Aggregation unter physiologischen Bedingungen
Damit Thrombozyten aggregieren, müssen diese „aktiviert“ werden, d. h. äußere Signale erhalten. Im Falle einer Verletzung der Blutgefäßwand (Endothel) kommen die im Blut zirkulierenden Thrombozyten in direkten Kontakt mit Zellwänden, die nicht endothelial sind. Sie sind mit einem Protein, dem Von-Willebrand-Faktor (vWF) bedeckt, an dem sich Thrombozyten mittels eines spezifischen Rezeptors (Glycoprotein (GP)-Ib-V-IX-Komplex) binden. Dies ermöglicht den thrombozytären Rezeptoren α2β1 (ein Integrin) und GP VI die Bindung an durch die Verletzung freigelegtes Kollagen.
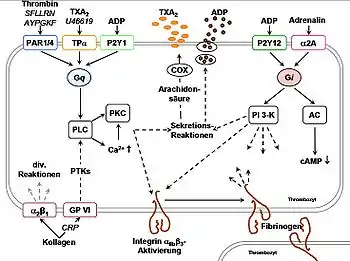
Die Bindung von GP VI an Kollagen scheint der Hauptauslöser für die initiale Thrombozyten-Aktivierung zu sein, was zu einer morphologischen Änderung der Blutplättchen führt. Durch Umlagerungen des Cytoskeletts und Ausstülpung von Pseudopodien vergrößern sie ihre Oberfläche um ein Mehrfaches und ermöglichen so eine lockere Abdeckung des Wundbereichs. Daraufhin werden aggregationsfördernde Substanzen wie ATP und ADP aus dichten Granula freigesetzt, und es kommt zur Sekretion von Thromboxan-A2 (TXA2). TXA2 ist der prominenteste, von Thrombozyten endogen gebildete Metabolit der Arachidonsäure. Arachidonsäure wird durch die aktivierte Phospholipase A (PLA) aus Phospholipiden der Zellmembran herausgespalten. Es erfolgt eine COX-abhängige Umwandlung in das Prostaglandin H2 und umgehend zur Thromboxan-Synthase-vermittelten Bildung von TXA2. Da Thrombozyten selbst Rezeptoren für diese Botenstoffe haben, führt die Bindung von ADP an die P2Y12- und P2Y1-Rezeptoren und die Bindung von TXA2 an den Thromboxan-Rezeptor α (TPα) zu einer Verstärkung des aggregationsfördernden Signals (ein Beispiel für einen engl. „positive feedback loop“).
Diese Verstärkung führt u. a. dazu, dass der membranständige Fibrinogen-Rezeptor Integrin αIIbβ3 eine Konformationsänderung erfährt, sodass er Fibrinogen statt mit geringer nun mit hoher Affinität bindet (ein seltenes Beispiel für engl. „inside-out signaling“). Die anschließend starke Bindung an Fibrinogen ist die Basis für eine starke Quervernetzung mit anderen Thrombozyten und führt außerdem zu einer erneuten Aktivierungsverstärkung ins Zellinnere (engl. „outside-in signaling“).
Sie führt zu einer Änderung der Plasmamembran-Orientierung („Flip“), wodurch nun negativ geladene Phospholipide nach außen freigelegt werden. Gerinnungsfaktoren wie aktivierter Faktor X (F Xa) und Faktor V (F Va) lagern sich Calcium-abhängig an dieser Oberfläche an, und katalysieren durch Umwandlung von Prothrombin (F II) eine lokale, massive Generation von Thrombin (F IIa) (dem sog. engl. „thrombin burst“). Während der sekundären Hämostase führt Thrombin, neben der starken Aktivierung von den Thrombozyten-Rezeptoren PAR1 und PAR4 (protease activated receptor 1 & 4) zur Spaltung von extrazellulärem Fibrinogen zu Fibrin, was zu einem unlöslichen Faser-Netzwerk zum Zweck der Gerinnsel-Stabilisierung führt. In solch einem Netzwerk verfangen sich auch andere zelluläre Bestandteile des Blutes wie bspw. Erythrozyten. Im Laufe der Gefäßwand-Genese wird dieser Thrombus durch Plasmin wieder aufgelöst, welches in einem Fibrinolyse genannten Prozess die Fibrinfasern spaltet.
Sonstiges
Störungen in diesem System können unter anderem zum weit verbreiteten Krankheitsbild der Thrombose führen sowie zu Symptomen, die charakteristisch für Hämophilie sind, bspw. ausgelöst durch Thrombozytopenie.
Um die Aggregationsfähigkeit von Thrombozyten zu testen, bedient man sich in der Forschung und Diagnostik der Thrombozytenaggregometrie. Im Menschen direkt kann man durch Durchführung des Rumpel-Leede-Tests Hinweise auf die Aggregationsfähigkeit erhalten. In der Tiermedizin ist dazu die Messung der Schleimhautblutungszeit üblich.
Literatur
- Heinz Lüllmann, Klaus Mohr, Lutz Hein: Pharmakologie und Toxikologie: Arzneimittelwirkungen verstehen – Medikamente gezielt einsetzen. Georg Thieme Verlag, Stuttgart 2006 (online)
- Wilfried Kraft: Klinische Labordiagnostik in der Tiermedizin. Schattauer Verlag, 6. Auflage, Stuttgart 2005 (online)
- Wolfgang Gerok: Die Innere Medizin: Referenzwerk für den Facharzt. Schattauer Verlag, 11. Auflage, Stuttgart 2007 (online)
Weblinks
- Thrombozytenaggregation im DocCheck Flexikon
- Thrombozytenaggregation auf thrombozyten-info.de
- Thrombozytenaggregation gesundheit.de
- Thrombozytenaggregation auf symptomat.de
- Thrombozytenaggregation auf wissen.de