Glatte Muskulatur
Glatte Muskulatur ist eine der drei Arten von Muskulatur bei Mensch und Tier. Sie kommt in den Wänden der Hohlorgane außer dem Herzen vor, die sich „zusammenziehen“ können, die also ihre lichte Weite (Lumen) verringern können. Dies sind zum Beispiel die Blutgefäße, die Organe des Verdauungstraktes und die Atemwege. Daneben tritt glatte Muskulatur an verschiedenen anderen Stellen, etwa in der Haut, auf.[1]

Der Name der glatten Muskulatur bezieht sich auf ihre mikroskopische Struktur: Während die Skelettmuskulatur und die Herzmuskulatur im Mikroskop eine sichtbare Querstreifung aufweisen, verfügt die glatte Muskulatur über eine solche nicht. Im Gegensatz zur Skelettmuskulatur kann sie auch nicht willkürlich kontrahiert werden, sondern verfügt über andere Kontrollmechanismen, die von muskeleigenen (myogenen) Mechanismen bis zur Kontrolle durch das vegetative Nervensystem oder enterische Nervensystem (neurogene Kontrolle) und zur Kontrolle durch Hormone, Neurotransmitter und andere Botenstoffe reichen.[2] Abgesehen von diesen Gemeinsamkeiten bildet die glatte Muskulatur jedoch eine sehr heterogene (unterschiedliche) Gruppe, die in weitere Untergruppen eingeteilt werden kann. Man kann zum Beispiel die Muskulatur der einzelnen Organsysteme voneinander abgrenzen (z. B. glatte Muskulatur der Blutgefäße, der Atemwege usw.), oder phasische glatte Muskulatur (in Ruhe entspannt oder rhythmisch kontrahiert) von tonischer (ständig kontrahiert) unterscheiden.[3]
Embryologie
Wie auch die Skelettmuskelzellen sind die Zellen der glatten Muskulatur außer in der Regenbogenhaut des Auges mesodermalen Ursprungs.
Aufbau
Aufbau auf zellulärer Ebene
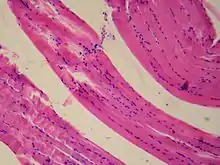

Glatte Muskulatur besteht aus glatten Muskelzellen, die ein spindelförmiges Aussehen haben, etwa zwei bis zehn Mikrometer breit und etwa 20 (in Blutgefäßen) bis 800 µm (in der Gebärmutter einer Schwangeren) lang sind. Der längliche Zellkern liegt zentral in der Mitte,[4] an seinen Enden liegen die meisten Zellorganelle wie Mitochondrien, Ribosomen, oder das raue endoplasmatische Retikulum.[5][6]
Treten die glatte Muskelzellen in größerer Zahl auf, bilden sie dichte Schichten, Stränge oder gitterartige Systeme, je nach Organ.[4] Dabei ist jede Zelle von einer Membran, der Basalmembran, umgeben. Die Zellen sind untereinander über Proteinsysteme außerhalb der Zellen (Extrazellularmatrix) miteinander verbunden. Über diese Verbindung der Zellen untereinander ist gewährleistet, dass der ganze Muskelverband eine Kraft ausüben kann. Einige glatte Muskelzellen verfügen auch über kleinste Sehnen über die sie am Bindegewebe ansetzen.[6]
Im elektronenmikroskopischen Bild fallen die längs orientierten, parallelen Filamente im Inneren der Zelle, Verdichtungszonen im Zellinneren und an der Zellmembran und Grübchen (Caveolae) an der Zellmembran auf. Bei manchen Muskelzellen findet man auch ein System glatter Schläuche in der Nähe dieser Caveolae; man vermutet, dass beide am Mechanismus der Kontraktion der Muskelzelle beteiligt sein können.[6]
Aufbau auf molekularer Ebene
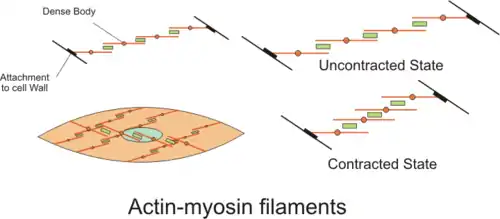
Auf der rechten Seite sieht man, wie sich die Aktinfilamente (rot) zwischen den Myosinköpfchen (grün) aufeinander zu bewegen und den Muskel so verkürzen.
Lichtmikroskopisch erscheint das Zytoplasma (Zellinnere) im Gegensatz zur quergestreiften Muskulatur homogen, dennoch finden sich eine Vielzahl von Strukturen in glatten Muskelzellen. Für die Kontraktion einer glatten Muskelzelle sind zwei verschiedene Systeme in Kombination verantwortlich: Das Zytoskelett-System und die Myofilamente.[7]
Zytoskelett
Das Zytoskelett einer Zelle ist ein Gerüst aus Proteinen im Inneren der Zelle, das diese stützt, ihr Form verleiht und andere Aufgaben wahrnimmt. Für die Kontraktion einer glatten Muskelzelle sind die Intermediärfilamente Desmin und bei Gefäß-Muskelzellen Vimentin, sowie nicht-muskuläres Aktin nötig. Diese durchziehen die Muskelzelle und reichen von Verdichtungszonen im Inneren der Zelle, den dense bodies, zu Verdichtungszonen an der Innenseite der Zellmembran, den Anheftungsplaques, oder dense plaques. Diese Verdichtungszonen enthalten α-Actinin und Plectin und sind mit den Z-Scheiben in quergestreifter Muskulatur vergleichbar.[7]
Myofilamente
Die Myofilamente bilden den eigentlichen Mechanismus zur Kontraktion (kontraktiler Apparat) und setzen sich bei glatter Muskulatur aus glattmuskulärem α-Aktin und Isoformen von Myosin zusammen. Sie sind wahrscheinlich in schrägen Bahnen durch die Zelle angeordnet. Die aus Aktin bestehenden Filamente sind in den erwähnten dense bodies und dense plaques verankert. Die Myosinfilamente haben Kontakt zu mehreren Aktinfilamenten und können mit ihrer Kopfregion an diese Aktinfilamente binden. Die spezielle Anordnung der Aktin- und Myosinfilamente zueinander ermöglicht es den glatten Muskelzellen, sich auf ein Drittel ihrer Ausgangslänge zu verkürzen. In quergestreiften Muskelzellen haben die Aktin- und Myosinfilamente eine regelmäßige Anordnung, so dass es im mikroskopischen Bild zur typischen Querstreifung kommt.[8][9]
Die Aktinfilamente der glatten Muskelzellen haben im Bereich der dense plaques außerdem Kontakt zu Integrinen, die die Zellmembran durchspannen und an der Zellaußenseite mit Proteinen der extrazellulären Matrix verbunden sind. Dies stellt den Kontakt der Muskelzellen untereinander sicher.[10]
Kontraktion
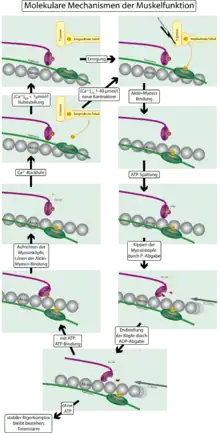
Der Kontraktionsmechanismus der glatten Muskulatur entspricht im Wesentlichen der Muskelkontraktion der quergestreiften Muskulatur und läuft grundsätzlich wie folgt ab: Die Kopfdomäne des Myosins, das Myosinköpfchen, ist bereits in Ruhe an ein Aktinfilament gebunden. Der Winkel zwischen der Kopfdomäne (schwere Kette) und der leichten Kette beträgt dabei 90°. Darüber hinaus hat das Myosinköpfchen noch ATP gebunden. Wird nun die Kontraktion des Muskels ausgelöst, kommt es innerhalb der Zelle zu einer starken Erhöhung der Ca2+-Konzentration (von etwa 10−7 auf 10−6 bis 10−5 mmol/l). Dieses Ca2+ bindet nun an das Protein Calmodulin, das wiederum das Enzym Myosin-leichte-Ketten-Kinase (MLKK) aktiviert. MLKK phosphoryliert die leichte Kette des Myosins, d. h. Phosphat wird zur molekularen Struktur des Myosins hinzugefügt. Dadurch erhält das Myosin ATPase-Aktivität und spaltet folglich das an der Kopfdomäne gebundene ATP. Dieser Schritt liefert die notwendige Energie. Die Spaltprodukte, nämlich ADP und Phosphat, verlassen das Myosinköpfchen und dieses klappt um, der Winkel zwischen schwerer Kette und leichter Kette beträgt jetzt nur noch 45°. Dabei „verschiebt“ das Myosinköpfchen das Aktinfilament ein Stück: es ist eine Bewegung entstanden. Diese Bewegung nennt man Kraftschlag. Die einzelnen Aktinfilamente wurden dabei aufeinander zugeschoben, so dass sich die Länge des Muskels insgesamt verkürzt hat, er ist also kontrahiert.[9][10][11]
Im nächsten Schritt ist es nun nötig, die Bindung zwischen dem Myosinköpfchen und dem Aktinfilament wieder aufzulösen. Dazu wird erneut ein Molekül ATP gebunden, die Bindung löst sich, es stellt sich wieder ein Winkel zwischen schwerer und leichter Kette von 90° ein und der Mechanismus kann von vorne beginnen. Es handelt sich also um einen Zyklus, den Querbrückenzyklus. Dieser Zyklus erlaubt es, den Kraftschlag immer wieder auszuführen, so dass sich der Muskel bis zum Maximum verkürzen kann. Bei glatten Muskelzellen liegt dieses Maximum bei ca. einem Drittel der Ausgangslänge, was deutlich mehr ist als bei einem Skelettmuskel. Allerdings läuft die Kontraktion auch deutlich langsamer ab.[9][10]
Der Anstieg der Ca2+-Kontraktion kann durch drei verschiedene Mechanismen verursacht werden:[9]
- Elektromechanische Kopplung:
- Die elektromechanische Kopplung bezeichnet den Vorgang, bei dem Aktionspotentiale zur Muskelkontraktion führen. Aktionspotentiale stellen Ionenströme dar, die durch Umverteilung von bestimmten Ionen an der Zellmembran charakterisiert sind und sich entlang der Zellmembran fortbewegen. Dabei ändert sich die Spannung zwischen dem Raum außerhalb und innerhalb der Zelle. Diese Aktionspotentiale können durch Schrittmacherzellen oder durch Nervenstellen bedingt sein. Jedenfalls führt eine solche Spannungsänderung dazu, dass sich spannungsabhängige Ca2+-Kanäle öffnen und Kalzium von außerhalb in die Zelle einströmt, wodurch es zur oben beschriebenen Kontraktion kommt. Solche Spannungsänderungen können auch durch eine lang anhaltende Änderung der Spannung (Depolarisation) durch Veränderung der Leitfähigkeit für Kalium-Ionen zustande kommen. Man spricht hierbei von der metabolischen Kontraktion.[11]
- Pharmakomechanische Kopplung:
- Bei der pharmakomechanischen Kopplung führen Hormone, Neurotransmitter oder Pharmazeutika zu einem Anstieg der Ca2+-Konzentration und damit zur Kontraktion. So können Hormone und Neurotransmitter wie beispielsweise Noradrenalin an Rezeptoren an der Zelloberfläche binden und die Aktivität des Enzyms Phospholipase C im Zellinneren erhöhen. Die Phospholipase C bildet Inositoltriphosphat (IP3), das wiederum an den IP3-Rezeptor bindet, der auf dem sarkoplasmatischen Retikulum (einem Zellorganell) sitzt. Das führt zur Freisetzung von Kalzium aus dem sarkoplasmatischen Retikulum ins Innere der Zelle und damit zur Kontraktion.[9]
- Außerdem kann es durch die pharmakomechanische Kopplung direkt zur Aktivitätsänderung des Enzyms MLKK kommen (Ca2+-Sensitivierung). Beispielsweise wird das Zusammenziehen der Blutgefäße durch Aktivatoren der Rho-Kinase des Parasympathikus so reguliert. Eine Aktivitätssteigerung der Myosin-Leichte-Ketten-Phosphatase (MLKP) hingegen, nennt man Ca2+-Desensitivierung, da MLKP den gegenteiligen Effekt zu MLKK hat, nämlich Myosin dephosphoryliert und den Querbrückenzyklus so verhindert.[9]
- mechanische Kopplung: Dehnungsabhängigie Kalziumkanäle können sich direkt bei Dehnung öffnen und einen Kalziumeinstrom und damit Kontraktion auslösen.[5] Dies nennt man den Bayliss-Effekt.[12]
Kontraktionsformen
Durch strukturelle Unterschiede und die daraus resultierenden funktionellen Unterschiede ist eine Unterteilung des glatten Muskelgewebes in den Single-unit- und den Multi-unit-Typ möglich. Mischformen sind v. a. in der Gefäßmuskulatur häufig.
Single-unit-Typ
Sind mehrere Muskelzellen untereinander durch bestimmte Proteine miteinander verbunden, spricht man vom Muskelgewebe des Single-unit-Typs. Dabei formen die Proteine eine Art Kanal zwischen den Zellen, die Gap Junctions (Nexus), so dass Ionen und Botenstoffe wie Second Messenger schnell von einer Zelle zur anderen gelangen können. Dies führt zu einer elektrischen Kopplung zwischen den Zellen: ändert sich die Ionenkonzentration in einer Zelle (z. B. im Rahmen eines Aktionspotentials), wird diese Änderung unmittelbar auf die Nachbarzelle übertragen und diese ebenfalls erregt. Daher kontrahieren sich die Muskelzellen vom Single-unit-Typ nahezu synchron.[2][12]
Die Muskelzellen in einem solchen Zellverband werden von spontan aktiven Schrittmacherzellen (myogener Tonus) erregt und treten bei Hohlorganen, wie dem Uterus oder bei kleinen Blutgefäßen auf. Die Häufigkeit von solchen Verbindungen variiert aber auch innerhalb des Organs und ändert sich im Uterus während der Schwangerschaft. Die Aktivität der Schrittmacherzellen kann unter Umständen durch vegetative Nervenzellen oder Hormone reguliert werden.[2][12]
Multi-unit-Typ
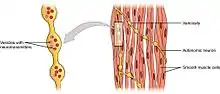
Von den Nachbarzellen abhängige Kontraktionen finden beim Multi-unit-Typ nicht bzw. nur sehr begrenzt statt. Jede Muskelzelle wird stattdessen durch Nervenfasern des Vegetativen Nervensystems innerviert, oder auch durch Hormone reguliert. Dazu geben die Nervenzellen in unmittelbarer Umgebung aus Varikositäten (Verdickungen) Transmitter ab. Man spricht daher auch vom neurogenen Tonus. Da der Abstand zwischen den Varikositäten und den glatten Muskelzellen wesentlich größer ist (ca. 50 bis 100 nm) als der Abstand bei „echten“ Synapsen, spricht man auch von der „Synapses à distance“.[12][13][14]
Relaxation
Zur Entspannung (Relaxation) kommt es durch einen sinkenden Ca2+-Spiegel, ausgelöst durch das Ausbleiben von Nervenreizen bzw. anderer erregender Vorgänge. Calcium wird durch Na+/Ca2+-Antiporter und Ca2+-ATPasen (SERCA) aus dem Innenraum der Zelle zurück in den Extrazellulärraum bzw. das sarkoplasmatische Retikulum transportiert. Der Ca2+-Calmodulin-Komplex dissoziiert (zerfällt) und MLKP dephosphoryliert die leichten Ketten des Myosinmoleküls. Daraufhin erliegt die ATPase-Aktivität der Myosinköpfchen und der Querbrückenzyklus kann nicht mehr ablaufen.[9]
Daneben ist der folgende Mechanismus zur aktiven Relaxation bekannt: Über die Aktivierung der Endotheliale Stickstoffmonoxid-Synthase wird der Botenstoff Stickstoffmonoxid (NO) ein Gasotransmitter im entsprechenden Gefäßabschnitt freigesetzt. Stickstoffmonoxid (NO), das konstitutiv vom Gefäßendothel gebildet wird, kann in die benachbarten Glattmuskelzellen diffundieren und dort die lösliche Guanylatcyclase aktivieren. Der konsekutive Anstieg im cGMP-Spiegel führt zu einer Aktivierung der Proteinkinase G, die die Myosin-Leichte-Ketten-Phosphatase (MLKP) durch Phosphorylierung aktiviert und damit zur Relaxation der Glattmuskelzellen führt. Auch die Stimulation der β-Adrenorezeptoren, beispielsweise durch Adrenalin, führt über die Erhöhung des cAMP-Spiegels und der Aktivierung der Proteinkinase A zu einer Aktivierung der MLKP und damit zu einer Relaxation der Muskelzelle. (siehe Regulation).[9]
Regulation
Für die Regulation des Tonus der glatten Muskulatur gibt es mehrere Mechanismen, von denen zwei im Folgenden dargestellt sind:
- Myogene Regulation bezeichnet den erregenden Einfluss der Schrittmacherzellen: glatte Muskelzellen oder spezialisierte Fibroblasten-ähnliche Zellen erzeugen langsame Depolarisationswellen, die zu Aktionspotentialen führen können. Dieser Vorgang kann durch Dehnung über dehnungsabhängige Ca2-Kanäle gefördert werden. Diese Art der Regulation findet man beim Single-unit-Typ.[2]
- Neurogene Regulation setzt voraus, dass beinahe jede Muskelzelle innerviert ist. Hier erfolgt die Regulation über Nervenimpulse aus dem vegetativen Nervensystem, das sich aus Sympathikus und Parasympathikus zusammensetzt. Im Verdauungstrakt ist auch das enterische Nervensystem beteiligt:
- Sympathikus: Die Nervenzellkörper des Sympathikus sitzen im Rückenmark und ziehen zu den paravertebralen Ganglien des Grenzstrangs oder zu den prävertebralen Ganglien, wo sie über cholinerge Synapsen auf das zweite Neuron relativ organfern verschalten. Das zweite Neuron innerviert letztendlich unter anderem die glatte Muskulatur über adrenerge Synapsen. Die Wirkung ist dabei abhängig vom Rezeptor: Der α1-Rezeptor vermittelt eine Kontraktion der Muskulatur (z. B. in Blutgefäßen, der Iris, der Sphinkteren im Verdauungstrakt und der Harnblase), während der β2-Rezeptor genau das Gegenteil bewirkt: Wird er aktiviert, kommt es zur Erweiterung der Bronchien, Blutgefäße in Skelettmuskeln und des Herzens. Dabei ist zu beachten, dass die Wirkung auf den β2-Rezeptor nur zu einem geringen Anteil von Nervenfasern herrühren, weil die entsprechenden Muskeln nur sehr ungenügend innerviert sind. Von physiologisch deutlich größerer Relevanz ist die Stimulation durch Katecholamine, insbesondere Adrenalin und Noradrenalin aus dem Blutkreislauf. Alle diese Wirkungen des Sympathikus auf den Organismus kommen grundsätzlich der Vorbereitung des Körpers auf größere körperliche Anstrengung („fight-oder-flight“) zugute.[15]
- Parasympathikus: Statt einer organfernen Verschaltung von prä- auf postganglionäres Neuron wie beim Sympathikus liegt beim Parasympathikus eine relativ organnahe Verschaltung vor: Die präganglionären Fasern aus dem Rückenmark oder vom Nervus vagus ziehen zu den Cilarganglion, Ganglion oticum, Ganglion submandibulare und Ganglion pterygopalatinum oder zu Ganglien, die sich in unmittelbare Nähe zu oder gar im Organ selbst befinden. Die postganglionären Fasern erreichen die glatten Muskelzellen dann über muskarinische, cholinerge Rezeptoren. Die M1, M3 und M5-Rezeptoren gelten dabei für die glatte Muskulatur und bewirken eine Kontraktion der Bronchialmuskulatur und anderer Muskeln. In Gefäßen wiederum erklärt man die Wirkung über das Endothel: Acetylcholin soll hier an M3-Rezeptoren an Endothelzellen binden, die dann wiederum muskelrelaxierende Substanzen an die glatten Muskelzellen abgeben.[16]
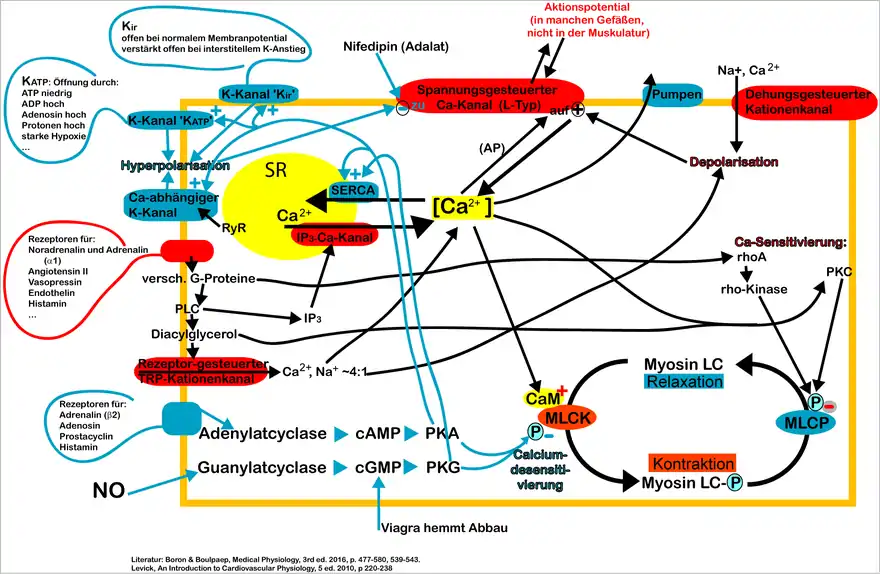
Myosin LC: Leichte Kette des Myosins. MLCK: Myosin-leichte-Kette-Kinase. MLCP: Myosin-leicht-Kette-Phosphatase. CaM: Calmodulin. ℗: Phosphorylierung. PLC: Phospholipase C. PKA, PKC, PKG: Proteinkinase A, C oder G. NO: Stickstoffmonoxid. SR: Sarcoplasmatisches Reticulum. AP: Aktionspotential.
Nicht dargestellt: Chlorid-Kanäle, Store operated Ca channel (TRPC1), Kalikum-Kanal KV, Phospholamban, α2-Rezeptor und andere.
Funktion
Glatte Muskulatur kann aufgrund ihrer Struktur und der beschriebenen Vorgänge bei der Kontraktion einen langanhaltenden Tonus (tonische Dauerkontraktion) aufrechterhalten. Sowohl die Peristaltik in Magen, Darm und Harnwegen als auch die Blutdruckregulation in den Innenwänden der Arterien beruhen auf der Wirkung glatter Muskulatur. Während der Geburt ermöglicht sie die rhythmische Kontraktion (phasisch-rhythmische Kontraktion) der Gebärmutter (Wehen).
Matrixproduktion
Glatte Muskelzellen sind zur Synthese von Kollagen und anderen Bestandteilen der extrazellulären Matrix, wie z. B. Proteoglykanen, Elastin und Laminin, befähigt.
Pathologie
Neoplasien glatter Muskelzellen heißen Leiomyome. Sie kommen vor allem im Uterus und im Gastrointestinaltrakt vor. Kommt es zur malignen Entartung des Tumors, spricht man von Leiomyosarkomen.
Siehe auch
Einzelnachweise
- Renate Lüllmann-Rauch: Taschenlehrbuch Histologie. 5. Auflage. Thieme, Stuttgart 2015, ISBN 978-3-13-129245-2, S. 238 und 260.
- Renate Lüllmann-Rauch: Taschenlehrbuch Histologie. 5. Auflage. Thieme, Stuttgart 2015, ISBN 978-3-13-129245-2, S. 264.
- Jan C. Behrends et al.: Duale Reihe: Physiologie. 3. Auflage. Thieme, Stuttgart 2016, ISBN 978-3-13-138413-3, S. 74 und 76.
- Renate Lüllmann-Rauch: Taschenlehrbuch Histologie. 5. Auflage. Thieme, Stuttgart 2015, ISBN 978-3-13-129245-2, S. 260.
- Ernst Mutschler: Anatomie, Physiologie, Pathophysiologie des Menschen. Wissenschaftliche Verlagsgesellschaft, Stuttgart 2007, ISBN 978-3-8047-2342-9, 6. Auflage.
- Renate Lüllmann-Rauch: Taschenlehrbuch Histologie. 5. Auflage. Thieme, Stuttgart 2015, ISBN 978-3-13-129245-2, S. 261.
- Renate Lüllmann-Rauch: Taschenlehrbuch Histologie. 5. Auflage. Thieme, Stuttgart 2015, ISBN 978-3-13-129245-2, S. 262.
- Renate Lüllmann-Rauch: Taschenlehrbuch Histologie. 5. Auflage. Thieme, Stuttgart 2015, ISBN 978-3-13-129245-2, S. 262 und 263.
- Jan C. Behrends et al.: Duale Reihe: Physiologie. 3. Auflage. Thieme, Stuttgart 2016, ISBN 978-3-13-138413-3, S. 76.
- Renate Lüllmann-Rauch: Taschenlehrbuch Histologie. 5. Auflage. Thieme, Stuttgart 2015, ISBN 978-3-13-129245-2, S. 263.
- Jan C. Behrends et al.: Duale Reihe: Physiologie. 3. Auflage. Thieme, Stuttgart 2016, ISBN 978-3-13-138413-3, S. 75.
- Jan C. Behrends et al.: Duale Reihe: Physiologie. 3. Auflage. Thieme, Stuttgart 2016, ISBN 978-3-13-138413-3, S. 74.
- Renate Lüllmann-Rauch: Taschenlehrbuch Histologie. 5. Auflage. Thieme, Stuttgart 2015, ISBN 978-3-13-129245-2, S. 264 und 265.
- Jan C. Behrends et al.: Duale Reihe: Physiologie. 3. Auflage. Thieme, Stuttgart 2016, ISBN 978-3-13-138413-3, S. 569.
- Jan C. Behrends et al.: Duale Reihe: Physiologie. 3. Auflage. Thieme, Stuttgart 2016, ISBN 978-3-13-138413-3, S. 560 bis 565, sowie 570 und 572.
- Jan C. Behrends et al.: Duale Reihe: Physiologie. 3. Auflage. Thieme, Stuttgart 2016, ISBN 978-3-13-138413-3, S. 564, 572 und 573.