Tegaserod
Tegaserod ist ein Arzneistoff zur Behandlung des Reizdarmsyndroms (IBS) mit Verstopfung (Obstipation) bei Frauen. Unter den Handelsnamen Zelnorm (Novartis) wurde es 2002 in den USA zugelassen. Die Wirkung entsteht durch Aktivierung der 5-HT-Rezeptoren (Serotoninagonist).
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
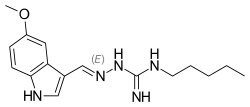 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Tegaserod | |||||||||||||||||||||
| Andere Namen |
1-{[(5-Methoxy-1H-indol-3-yl)methyliden]amino}-3-pentylguanidin | |||||||||||||||||||||
| Summenformel | C16H23N5O | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
A06AX06 | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 301,39 g·mol−1 | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Wirkungsweise
Das Medikament wird oral verabreicht und zu circa 10 %[2] resorbiert. Die Wirkung entsteht durch Aktivierung der 5-HT4-Rezeptoren im enterischen Nervensystem, wodurch es zur Stimulierung des peristaltischen Reflexes und der intestinalen Sekretion kommt. Dadurch wird die beeinträchtigte Motilität im gesamten Verdauungstrakt normalisiert.[3] IBS-bedingten Bauchschmerzen und -beschwerden werden gelindert.[4] In vitro wurde außerdem eine antagonistische Wirkung am 5-HT2B-Rezeptor gefunden.[5][3]
Vermarktung
Tegaserod wurde 2002 von der US-amerikanischen Arzneimittelbehörde (Food and Drug Administration, FDA) zugelassen als erstes Medikament zur Linderung von Bauchbeschwerden, Blähungen und Verstopfung im Zusammenhang mit dem Reizdarmsyndrom. Es war angezeigt zur kurzzeitigen Behandlung von Frauen mit Reizdarmsyndrom mit dem Hauptsymptom Obstipation. Über Wirksamkeit und Sicherheit bei Männern gibt es keine Angaben.[6]
2004 erfolgte die Erweiterung der Indikation um die Behandlung der chronischen idiopathischen Verstopfung.[7] Im März 2007 setzte Novartis die Vermarktung des Medikaments in Absprache mit der FDA in den USA aus. Die Behörde vermutete einen Zusammenhang zwischen der Einnahme des Medikaments und einem erhöhten Risiko für Herzinfarkt oder Schlaganfall. Eine Analyse der Daten von über 18.000 Patienten hatte unerwünschte kardiovaskuläre Reaktionen gezeigt bei 13 von 11.614 Patienten, die mit Tegaserod behandelt wurden (eine Rate von 0,11 %), verglichen mit 1 von 7.031 Patienten, die mit Placebo behandelt wurden (eine Rate von 0,01 %). Novartis hingegen führte die unerwünschten Wirkungen auf vorbestehende kardiovaskuläre Erkrankungen oder Risikofaktoren bei den behandelten Patienten zurück und verwies darauf, dass kein kausaler Zusammenhang mit der Tegaserodgabe habe nachgewiesen werden können.[8] Auf Wunsch der kanadischen Behörde Health Canada stellte Novartis zur gleichen Zeit auch die Vermarktung und den Verkauf des Medikaments in Kanada ein.[9]
Ein erhöhtes Risikos für kardiovaskuläre Ereignisse unter Tegaserod-Behandlung konnte in einer großen Kohortenstudie, die auf einer US-amerikanischen Krankenversicherungsdatenbank basiert, nicht festgestellt werden.[10] 2015 verkaufte Novartis die Lizenz an das Unternehmen Sloan Pharma. Im Oktober 2019 sprach sich nach einer Beurteilung durch das zuständige Advisory Committee der FDA die Mehrheit der Gutachter für die Wiederzulassung aus, so dass in den USA Tegaserod im gleichen Jahr für die Anwendung bei Reizdarmsyndrom mit Verstopfung (IBS-C) bei Frauen unter 65 Jahren wieder eingeführt wurde.[11] Der Einsatz ist nun jedoch auf Frauen beschränkt, die keine kardiovaskulären ischämischen Erkrankungen in der Vorgeschichte hatten.[3]
Ein Zulassungsantrag in der europäischen Union wurde 2005 abgewiesen, da der Ausschuss für Humanarzneimittel kein positives Nutzen-Risiko-Verhältnis gegeben sah.[12] In der Schweiz war Tegaserod als Zelmac ab 2001 auf dem Markt, bis es ebenfalls 2007 zurückgezogen wurde.[13]
Sonstiges
Pharmazeutisch eingesetzt wird Tegaserod als Tegaserodmaleat[14] (Salz der Maleinsäure).
Einzelnachweise
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- S. Appel-Dingemanse: Clinical pharmacokinetics of tegaserod, a serotonin 5-HT(4) receptor partial agonist with promotile activity. In: Clinical Pharmacokinetics. Band 41, 2002, doi:10.2165/00003088-200241130-00002.
- Zellnorm, Prescribing information. Stand: März 2019.
- Simone Rossi: AMH 2004 : Australian medicines handbook 2004. [5th ed.]. Australian Medicines Handbook Pty Ltd, Adelaide, S.A. 2004, ISBN 0-9578521-4-2.
- D T Beattie, J A M Smith, D Marquess, R G Vickery, S R Armstrong: The 5-HT4 receptor agonist, tegaserod, is a potent 5-HT2B receptor antagonist in vitro and in vivo. In: British Journal of Pharmacology. Band 143, Nr. 5, November 2004, S. 549–560, doi:10.1038/sj.bjp.0705929, PMID 15466450, PMC 1575425 (freier Volltext).
- FDA approves first treatment for women with constipation-predominant irritable bowel syndrome. 5. Februar 2007, abgerufen am 17. Februar 2021 (englisch).
- Drugs@FDA - FDA-Approved Drugs: Eintrag Zelnorm, abgerufen am 17. Februar 2021.
- Novartis suspends US marketing and sales of Zelnorm in response to request from FDA. 10. April 2007, abgerufen am 14. Februar 2021 (englisch).
- Public Communication Health Canada Endorsed Important Safety Information on Zelnorm* (tegaserod hydrogen maleate), 30. März 2007; abgerufen am 17. Februar 2021.
- Jeanne Loughlin, Sherry Quinn, Elena Rivero, Judy Wong, Jiaquing Huang: Tegaserod and the risk of cardiovascular ischemic events: an observational cohort study. In: Journal of Cardiovascular Pharmacology and Therapeutics. Band 15, Nr. 2, Juni 2010, S. 151–157, doi:10.1177/1074248409360357, PMID 20200325.
- U. S. WorldMeds: FDA approves the reintroduction of Zelnorm™ (tegaserod) for Irritable Bowel Syndrome with Constipation (IBS-C) in women under 65. Abgerufen am 14. Februar 2021 (englisch).
- Zelnorm – EPAR., EMA. Abgerufen am 17. Februar 2021.
- Switzerland follows FDA’s lead and pulls Novartis IBS drug, www.pharmatimes.com, 1. Juni 2007.
- Externe Identifikatoren von bzw. Datenbank-Links zu Tegaserod-Maleat: CAS-Nummer: 189188-57-6, EG-Nummer: 630-469-2, ECHA-InfoCard: 100.158.793, PubChem: 135413539, ChemSpider: 10482083, DrugBank: DBSALT001797, Wikidata: Q27888319.