Prodrug
Als Prodrug (das oder die Prodrug)[1] wird ein inaktiver oder wenig aktiver pharmakologischer Stoff bezeichnet, der erst durch Verstoffwechselung (Metabolisierung) im Organismus in einen aktiven Wirkstoff (Metaboliten) überführt wird.
Prodrugs sind in denjenigen Fällen von strategischer Bedeutung, in denen der eigentlich aktive Wirkstoff, würde er direkt verabreicht, nicht oder nur geringfügig oder nicht selektiv genug den gewünschten Wirkort erreicht. Das Prodrug-Konzept zielt dabei hauptsächlich auf die Verbesserung pharmakokinetischer Stoffeigenschaften ab. Die Verwendung von Prodrugs kann zum Beispiel die orale Resorption oder Bioverfügbarkeit verbessern, den First-Pass-Effekt verringern oder einen Arzneistoff dazu befähigen, die Blut-Hirn-Schranke zu passieren.
Ein Co-Drug (Mutual Prodrug) ist eine spezielle Form von Prodrug. Dabei handelt es sich um einen Arzneistoff, der im Körper in zwei oder mehr aktive Wirkstoffe umgewandelt wird. Beispiele dafür sind Fenetyllin und Sulfasalazin.[2]
Beispiele
Ein Beispiel für ein(e) Prodrug ist Levodopa, das Ausgangsstoff für die körpereigene Synthese von Adrenalin, Noradrenalin und Dopamin ist. Levodopa wird als Prodrug zur Behandlung der Parkinson-Krankheit verwendet: Nach Passieren der Blut-Hirn-Schranke wird Levodopa zu Dopamin verstoffwechselt, das dann die eigentlich gewünschte pharmakologische Wirksamkeit entfaltet.
Weitere Beispiele
- Codein und Diamorphin – aktiver Metabolit: Morphin
- Clopidogrel – ein Thrombozytenaggregationshemmer
- Metamizol – wirksamer Metabolit: 4-N-Methylaminoantipyrin (MAA)
- Myristicin – Umwandlung in das halluzinogen und euphorisierend wirkende 3-Methoxy-4,5-methylendioxyamphetamin (MMDA)
- Nabumeton – Nichtsteroidales Antirheumatikum
- Omeprazol – Magensäurehemmer
- Phenacetin – aktiver Metabolit: Paracetamol
- Ramipril und Enalapril – wirksame Metaboliten: Ramiprilat und Enalaprilat, Arzneistoffe der Gruppe der ACE-Hemmer
- Lisdexamfetamin – aktiver Metabolit: Dextroamphetamin
- Amfepramon – wirksamer Metabolit: Ethcathinon
- Adrafinil – wirksamer Metabolit: Modafinil
- Psilocybin – wirksamer Metabolit: Psilocin
Co-Drugs
- Fenetyllin – wirksame Metaboliten: Amphetamin und Theophyllin
- Sulfasalazin – wirksame Metaboliten: Sulfapyridin und 5-ASA
Resorptionsester
Eine eigene Form der Prodrugs bilden die sogenannten Resorptionsester. Man versteht darunter Verbindungen, die eigens zu dem Zweck synthetisch verestert wurden, um besser oder überhaupt erst resorbiert werden zu können. Die Veresterung verbessert die Lipophilie und erhöht die Resorption des Arzneistoffes über die Darmschleimhaut und damit seine orale Bioverfügbarkeit. Der unwirksame oder wenig wirksame Resorptionsester wird entweder bereits beim Durchtritt durch die Darmschleimhaut oder später im Plasma durch die vorhandenen körpereigenen Esterasen hydrolysiert, wobei wieder die pharmakologisch aktive Muttersubstanz entsteht.

Beispielsweise entsteht aus der virostatischen Substanz Aciclovir durch Veresterung ihrer Hydroxygruppe mit der Aminosäure Valin der Resorptionsester Valaciclovir. Das Fosamprenavir ist ein Resorptionsester des Amprenavir mit Phosphorsäure. Vereinzelt werden auch Steroidhormone mit einfachen Carbonsäuren wie Essigsäure, Valeriansäure oder Pivalinsäure zu besser resorbierbaren Derivaten verestert, wie z. B. Fludricortison-21-acetat, Cortison-21-acetat, Abirateronacetat, Estradiol-17-valerat, Prednisolon-21-pivalat, Dexamethason-21-pivalat usw.
Bestimmte Wirkstoffe mit Carboxygruppen können zu gut resorbierbaren Doppelestern vom Typ Acyloxyalkylester oder Alkoxycarbonyloxyalkylester umgesetzt werden. Dieses Prinzip wird z. B. bei oralen Cephalosporinen und Virostatika genutzt. Die Namen solcher Resorptionsester enden auf -xil oder -xetil. Das Affix davor, wie z. B. -pi-, -a- oder -pro- steht für die verwendete Säure.
- Beispiele für Cephalosporine: Cefotiamcilexetil, Cefuroximpivoxetil, Cefuroximaxetil, Cefpodoximproxetil, Cefedametpivoxil.
- Beispiele für Virostatika: Tenofovirdisoproxil, Adefovirdipivoxil
Candesartancilexetil ist der Resorptionsester des AT1-Antagonisten Candesartan.[2]
ProTides
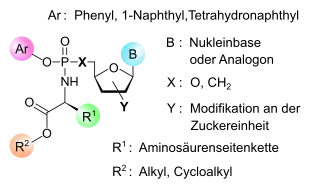
Ein von McGuigan und seinem Team an der Cardiff University entwickeltes Prodrug-Konzept stellen die Aryloxyphosphoramidat-Prodrugs („ProTide“, prodrug nucleotide) dar. Hierbei handelt es sich um Nukleotide bzw. Nukleotidanaloga, deren Phosphat- oder Phosphonatgruppe durch einen Arylsubstituenten und einen Aminosäureester maskiert ist. Dadurch wird die passive Diffusion der Substanz durch die Zellmembran hindurch an ihren Wirkort erleichtert. Nukleotidanaloga sind typische Wirkstoffe in der antiviralen Therapie. Das bevorzugte Aminosäurenmotiv für ein „ProTide“ ist das L-Alanin, die Esterkomponente bilden kurze lineare (Methyl-, Ethyl-, Pentyl-) oder verzweigte Alkyl- (Isopropyl-, Neopentyl-) und Benzylgruppen. Als Arylkomponente werden üblicherweise Phenyl- und 1-Naphthyl- verwendet. Nach Aufnahme in das Zellinnere werden die Substituenten in mehreren Schritten enzymatisch abgespalten und das Nukleotid freigesetzt, das weiterhin zu den entsprechenden biologisch aktiven Di- und Triphosphatformen phosphoryliert wird.[3][4]
Beispiele für Aryloxyphosphoramidat-Prodrugs sind etwa Tenofoviralafenamid, Sofosbuvir und Remdesivir.
Einzelnachweise
- Prodrug. In: Duden - Das große Fremdwörterbuch: Herkunft und Bedeutung der Fremdwörter (online). 4., aktualisierte Auflage. Dudenverlag, Mannheim u. a. 2007.
- Prodrugs – Arzneistoffe mit maßgeschneiderten Eigenschaften. In: Pharmazeutische Zeitung, Ausgabe 26/2011.
- M. Slusarczyk et al.: Phosphoramidates and phosphonamidates (ProTides) with antiviral activity. In: Antiviral Chemistry and Chemotherapy. Band 26 (2018), S. 1–31, doi:10.1177/2040206618775243.
- Y. Mehellou et al.: The ProTide Prodrug Technology: From the Concept to the Clinic. In: Journal of Medical Chemistry. Band 61 (2018), S. 2211–2226, doi:10.1021/acs.jmedchem.7b00734.