Reserpin
Reserpin ist ein Indolalkaloid einiger Pflanzen aus der Gruppe der Schlangenwurze, welches vor allem über die Rauvolfia serpentina aus der indischen Heilkunst Eingang in die westliche Medizin fand. Dort wurde es zu einem jener Arzneistoffe, mit denen die Ära der modernen Psychopharmakologie begann. Zuerst in der Psychiatrie als Neuroleptikum bei Schizophrenie eingesetzt, erlangte es insbesondere als Mittel gegen Bluthochdruck große Bedeutung. Während ihm infolge der Erforschung seines Wirkmechanismus nach wie vor ein hoher Stellenwert in der neurochemischen Forschung zukommt, hat es seine klinische Bedeutung heutzutage zum größten Teil eingebüßt. Nach der Einführung wesentlich effizienterer Medikamente ist Reserpin nicht mehr ein Mittel der Wahl.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
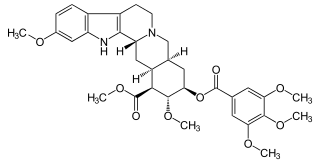 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Reserpin | |||||||||||||||||||||
| Andere Namen |
(1S,2R,3R,4aS,13bR,14aS)-2,11-Dimethoxy-3-(3,4,5-trimethoxybenzoyloxy)1,2,3,4,4a,5,7,8,13,13b,14,14a-dodecahydroindolo[2',3':3,4]pyrido[1,2-b]isochinolin-1-carbonsäuremethylester (IUPAC) | |||||||||||||||||||||
| Summenformel | C33H40N2O9 | |||||||||||||||||||||
| Kurzbeschreibung |
kristallines Pulver oder kleine Kristalle, weiß bis schwach gelb, unter Lichteinfluss langsam dunkler werdend[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code | ||||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 608,68 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Löslichkeit |
nahezu unlöslich in Wasser[3] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Herkunft
Reserpin wird aus den Wurzeln von Kletterpflanzen der Unterfamilie Rauvolfioideae gewonnen, primär aus der Indischen Schlangenwurzel (Rauvolfia serpentina), die einen Reserpin-Gehalt von 0,04–0,05 %[6] besitzt, aber auch aus der mexikanischen Rauvolfia heterophylla und der australischen Bitterrinde („Iodstrauch“; Tabernaemontana orientalis, auch Asternia constricta).[7] Eine wichtige Alternativquelle ist heute die afrikanische Rauvolfia vomitoria.[8]
Geschichte
In Indien findet die Wurzel der dort auch als „Sarpagandha“ bezeichneten Rauvolfia serpentina, welche auch Yohimbin enthält, bereits seit Jahrhunderten vor allem als Beruhigungsmittel, aber auch als Allheilmittel Verwendung.[9] Zu Beginn des 20. Jahrhunderts wurde berichtet, dass eines der über zwanzig Alkaloide der Pflanze eine blutdrucksenkende Wirkung besäße. Der erste Artikel, der sich mit dem psychiatrischen Einsatz von Reserpin auseinandersetzte, wurde im Jahr 1931 von den Indern Sen und Bose veröffentlicht, welche von guten Behandlungserfolgen bei Geisteskrankheiten mit gewalttätigen und manischen Symptomen berichteten.[10][11] 1949 wurde durch einen Bericht von Rustom Jal Vakil im „British Health Journal“[12] die blutdrucksenkende Wirkung der Rauvolfia auch in der westlichen Welt bekannt.[13]
Reserpin wurde erstmals 1952 durch Emil Schlittler aus der Rauvolfia serpentina isoliert. Ihm gelang kurze Zeit später auch die Aufklärung der chemischen Struktur.[7] Zwei Jahre später wurde es zum ersten Mal vom amerikanischen Psychiater Nathan S. Kline[11] für die Behandlung von Psychosen empfohlen und klinisch eingesetzt – zwei Jahre nach Chlorpromazin, gegen das es sich als Mittel bei schizophrenen Psychosen letzten Endes nicht durchzusetzen vermochte,[14] obgleich Reserpin nach 1952 vorübergehend eines der meistverwandten Präparate (Handelsname: Serpasil[15]) bei der Behandlung psychiatrischer Erkrankungen wurde.[16] Im selben Jahr wurde auch von Freis[17] erstmals von Patienten berichtet, die nach Gaben hoher Dosen depressiv geworden waren.[18] 1958 publizierte Robert Burns Woodward die erste Totalsynthese des Reserpins.[19] In Großbritannien wurde Reserpin aufgrund seiner enormen Nebenwirkungen für einige Jahre vom Markt genommen. Allerdings schrieb der bekannte Psychiater Manfred Bleuler noch 1969, dass die Wirkung von Reserpin bei chronisch Geisteskranken in einzelnen Fällen nachhaltiger als die von Chlorpromazin sei.[20] Um die motorischen Nebenwirkungen abzuschwächen, kam 1958 eine Kombination mit Orphenadrin (Handelsname Phasein) auf den Markt.[21] Ende der 1970er war Reserpin weitläufig durch neue, bessere Wirkstoffe ersetzt.[7][22]
Die Bedeutung des Reserpin liegt – eingedenk der Tatsache, dass es in der Therapie weitläufig durch bessere Substanzen ersetzt wurde –, vor allem in seinem Einfluss auf die Grundlagenforschung der modernen Neuropsychopharmakologie und Neuropsychiatrie: In den 1950er- und 1960er-Jahren wurden Reserpin und sein Wirkmechanismus intensiv erforscht, wodurch viele neue Erkenntnisse über biochemische Prozesse erlangt wurden, so etwa über den Stoffwechsel der biogenen Amine, die Entdeckung regional verminderter Konzentration des Neurotransmitters Dopamin im ZNS bei Parkinsonpatienten oder die Wegbereitung für die Entwicklung zahlreicher Antidepressiva auf Grundlage der Beobachtung des Reserpin-Antagonismus des MAO-Hemmers Iproniazid und des Trizyklikums Imipramin.[13][23]
In Deutschland sind keine reserpinhaltigen schulmedizinischen Präparate mehr im Handel. Die beiden einzigen Präparate, die 2006 noch zu den 3000 am häufigsten verordneten gehörten, waren Briserin N (Kombination mit dem Thiazid-Diuretikum Clopamid, Novartis) und Triniton (Kombination mit dem Antihypertonikum Dihydralazin und dem Diuretikum Hydrochlorothiazid, Apogepha). Die Verordnungshäufigkeit nahm jedoch über die Jahre ab: Gegenüber dem jeweiligen Vorjahr nahm 2005 die ärztliche Verschreibung von Briserin N um 13,1 % ab und sank auf 29,5 Millionen DDD, im Folgejahr um 14,5 % auf 25,2 Millionen DDD; bei Triniton ging sie 2005 um 6,9 % und 2006 um weitere 16 % zurück und sank zunächst auf 6,9 Millionen, dann 5,8 Millionen DDD.[24]
Die Pharmakologen Hartmut Porzig und Stefan Engelhardt vermuten, dass der Arzneistoff weniger in Verruf geraten wäre, hätte man früher nicht dergestalt hohe Dosen (gegeben wurden zur antihypertensiven Therapie bis zu 5 mg am Tag,[25] zur neuroleptischen bis zu 20 mg[26]) mit dementsprechend ausgeprägten Nebenwirkungen verabreicht, sondern deutlich niedrigere und gleichsam ausreichend wirksame Mengen.[27] Die heute üblichen Tagesdosen liegen zwischen 0,05 mg und 0,25 mg bei der Behandlung des Bluthochdrucks.[28] Bei der Behandlung der Schizophrenie waren Dosierungen von 1 bis 2 mg täglich üblich.[29]
Es gab Versuche, Reserpin-Derivate zu entwickeln, denen eine bessere Verträglichkeit beschieden sein sollte als ihrem Vorgänger. Einen Ansatz hierfür, Reserpin-Methonitrat, stellten die Inder Sreemantula, Boini und Nammi 2004 vor.[22]
Pharmakologie
Wirkmechanismus
Die Wirkung von Reserpin auf den Säugetierorganismus lässt sich in eine periphere und eine zentrale Komponente unterteilen. Während erstere für die Senkung des Blutdrucks ausschlaggebend ist, gehen auf letztere die Wirkungen zurück, deretwegen Reserpin zuerst als Neuroleptikum eingesetzt wurde, aber heute obsolet ist.
Die antihypertone Wirkung beruht auf einer Verarmung des Neurotransmitters Noradrenalin im postganglionären Sympathikus. Daher kann sich, gleichwohl sich die zentralen sympathischen Nervenzellen häufiger entladen als zuvor,[28] die Erregung nicht in die Peripherie fortsetzen. Als Folge dieser Hemmung des Sympathikus kann neben einer Senkung der Herzfrequenz (Bradykardie) auch die gewünschte Senkung des Blutdrucks beobachtet werden. Die antipsychotische Wirkung des Reserpins wird mit einer beobachteten Verringerung der Dopamin- und Serotoninkonzentration im Zentralnervensystem in Verbindung gebracht. Mit einer neuroleptischen Potenz von 20–50 CPZi[30] zählt es zu den hochpotenten Neuroleptika.
Auf zellulärer Ebene beruht der Wirkmechanismus des Reserpins auf der „Entspeicherung“ biogener Amine wie den Botenstoffen Dopamin, Serotonin und Noradrenalin. Es bindet an die nicht selektiven vesikulären Monoamintransporter in den Membranen der Speichervesikel der präsynaptischen Nervenendigungen, woraufhin die Botenstoffe nicht mehr in die Vesikel aufgenommen werden können. Insbesondere hemmt es die Neusynthese von Noradrenalin aus Dopamin, da diese im Innern der Vesikel stattfindet. Außerhalb dieser werden biogene Amine vom Enzym Monoaminooxidase („MAO“) zu Aldehyden, Ammoniak und Wasserstoffperoxid abgebaut, was zur Folge hat, dass die Menge an Noradrenalin, die bei Erregung freigesetzt werden kann, verringert wird. Zu hohe Dosierungen führen zu einer irreversiblen Schädigung der Speicherversikel, welche daraufhin neugebildet werden müssen, was einige Tage bis Wochen dauert.
Pharmakokinetik
Das peroral eingenommene Reserpin gelangt zuerst in den Magen und von dort aus in den Darm, wo es rasch resorbiert wird. Die Resorptionsrate ist bei erhöhtem pH-Wert des Magensaftes gesteigert, da der Magen nicht nur schneller entleert wird, sondern das schwach basische Reserpin zudem weniger protoniert wird und im Darm – dessen Milieu ohnehin vergleichsweise alkalisch ist – schließlich weniger in elektrisch geladener Form vorliegt, wodurch es von den Darmzellen besser resorbiert werden kann.[31] Über die Pfortader erreicht es anschließend erstmals die Leber und unterliegt daraufhin sowohl einem First-Pass-Effekt als auch einem enterohepatischen Kreislauf; in der Folge lassen sich dem Reserpin, welches nur mehr zu 50–60 % verfügbar ist, zwei Halbwertszeiten von 4,5 h bzw. 270 h zuordnen.[32] Maximale Konzentrationen des Stoffs im Blut finden sich etwa ein bis zwei Stunden nach Applikation. Reserpin wird zu 96 % an Plasmaproteine gebunden, großteils an Albumin, zu einem Teil aber auch an Lipoproteine.[33] Über die Blutbahn gelangt das Reserpin in die peripheren und zentralen Nervengewebe, in denen es seine arzneilich genutzte Wirkung entfaltet. Da die Bindung an die neuronalen Vesikel irreversibel ist, bedarf es vergleichsweise sehr kleiner Mengen des Alkaloids, um sehr große Mengen von Aminen aus ihnen zu „entspeichern“. Die Wirkung des gebundenen Anteils überdauert so den allgemeinen Abfall der Konzentration im Gewebe. Da derart geringe Mengen mit früheren Mitteln nicht aufgespürt werden konnten, wurde irrtümlicherweise angenommen, die Wirkdauer des Stoffes übersteige die seiner tatsächlichen Anwesenheit am Wirkort wesentlich. Dieser Umstand prägte seine Bezeichnung als hit and run drug. Im Weiteren wird der Löwenanteil des Reserpins verstoffwechselt und anschließend überwiegend mit den Fäzes (etwa 60 % innerhalb von vier Tagen)[34] ausgeschieden, teilweise auch über den Urin (etwa 8 %).[34]
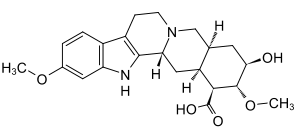
Zur Elimination findet in Darm und Leber eine enzymatische Umwandlung statt, die polare und damit besser ausscheidbare Substanzen erzeugt. Die Hauptmetaboliten – Reserpsäuremethylester, Trimethoxybenzoesäure (TMBS) und in geringerem Umfang Reserpsäure – entstehen durch von Esterasen vermittelte Spaltung der beiden Esterbindungen des Reserpin. Neben diesem hydrolytischen Weg des Abbaus findet, katalysiert von mikrosomalen Leberenzymen, oxidative Demethylierung der mittleren Methoxygruppe des TMBS-Rests statt. Das Produkt kann vom Organismus anschließend leichter hydrolysiert werden, wobei statt TMBS Syringasäure gebildet wird. Im Vergleich zur Ausgangssubstanz sind die Metaboliten pharmakologisch weitgehend inaktiv.[35][36]
Reserpin-Methonitrat (RMN) überwindet die Blut-Hirn-Schranke aufgrund des quatärnisierten Amins – ein Amin, das kovalent mit vier Kohlenstoff-Atomen verbunden ist und dadurch eine positive Ladung trägt – erheblich schwerer, was dazu führt, dass deutlich weniger Substanz in das ZNS eintritt, als es bei Reserpin der Fall ist, und zentralnervöse Nebenwirkungen (Parkinson-Symptomatik, Sedierung) stark vermindert werden.[22]
Indikation und Applikation
Der therapeutische Einsatz von Reserpin wird vor dem Hintergrund dieser Nebenwirkungen in den gängigen Lehrbüchern sehr unterschiedlich bewertet. Während in manchen die gute Verträglichkeit[25] niedrigdosierten Reserpins und seine Eignung als Kombinationspartner[37] bei unzureichender Therapie mit einem einzelnen anderen Antihypertonikum hervorgehoben wird, lehnen andere Autoren die Reserpingabe rundheraus ab, vor allem Martin Wehling spricht sich dagegen aus und bemängelt, dass es noch immer „in einem sehr beliebten Präparat enthalten [ist], das aufgrund seines niedrigen Preises gerne verschrieben wird“.[38] Auch die Arzneimittelkommission der deutschen Ärzteschaft führt die fortwährende Verordnung von Briserin N® und Triniton® u. a. auf niedrige Tagestherapiekosten zurück, erachtet es aber als billiger und sinnvoller, sich zunächst auf Diuretika zu beschränken. Sie betont aber, dass bei bereits auf Reserpin-Kombipräparate gut eingestellten Patienten, die diese Medikation auch gut vertragen, kein Grund besteht, etwas an ihr zu ändern.[39] Das letzte Reserpin-Präparat in Deutschland (Briserin N) wurde 2016 vom Markt genommen.
Diagnostisch kann Reserpin genutzt werden, um den Verdacht auf ein Karzinoid zu bestätigen. Bei diesem Reserpin-Test handelt es sich um einen Provokationstest, der auf die endokrine Aktivität des Tumors abzielt: Der Tumor produziert sehr große Mengen Serotonin, das durch Reserpin aus den Tumorzellen freigesetzt wird und die karzinoidtypische Symptomatik incl. einer drastisch erhöhten Konzentration des Serotonin-Abbauprodukts 5-HIES im Urin auslöst.[40][41]
Generell kontraindiziert ist Reserpin bei einer Vorgeschichte depressiver Episoden,[28] bei bestehenden Magen- und Zwölffingerdarmgeschwüren sowie bei Asthma bronchiale.[37]
Heute wird Reserpin als Blutdrucksenker in der Langzeittherapie üblicherweise peroral gegeben, im früheren psychiatrischen Einsatz waren aber auch intramuskuläre Injektionen üblich.[26]
Reserpin wird in den USA vom Joint National Committee (JNC 8) als alternatives Medikament zur Behandlung von Bluthochdruck empfohlen.[42] Ein Cochrane-Review befand Reserpin als ebenso wirksam wie andere Erstlinien-Antihypertensiva zur Senkung des Blutdrucks.[43] Die Kombination Reserpin mit einem Thiazid-Diuretikum ist eine der wenigen medikamentösen Behandlungen, die die Sterblichkeit in randomisierten kontrollierten Studien reduzieren, z. B. beim Programm zur Erkennung und Weiterverfolgung von Bluthochdruck (The Hypertension Detection and Follow-up Program),[44] die Veterans Administration Cooperative Study Group in Antihypertensive Agents,[45] und das Systolic Hypertension in Elderly Program.[46] Darüber hinaus wurde Reserpin als sekundäre antihypertensive Option für Patienten aufgenommen, die in der ALLHAT-Studie keine blutdrucksenkenden Ziele erreicht haben.[47] Die tägliche Dosis von Reserpin in der antihypertensiven Behandlung liegt bei nur 0,05 bis 0,25 mg.
Früher wurde Reserpin in den USA zur Behandlung von Symptomen der Dyskinesie bei Patienten mit Huntington-Krankheit eingesetzt,[48] Heute werden alternative Medikamente bevorzugt.[49]
Die Verwendung von Reserpin als antipsychotisches Medikament war fast vollständig aufgegeben worden, aber in jüngster Zeit kehrte es als Begleitbehandlung in Kombination mit anderen Antipsychotika zurück, so dass mehr refraktäre Patienten eine Dopaminblockade durch das andere Antipsychotikum und eine Dopaminabreicherung durch Reserpin erhalten. Die Dosierungen können niedrig gehalten werden, was zu einer besseren Verträglichkeit führt. Ursprünglich wurden Dosen von 0,5 mg bis 40 mg täglich zur Behandlung psychotischer Erkrankungen eingesetzt. Dosierungen über 3 mg täglich, die oft die Verwendung eines anticholinergen Medikaments erfordern, um eine übermäßige cholinerge Wirkung in verschiedenen Teilen des Körpers oder Morbus Parkinson zu behandeln. Für die Begleitbehandlung werden die Dosen in der Regel zweimal täglich bei oder unter 0,25 mg gehalten.
Tiermedizin
Reserpin wird als lang wirkendes Beruhigungsmittel verwendet, um reizbare oder schwierige Pferde zu beruhigen, und wurde illegal zur Sedierung von Turnierpferden, Pferden beim Verkauf und bei anderen Situationen, bei denen ein ruhigeres Pferd gewünscht wird, verwendet.[50]
Antibakterielle Wirkung
Reserpin hemmt die Bildung von Biofilmen von Staphylococcus aureus und hemmt die metabolische Aktivität von Bakterien in Biofilmen.[51]
Neben- und Wechselwirkungen
Wie die der meisten Antisympathotonika kann auch die Reserpingabe eine Reihe mithin schwerwiegender Nebenwirkungen nach sich ziehen. Da Reserpin die Katecholamin-Verfügbarkeit mindert und so den Sympathikotonus senkt, Acetylcholin – welches einen eigenen Carrier für den Eintritt in die Vesikel besitzt – jedoch unbeschadet lässt, überwiegt in Folge die Aktivität des Parasympathikus, und es können Pupillenverengung, Hängelider, Schwellung der Nasenschleimhaut (durch seröse Sekretion in diese, sog. „Reserpin-Schnupfen“), Libido- und Potenzverlust[37], Durchfall, Magen- und Zwölffingerdarmgeschwüre auftreten. Aus denselben Gründen kann es neben Bradykardie infolge der beeinträchtigten reflektorischen Blutdruckregulation auch zu einem lagebedingten Blutdruckabfall kommen, der vor allem bei raschem Aufrichten des Körpers so heftig sein kann, dass plötzlich Bewusstlosigkeit eintritt. Das durch Reserpin gesenkte Herzzeitvolumen normalisiert sich bei chronischer Verabreichung jedoch wieder, da mit dem Blutdruck der Gefäßwiderstand abnimmt.[28]
Reserpin kann in die Muttermilch eintreten und die Leibesfrucht schädigen. Kinder, deren Mütter im letzten Drittel der Schwangerschaft Reserpin genommen haben, leiden später häufiger an Trink- und Atemstörungen, Neugeborene können lethargisch sein, beim Fötus kann es zur Bradykardie kommen. Ebenso kann Reserpin Menstruationsbeschwerden hervorrufen.[52]
Im ZNS zeigt sich insbesondere der Mangel an Dopamin und Serotonin, welcher zu extrapyramidalmotorischen Störungen, Parkinsonismus, Sedierung und depressiven Verstimmungen bis hin zur Suizidalität führen kann.
Paul Willner[53] betont jedoch, dass die weit verbreitete Annahme, Reserpin verursache Depression, auf einer Reihe von Berichten aus den 1950ern basiert, im Rahmen derer depressive Patienten nach Goodwin et al.[54] falsch diagnostiziert worden wären. Diese hatten die den damaligen Berichten zu Grunde liegenden Daten erneut ausgewertet und waren zu dem Ergebnis gekommen, dass mit Reserpin behandelte Patienten dazu neigten, eine Pseudodepression zu zeigen, die durch psychomotorische Verlangsamung, Müdigkeit und Anhedonie gekennzeichnet ist, jedoch nicht kognitive Erscheinungen der Depression wie Hoffnungslosigkeit oder Schuldgefühle aufwies. Lediglich 5–9 % der Patienten hätten demnach Symptome einer primären Depression gezeigt, und diese hätten obendrein bereits eine Vorgeschichte affektiver Störungen gehabt.
Im Falle einer toxischen Überdosierung fallen Herzschlagfrequenz, Blutdruck und Körpertemperatur ab (wobei dem initial Blutdruck- und Herzfrequenzsteigerung vorausgehen können)[18], die Schleimhäute schwellen an und es kommt zu Benommenheit, evtl. treten auch Krämpfe auf.[55]
Bei vorausgegangener Gabe von tri- oder tetrazyklischen Antidepressiva kommt es zu einem als Reserpinumkehr[56] bezeichneten Effekt: Tri- und Tetrazyklika verhindern, dass bereits in den synaptischen Spalt entlassene Transmitter wieder in die präsynaptischen Nervenendigungen aufgenommen werden, wodurch nicht nur die Reserpinwirkung umgangen wird, sondern die motorische Erregung sogar gesteigert wird. Nach Vorbehandlung mit Reserpin wirken indirekte Sympathomimetika nicht, während die Wirkung direkter Sympathomimetika und von Hemmstoffen der Monoaminoxidase durch Reserpin verstärkt wird. Die den Blutzuckerspiegel senkende Wirkung von Antidiabetika wird von ihm verstärkt, wogegen die Antiparkinsonwirkung von Bromocriptin und Levodopa gestört werden kann. Bei gleichzeitiger Einnahme von Narkotika, Opioiden oder dem Konsum von Alkohol verstärken sich die sedativen Effekte der Substanzen gegenseitig; zu einer Verstärkung des hypotensiven Effekts kommt es in Kombination mit Vasodilatatoren und Thiaziddiuretika. Letzteres macht man sich therapeutisch zunutze: Durch die fixe Kombination von Reserpin mit den Diuretika, welche einen völlig anderen Wirkmechanismus besitzen, gleichsam aber eine Blutdrucksenkung bewirken, reichen deutlich niedrigere Dosen aus, womit auch eine wesentliche Milderung der Nebenwirkungen einhergeht. Zu einer Verstärkung des neuroleptischen Effekts, ohne Beeinflussung der Blutdruckwirkung, kommt es bei gleichzeitiger Einnahme von Phenothiazinen. Im Falle paralleler Einnahme von herzwirksamen Glycosiden kann es aufgrund der Verstärkung der Wirkung letzterer zu Herzrhythmusstörungen kommen.[57]
Chemie
Bei Reserpin handelt es sich um ein Indolalkaloid der Epialloyohimban-Reihe, was bedeutet, dass sein Grundgerüst dem des Yohimbins entspricht, die Ringe C und D aber ebenso wie die Ringe D und E cis-verknüpft sind. Dieses pentazyklische Grundgerüst – welches bereits die Leitstruktur der Tryptamine enthält – ist das der Reserpsäure. Es ist zweifach verestert: Die Säuregruppe an C-16 ist methyliert, die Hydroxygruppe der Reserpsäure an C-18 ist mit 3,4,5-Trimethoxybenzoesäure verestert.
.svg.png.webp)
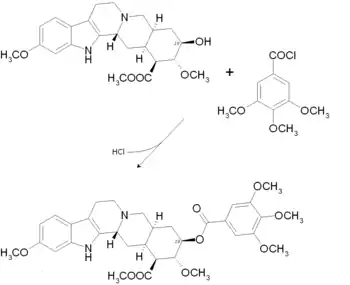
Beide Ester sind für die pharmakologische Aktivität von Reserpin von Bedeutung. Die im Rahmen der Metabolisierung in vivo stattfindenden Esterspaltungen lassen sich auch in vitro durchführen. Reserpsäuremethylester lässt sich selektiv durch Hydrolyse unter schonenden Bedingungen erhalten.[58]
Reserpin ist eine schwache Base, wobei das Stickstoffatom N-4 mit einem pKs-Wert von 6,6 (bei 25 °C) die größte Basizität aufweist, dementsprechend erfolgt dort auch die Aufnahme von Protonen.[58] Mit einem Oktanol-Wasser-Verteilungskoeffizienten (log KOW) von 3,3 handelt es sich um eine deutlich lipophile Substanz.[2] Dementsprechend wird sie in Wasser nicht, in Chloroform dagegen optimal gelöst, doch ist diese Lösung des labilen Alkaloids gerade im Tageslicht nur von geringer Haltbarkeit, während die Lösung in Ethanol zwar schwerer vonstattengeht, jedoch bezüglich der Stabilität unter den organischen Lösungsmitteln am günstigsten ist.[58]
Das feine, kristalline Pulver, als welches Reserpin vorliegt, rangiert farblich zwischen weiß, gelblich und einem bleichen Gelbbraun, färbt sich unter Lichteinfluss aber allmählich dunkler.
Reserpin hat einen spezifischen Drehwinkel von −116° bis −128° bei 20 °C im Natriumlicht.
Analytik
Mit Reserpin lassen sich verschiedene Farbreaktionen durchführen. In essigsaurer Lösung wird ihm mit Natriumnitrit Wasserstoff abgespalten, es entsteht 3,4-Dehydroreserpin. Dieses ist eine gelbgrün fluoreszierende Anhydroniumverbindung, die ein langwelliges Absorptionsmaximum von 388 nm besitzt. Reserpin selbst absorbiert maximal bei 296 nm.[59]
Biosynthese
Die Biosynthese des Reserpins beginnt – wie auch die aller anderen Epiyohimban-Alkaloide – bei Strictosidin. Dieses entsteht durch Mannich-artige Kondensation aus Tryptamin und Secologanin.
Strictosidin wird zu 3-epi-Dehydrocorynantheinaldehyd umgewandelt. Hierfür wird es zuerst am C-3 epimerisiert, die β-D-Glucose wird hydrolytisch abgespalten, der spätere Ring D geschlossen und der spätere Ring E geöffnet. Die Reihenfolge, in der diese Reaktionen stattfinden, ist noch unbekannt.
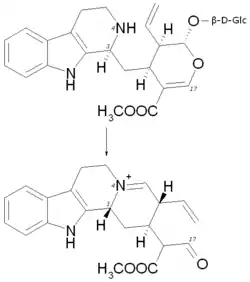
Anschließend wird 3-epi-Dehydrocorynantheinaldehyd in drei Reaktionsschritten zu Reserpsäuremethylester umgewandelt:
Zuerst wird die Doppelbindung bei N-4 stereospezifisch hydriert, so dass 3-epi-Corynantheinaldehyd vorliegt. Dann wird der spätere Ring E zwischen C-17 und C-18 geschlossen und die entstehende Doppelbindung zwischen C-19 und C-20 hydriert. Schließlich entsteht nach Hydroxylierung an C-18 und Hinzufügen zweier CH3O-Gruppen Reserpsäuremethylester.
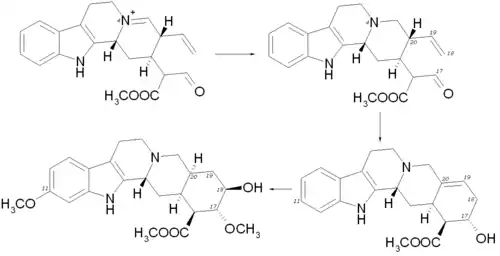
Abschließend wird Reserpsäuremethylester mit 3,4,5-Trimethoxybenzoyl-CoA an der Hydroxygruppe am C-18 zu Reserpin verestert.
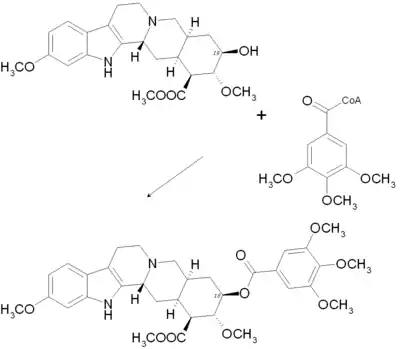
Totalsynthese
Obgleich Reserpin überwiegend aus Rauvolfia-Arten isoliert wird, ist eine vollsynthetische Herstellung möglich. In einer über 16 Reaktionsschritte verlaufenden Synthese gelang Woodward 1958 die erste (konstitutionelle) Herstellung von Reserpin.[19] 1958 war die Totalsynthese von Reserpin ein Meilenstein der organischen Chemie. Aufgrund seiner komplexen Struktur ist es mittlerweile ein Klassiker und Ziel zahlreicher Totalsynthesen geworden.[60] Einen Weg der stereospezifischen Totalsynthese etablierte 1989 Gilbert Stork.[61] Seit der Erstsynthese wurden einige alternative Zugänge entwickelt.[60][62][63]
Die Totalsynthese nach Woodward nimmt ihren Anfang beim Aufbau des Rings E, welcher fünf der sechs Stereozentren des Reserpinmoleküls enthält. Die Edukte sind 1,4-Benzochinon und Penta-2,4-diensäuremethylester. Zwischen dem Chinon und dem Dien kommt es zu einer Diels-Alder-Reaktion, deren Produkt infolge der Erhaltung der Orbitalsymmetrie bei konzertierten Reaktionen bereits drei der benötigten fünf Stereozentren enthält.

Die Reduktion des entstandenen endo-Addukts mit Aluminiumtriisopropylat wird über die cis-Verknüpfung der beiden entstandenen Ringe so gesteuert, dass vor allem der gezeigte β-Alkohol entsteht. Da sich eine der beiden Hydroxygruppen in räumlicher Nähe zum Carbonsäuremethylester befindet, bildet sich ein Lacton.
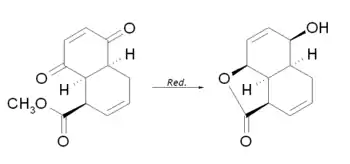
Die Reaktivität der beiden Doppelbindungen in den Ringen ist gegenüber Elektrophilen verschieden: Bei der Bromierung des C11H12O3 reagiert nur die Doppelbindung des späteren E-Rings, da sie geringfügig elektronenreicher ist.
Durch den elektrophilen Angriff des Broms bildet sich unter Abspaltung eines Bromidions das Bromoniumion. Der Sauerstoff der Hydroxygruppe öffnet diesen Dreiring durch nukleophilen Angriff an dem Kohlenstoffatom, das räumlich günstiger gelegen ist, so dass ein Furan entsteht.
.PNG.webp)
Im Folgenden wird das Brom über den nukleophilen Angriff eines Methanolations substituiert, wobei der erste der zahlreichen Methylester des Reserpin entsteht: Nachdem Bromwasserstoff eliminiert wurde und das α,β-ungesättigte Lacton entstanden ist, wird es vom Methanolation angegriffen. Der Angriff durch das Methanolation erfolgt aufgrund des Lactons und des Ethers von der α-Seite, also von unterhalb der Zeichenebene, womit das fünfte Stereozentrum des E-Rings entsteht.
Danach erfolgt die zweite Bromierung: N-Bromsuccinimid greift elektrophil an der Doppelbindung an, die im dritten Schritt nicht von Br2 aufgebrochen werden konnte. Das entstehende Bromoniumion wird durch nukleophilen Angriff von Wasser von der α-Seite transdiaxial geöffnet. Für die Reaktion dient Schwefelsäure als Katalysator.
Anschließend wird das Produkt mit Chromsäure oder Chromtrioxid oxidiert.
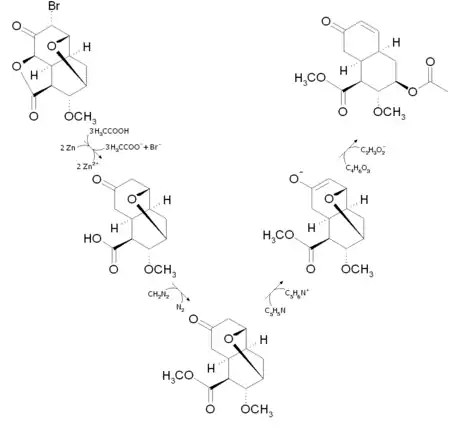
Der nächste Schritt besteht in einer komplexen Reaktion, im Rahmen derer das Bromatom entfernt, zwei Ringe aufgebrochen und ein Acetatrest hinzugefügt werden.
Der erste Schritt hierbei ist eine radikalische, reduktive Debromierung. Das zugegebene Zink macht zunächst einen Single-Electron-Transfer in das unbesetzte π*-Orbital der C–Br-Bindung, wodurch letztere sofort unter Bildung eines Bromidions gelöst wird. Es entsteht kurzfristig ein sekundäres, elektrophiles C-Radikal, welches sofort ein zweites Elektron vom Zink bekommt und zum Anion wird – mesomeriestabilisiert durch die benachbarte Carbonylgruppe –, welches von der Essigsäure protoniert wird. Die Lactonöffnung verläuft analog dazu nach vorheriger Protonierung der Lacton-Carbonylgruppe am Sauerstoff (dies senkt die Elektronendichte und damit die energetische Lage des π*-Orbitals der zu öffnenden C–O-Bindung).
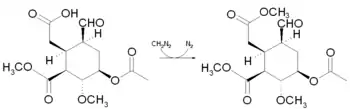
Im zweiten Schritt wird die entstandene Carboxygruppe mit Diazomethan methyliert.
Im dritten Schritt abstrahiert die schwache Base Pyridin das Proton aus dem ersten Schritt, wodurch ein Enolat entsteht. Dieses reagiert im vierten Schritt sogleich zum α-β-ungesättigten Keton zurück. Mit dem dabei abgetrennten Sauerstoffatom bildet das Essigsäureanhydrid unter Abspaltung eines Acetatanions am späteren C-18 ein Acetylester.
Als Nächstes wird der spätere D-Ring aufgespalten. Hierfür wird zuerst die Doppelbindung mit Osmiumtetroxid cis-dihydroxyliert, es entsteht ein Glycol.
Anschließend wird das Glycol oxidativ mittels Periodsäure gespalten, wodurch ein Aldehyd und ein Ketoaldehyd entsteht. Letzteres wird von Periodsäure weiter über eine Ketosäure und deren Decarboxylierung bis zur einfachen Carboxygruppe oxidiert.
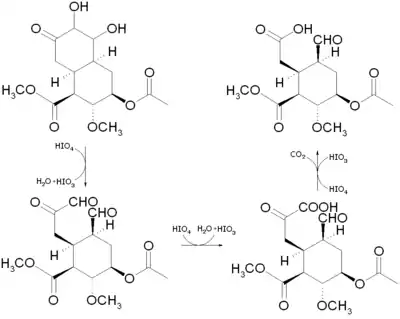
Schließlich wird die Carboxygruppe mit Diazomethan methyliert, womit der E-Ring fertig aufgebaut ist.
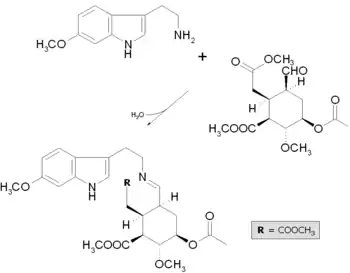
Nun wird der Aldehyd mit dem Tryptamin 6-Methoxytryptamin zu einem Aldimin kondensiert, es bildet sich also zwischen dem Kohlenstoff der Aldehydgruppe und dem Stickstoff der Aminogruppe unter Wasserabspaltung eine Doppelbindung aus.
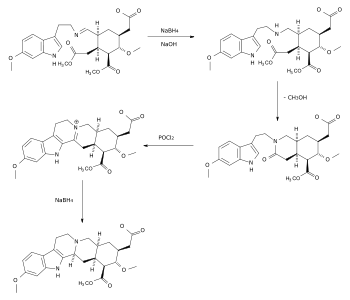
Anschließend wird das Aldimin mit Natriumborhydrid reduziert. Das Produkt cyclisiert spontan zu einem Lactam. Durch Umsetzung mit Phosphoroxychlorid erfolgt der Angriff auf das Pyrrol (Bischler-Napieralski-Reaktion), wodurch sich unter Ausbildung eines Iminiumions der C-Ring schließt. Anschließend reduziert man das Iminiumion mit Natriumborhydrid.
Aufgrund der räumlichen Struktur des Edukts greift das Hydridanion jedoch von unterhalb der Molekülebene an, wo es weniger gehindert wird. Zudem entsteht auf diese Art und Weise das thermodynamisch stabilere Produkt, was zur Folge hat, dass das gebildete Molekül ein Epimer von Reserpin ist, aber noch nicht Reserpin selbst: Zuerst muss die Konfiguration des neu entstandenen Stereozentrums am C-3 invertiert werden. Hierzu werden zuerst zwei Ester mit Kaliumhydroxid hydrolytisch gespalten, so dass an C-16 eine Carboxy- und an C-18 eine Hydroxygruppe entsteht, woraus mit Hilfe von Dicyclohexylcarbodiimid (DCC) ein Lacton aufgebaut wird. Danach haben sich die Stabilitätsverhältnisse hinreichend geändert, dass mit Pivalinsäure das Wasserstoffatom am C-3 in die nun stabilere β-Position gerückt werden kann. Nach Abschluss der Epimerisierung wird das Lacton wieder verseift.
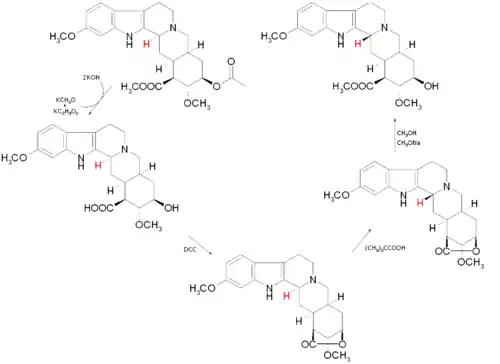
Der letzte Schritt der Totalsynthese nach Woodward besteht in der Veresterung mit 3,4,5-Trimethoxybenzoylchlorid zu racemischen (±)-Reserpin. Eine Trennung der Enantiomere gelingt durch Salzbildung mit Camphersulfonsäure und Trennung der diastereomeren Camphersulfonate, wodurch reines (−)-Reserpin erhalten werden konnte.
Handelsnamen
Monopräparat gegen Schizophrenie: Sedaraupin (D), Serpasil (D)
Kombination mit
- Bendroflumethiazid: Tensionorme (F)
- Clopamid und Dihydroergocristin: Normatens (PL)
Literatur
- Forth, Henschler, Rummel: Allgemeine und spezielle Pharmakologie und Toxikologie. Urban & Fischer, München/Jena 2001, ISBN 3-437-42520-X, S. 205–207. [Abschnitt #Wirkmechanismus]
- Stitzel: The Biological Fate of Reserpine. In: Pharmacological Reviews (1977), Vol. 28, S. 179–205. [Abschnitt #Pharmakokinetik]
- Lüllmann, Mohr, Wehling: Pharmakologie und Toxikologie. Thieme, Stuttgart 2003, ISBN 3-13-368515-5, S. 90–91, 545. [Abschnitt #Neben- und Wechselwirkungen]
- Rimpler: Biogene Arzneistoffe. Deutscher Apotheker Verlag, Stuttgart 1999, ISBN 3-7692-2413-2, S. 309–310. [Abschnitt #Biosynthese]
- Habermehl, Hammann, Krebs: Naturstoffchemie. Springer, Berlin 2002, ISBN 3-540-43952-8, S. 181–185. [Abschnitt #Totalsynthese]
Einzelnachweise
- Europäische Arzneibuch-Kommission (Hrsg.): EUROPÄISCHE PHARMAKOPÖE 6. AUSGABE. Band 6.0–6.2, 2008.
- Moffat, Osselton, Widdop, Galichet (Hrsg.): Clarke’s Analysis of Drugs and Poisons. Pharmaceutical Press, Bath 2004, ISBN 0-85369-473-7. S. 1531–1532.
- Datenblatt Reserpin bei AlfaAesar, abgerufen am 19. Februar 2010 (PDF) (JavaScript erforderlich).
- Eintrag zu Reserpin in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- Datenblatt Reserpine bei Sigma-Aldrich, abgerufen am 8. Mai 2017 (PDF).
- Roth, Daunderer, Kormann: Giftpflanzen – Pflanzengifte. Hüthig Jehle Rehm, 1994, ISBN 3-609-64810-4, S. 605.
- Giebelmann, von Meyer: Kulturgeschichtliches zu Hundsgiftgewächsen (2003; PDF; 418 kB).
- Wink, van Wyk, Wink: Handbuch der giftigen und psychoaktiven Pflanzen. Wissenschaftliche Verlagsgesellschaft, Stuttgart 2008, ISBN 3-8047-2425-6, S. 200.
- Polz: Biosynthese von Rauwolfia-Alkaloiden. München, 1989. (Diss.) S. 1–6.
- Sen, Bose: Rauwolfia serpentina, a new Indian drug for insanity and high blood pressure. In: Indian Med World (1931), Vol. 2, S. 194–201.
- Kline: Use of Rauwolfia serpentina Benth in neuropsychiatric conditions. In: Annals of the New York Academy of Sciences (1954), Vol. 59, S. 107–132.
- Vakil: Antihypertensive affects of Rauwolfia. In: British Health Journal 11, S. 350–355.
- Langer: Ausschnitte einer Geschichte der Psychopharmaka im 20. Jahrhundert. In: Langer, Heimann (Hrsg.): Psychopharmaka – Grundlagen und Therapie. Springer, Wien 1983, ISBN 3-211-81746-8. S. 25–26.
- Möller, Laux, Deister: Psychiatrie und Psychotherapie. Thieme, Stuttgart 2005, ISBN 3-13-128543-5, S. 492.
- Urs German: Medikamentenprüfungen an der Psychiatrischen Universitätsklinik Basel 1953–1980, Pilotstudie der Universität Bern, 9. März 2017.
- Wittern: Die Geschichte psychotroper Drogen vor der Ära der modernen Psychopharmaka. In: Langer, Heimann (Hrsg.): Psychopharmaka – Grundlagen und Therapie. Springer, Wien 1983, ISBN 3-211-81746-8, S. 17.
- Freis: Mental depression in hypertensive patients treated for long periods with large doses of reserpine. In: New England Journal of Medicine, Vol. 251, S. 1006–1008.
- Bebarta, Dart: Rauwolfia Alkaloids. In: Dart (Hrsg.): Medical Toxicology. Lippincott Raven, Philadelphia 2004, ISBN 0-7817-2845-2, S. 712.
- Woodward et al.: The Total Synthesis of Reserpine. In: Tetrahedron (1958), Vol. 2, S. 1–57.
- Hans Bangen: Geschichte der medikamentösen Therapie der Schizophrenie. Berlin 1992, Seite 90 ISBN 3-927408-82-4.
- Hans Bangen: Geschichte der medikamentösen Therapie der Schizophrenie. Berlin 1992, Seite 90 ISBN 3-927408-82-4.
- Sreemantula, Boini, Nammi: Reserpine methonitrate, a novel quaternary analogue of reserpine augments urinary excretion of VMA and 5-HIAA without affecting HVA in rats. In: BMC Pharmacology (2004), Vol. 4. Volltext.
- Hans Bangen: Geschichte der medikamentösen Therapie der Schizophrenie. Berlin 1992, ISBN 3-927408-82-4. S. 90–95: Neuroleptika und psychiatrische Theorienbildung
- Anlauf: Antihypertonika. In: Schwabe, Paffrath: Arzneiverordnungs-Report 2006. Springer, Berlin 2006, ISBN 3-540-34369-5, S. 418–420. Und in: Schwabe, Paffrath: Arzneiverordnungs-Report 2007. Springer, Berlin 2007, ISBN 3-540-72547-4, S. 380–381.
- Starke: Pharmakologie noradrenerger und adrenerger Systeme. In: Forth, Henschler, Rummel: Allgemeine und spezielle Pharmakologie und Toxikologie. Urban & Fischer, München/Jena 2001, ISBN 3-437-42520-X, S. 206.
- Kähler: Rauwolfia-Alkaloide. Boehringer Mannheim, Mannheim, 1970. S. 108–113.
- Porzig, Engelhardt: Pharmaka mit Wirkung auf das vegetative Nervensystem. In Estler, Schmidt (Hrsg.): Pharmakologie und Toxikologie. Schattauer, Stuttgart, 2006. S. 144.
- Porzig, Häusler: Pharmaka mit Wirkung auf das vegetative Nervensystem. In: Estler (Hrsg.): Pharmakologie und Toxikologie. Schattauer, Stuttgart/New York 2000, ISBN 3-7945-1898-5, S. 96.
- Hans Bangen: Geschichte der medikamentösen Therapie der Schizophrenie. Berlin 1992, S. 90 ISBN 3-927408-82-4.
- Mutschler, Geisslinger, Kreemer, Ruth, Schäfer-Körting: Mutschler Arzneimittelwirkungen kompakt. S. 72.
- Heintze: Pharmaka mit Wirkung auf den Gastrointestinaltrakt. In: Estler (Hrsg.): Pharmakologie und Toxikologie. Schattauer, Stuttgart/New York 2000, ISBN 3-7945-1898-5, S. 435.
- Verspohl: Neuroleptika. In: Ammon (Hrsg.): Arzneimittelneben- und -wechselwirkungen. Wissenschaftliche Verlagsgesellschaft, Stuttgart 1991, ISBN 3-8047-1155-3, S. 255.
- Chen, Danon: Binding of reserpine to plasma albumin and lipoproteins. In: Biochemical Pharmacology (1979), Vol. 28, S. 267–271.
- Beyer: Biotransformation der Arzneimittel. Springer, Berlin/Heidelberg/New York 1990, ISBN 3-540-50696-9, S. 489–490.
- Cohen: Reserpine. In: Sadée (Hrsg.): Drug Level Monitoring. John Wiley & Sons, New York/Chichester/Brisbane/Toronto 1980, ISBN 0-471-04881-X, S. 415–417.
- Hänsel, Sticher: Pharmakognosie – Phytopharmazie. Springer, Heidelberg 2007, ISBN 3-540-26508-2, S. 1421–1424.
- Mutschler, Geisslinger, Kroemer, Ruth, Schäfer-Korting: Mutschler Arzneimittelwirkungen. Wissenschaftliche Verlagsgesellschaft, Stuttgart 2008, ISBN 978-3-8047-1952-1, S. 357.
- Wehling: Herz-Kreislauf-Erkrankungen. In: Wehling (Hrsg.): Klinische Pharmakologie. Thieme, Stuttgart 2005, ISBN 3-13-126821-2.
- Arzneimittelkommission der deutschen Ärzteschaft (Hrsg.): Arzneiverordnungen: Empfehlungen zur rationalen Pharmakotherapie. Deutscher Ärzte-Verlag, Köln 2006, ISBN 3-7691-1201-6, S. 681.
- Kähler: Rauwolfia-Alkaloide. Boehringer Mannheim, Mannheim, 1970. S. 123–127.
- Roche Lexikon Medizin: Artikel Reserpin. Urban & Fischer, München 2006, ISBN 3-437-15156-8, S. 1585.
- James PA, Oparil S, Carter BL, Cushman WC, Dennison-Himmelfarb C, Handler J, Lackland DT, LeFevre ML, MacKenzie TD, Ogedegbe O, Smith SC, Svetkey LP, Taler SJ, Townsend RR, Wright JT, Narva AS, Ortiz E: 2014 evidence-based guideline for the management of high blood pressure in adults: report from the panel members appointed to the Eighth Joint National Committee (JNC 8). In: JAMA. 311, Nr. 5, Februar 2014, S. 507–20. doi:10.1001/jama.2013.284427. PMID 24352797.
- Shamon SD, Perez MI: Blood pressure-lowering efficacy of reserpine for primary hypertension. In: Cochrane Database Syst Rev. 12, Dezember 2016, S. CD007655. doi:10.1002/14651858.CD007655.pub3. PMID 27997978. PMC 6464022 (freier Volltext).
- Five-year findings of the hypertension detection and follow-up program. I. Reduction in mortality of persons with high blood pressure, including mild hypertension. Hypertension Detection and Follow-up Program Cooperative Group. In: JAMA. 242, Nr. 23, 1979, S. 2562–71. doi:10.1001/jama.242.23.2562. PMID 490882. full text at OVID
- Effects of treatment on morbidity in hypertension. Results in patients with diastolic blood pressures averaging 115 through 129 mm Hg. In: JAMA. 202, Nr. 11, 1967, S. 1028–34. doi:10.1001/jama.202.11.1028. PMID 4862069.
- Prevention of stroke by antihypertensive drug treatment in older persons with isolated systolic hypertension. Final results of the Systolic Hypertension in the Elderly Program (SHEP). SHEP Cooperative Research Group. In: JAMA. 265, Nr. 24, 1991, S. 3255–64. doi:10.1001/jama.265.24.3255. PMID 2046107.
- ((ALLHAT Officers and Coordinators for the ALLHAT Collaborative Research Group)): Major outcomes in high-risk hypertensive patients randomized to angiotensin-converting enzyme inhibitor or calcium channel blocker vs diuretic: The Antihypertensive and Lipid-Lowering Treatment to Prevent Heart Attack Trial (ALLHAT) Archiviert vom Original am 26. November 2009. In: JAMA. 288, Nr. 23, 18. Dezember 2002, S. 2981–97. doi:10.1001/jama.288.23.2981. PMID 12479763.
- Shen, Howard: Illustrated Pharmacology Memory Cards: PharMnemonics. Minireview, 2008, ISBN 978-1-59541-101-3, S. 11.
- Bhomraj Thanvi, Nelson Lo, and Tom Robinson: Levodopa‐induced dyskinesia in Parkinson's disease: clinical features, pathogenesis, prevention and treatment.Postgrad Med J. 2007 Jun; 83(980): 384–388. PMC 2600052 (freier Volltext).
- Forney B. Reserpine for veterinary use. Available at http://www.wedgewoodpetrx.com/learning-center/professional-monographs/reserpine-for-veterinary-use.html.
- Parai D, Banerjee M, Dey P, Mukherjee SK: Reserpine attenuates biofilm formation and virulence of Staphylococcus aureus. In: Microb. Pathog.. 138, Oktober 2019, S. 103790. doi:10.1016/j.micpath.2019.103790. PMID 31605761.
- Bopp, Herbst: Handbuch Medikamente. Stiftung Warentest, 2010, ISBN 978-3-86851-119-2.
- Willner: Dopaminergic Mechanisms in Depression and Mania. In: Psychopharmacology: The Fourth Generation of Progress; Raven Press, Ltd., New York, S. 925.
- Goodwin, Ebert, Bunney: Mental effects of reserpine in man: a review. In: Shader: Psychiatric complications of medical drugs. New York, Raven Press, 1972, S. 73–101.
- Mutschler, Geisslinger, Kroemer, Ruth, Schäfer-Korting: Mutschler Arzneimittelwirkungen. Wissenschaftliche Verlagsgesellschaft, Stuttgart 2008, ISBN 978-3-8047-1952-1, S. 1085.
- Kretzschmar, Stille: Psychopharmaka. In: Estler (Hrsg.): Pharmakologie und Toxikologie. Schattauer, Stuttgart/New York 2000, ISBN 3-7945-1898-5, S. 237.
- Verspohl: Neuroleptika. In: Ammon (Hrsg.): Arzneimittelneben- und -wechselwirkungen. Wissenschaftliche Verlagsgesellschaft, Stuttgart 1991, ISBN 3-8047-1155-3, S. 279–280. Und: Kurz: Antihypertensiv wirkende Stoffe. In: ibid. S. 671–672.
- Eger, Troschütz, Roth: Arzneistoffanalyse. Deutscher Apotheker Verlag, Stuttgart 1999, ISBN 3-7692-2595-3, S. 527–531.
- Auterhoff, Knabe, Höltje: Lehrbuch der Pharmazeutischen Chemie. Wissenschaftliche Verlagsgesellschaft, Stuttgart 1994, ISBN 3-8047-1356-4.
- Chen, Huan: Reserpine: A challenge for total synthesis of natural products. In: Chemical Reviews, Vol. 105, S. 4671–4706; doi:10.1021/cr050521a.
- Stork: The Stereospecific Synthesis of Reserpine. In: Pure Applied Chemistry (1989), Vol. 61, S. 439–442. Siehe auch: Org. Chem. Highlights
- Joelle Gauchet: A Comparative Analysis ot the Syntheses of Reserpine (Memento vom 14. Juli 2010 im Internet Archive), 1992 (Synthese-Varianten im schematischen Vergleich / Englisch, pdf; 665 kB)
- Literaturangaben zu einigen Originalarbeiten (Memento vom 31. März 2010 im Internet Archive) (dort ab Nr. 21; PDF; 86 kB)