2,5-Dimethoxy-4-methylamphetamin
2,5-Dimethoxy-4-methylamphetamin (DOM) ist ein vollsynthetisches Halluzinogen und gehört zur Gruppe der Amphetamine.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
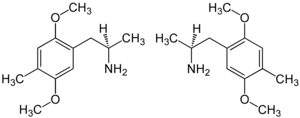 | ||||||||||||||||
| 1:1-Gemisch von Enantiomeren:
(R)-Form (links) und (S)-Form (rechts) | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | 2,5-Dimethoxy-4-methylamphetamin | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C12H19NO2 | |||||||||||||||
| Kurzbeschreibung |
weißer Feststoff (Hydrochlorid)[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 209,16 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Geschichte
DOM ist ein lang und stark wirksames Psychedelikum, das 1964 erstmals von Alexander Shulgin hergestellt wurde.[5] Der zunächst für die Substanz verwendete Name STP stammt vermutlich von der gleichnamigen Motorölmarke STP, da zu der Zeit im Pharmaceutical Chemistry Department der University of California, San Francisco (UCSF) verschiedene psychedelische Phenethylamine synthetisiert und aus unbekannten Gründen mit Motorölnamen gekennzeichnet wurden.[1] Mitte 1967 wurde DOM unter dem Namen STP generös in Haight-Ashbury in San Francisco verteilt, die Tabletten stammten vermutlich aus der Produktion von Owsley Stanley. Diese STP-Tabletten enthielten 20 mg (später 10 mg) DOM. Aufgrund der erst sehr spät eintretenden Wirkung legten viele Konsumenten nach und hatten dann bei Wirkungseinsetzen eine umso stärkere Wirkung, die zudem sehr lange (bis zu 20 Stunden) anhielt. Einige Konsumenten mögen auf diesem Wege 30 mg und mehr DOM zu sich genommen haben, wobei bereits 10 mg das volle Wirkungsspektrum entfalten. Zu jener Zeit war nicht bekannt, dass es sich bei dem verbreiteten Stoff um DOM handelte. Das war der Grund, weshalb Ärzte in den Notaufnahmen diese Symptome nicht einordnen konnten.[1]
Synthese
Ein möglicher Syntheseweg ist in PIHKAL[6] beschrieben. Der Ausgangsstoff 2,5-Dimethoxy-4-methylbenzaldehyd wird mit Nitroethan zum entsprechenden Nitropropen kondensiert und anschließend mittels Lithiumaluminiumhydrid zum Endprodukt reduziert.
Pharmakologische Eigenschaften
Pharmakokinetik
DOM ist peroral in Dosen von 3–10 mg wirksam, die Wirkdauer liegt bei 14–20 Stunden. Da die Wirkung erst nach 1,5–2 Stunden deutlich merkbar einsetzt, ist die Gefahr einer Überdosierung besonders hoch.
Wirkung
DOM scheint eine Amphetamin-ähnliche, enthemmende und gefühlsverstärkende Wirkung zu haben. Zudem berichten viele Konsumenten von verstärkter Farbwahrnehmung und visuellen Eindrücken, die zur Synästhesie mit Musik neigen. Einige Konsumenten sprechen von einer entheogenen Wirkung. DOM wirkt unter anderem als Agonist der Serotonin-Rezeptoren 5-HT2A/2C.[7]
DOM führt rasch zur Toleranz.
Wie viele andere psychoaktive Substanzen birgt auch DOM die Gefahr der Auslösung einer latenten Psychose. Körperlich unangenehm kann die Erfahrung durch Herzrasen, Tremor und Reizüberflutung werden. Da DOM extrem gering dosiert wird und die Wirkung recht spät eintritt, besteht die Gefahr einer ungewollten Überdosierung und damit verbunden besonders starken unangenehmen Nebenwirkungen.
Betäubungsmittelrechtliche Regelungen
DOM wurde durch den Suchtstoffkontrollrat der UNO im Schedule I der Konvention über Psychotrope Substanzen eingeführt und ist damit praktisch weltweit illegal.
In der Bundesrepublik Deutschland wurde DOM 1971[8] den in § 1 Abs. 1 Nr. 1 Buchst. b des Opiumgesetzes genannten Stoffen gleichgestellt. Im Rahmen der Ablösung des Opiumgesetzes durch das Betäubungsmittelgesetz erfolgte die Einstufung als nicht verkehrsfähiges Betäubungsmittel.[9] Zum Februar 1998 wurde die amtliche Schreibweise von Dimethoxymethylamphetamin im deutschen Betäubungsmittelgesetz in Anpassung an die WHO-Nomenklatur in Dimethoxymethylamfetamin geändert.[10]
Siehe auch
Literatur
- Alexander Shulgin, Ann Shulgin: PIHKAL – A Chemical Love Story Transform Press, ISBN 0-9630096-0-5
Einzelnachweise
- Alexander Shulgin, PHIKAL, S. 641f.
- Eintrag zu 2,5-Dimethoxy-4-methylamphetamin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 29. Dezember 2014.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Eintrag zu 2,5-Dimethoxy-4-Methylamphetamine in der ChemIDplus-Datenbank der United States National Library of Medicine (NLM)
- erowid.org: DOM, abgerufen am 29. Dezember 2014.
- www.erowid.org #68 DOM, aus: Alexander Shulgin, Ann Shulgin: PIHKAL – A Chemical Love Story. Transform Press, Berkeley 1995.
- Pablo R. Moya, Kelly A. Berg, Manuel A. Gutiérrez-Hernandez, Patricio Sáez-Briones, Miguel Reyes-Parada, Bruce K. Cassels, William P. Clarke: Functional Selectivity of Hallucinogenic Phenethylamine and Phenylisopropylamine Derivatives at Human 5-Hydroxytryptamine (5-HT)2A and 5-HT2C Receptors, in: Journal of Pharmacology and Experimental Therapeutics, 2007, 321 (3), 1054–1061; doi:10.1124/jpet.106.117507.
- Fünfte Betäubungsmittel-Gleichstellungsverordnung (5. BtMGLV) vom 6. April 1971 (BGBl. 1971 I S. 315); bei Eve & Rave einsehbar: online
- Anlage I zu § 1 des BtMG
- Zehnte Verordnung zur Änderung betäubungsmittelrechtlicher Vorschriften (10. BtMÄndV) vom 20. Januar 1998 (BGBl. I S. 74); bei Eve & Rave einsehbar: PDF