Oxalylchlorid
Oxalylchlorid ist eine chemische Verbindung mit der Summenformel (COCl)2. Es ist eine äußerst aggressive und stechend riechende Chemikalie. Es ist das Disäurechlorid der Oxalsäure, aus der es auch hergestellt wird. Die farblose Flüssigkeit ist aus wasserfreier Oxalsäure und Phosphorpentachlorid zugänglich.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
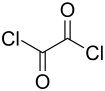 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Name | Oxalylchlorid | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C2Cl2O2 | |||||||||||||||
| Kurzbeschreibung |
farblose Flüssigkeit mit stechendem Geruch[1] | |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 126,93 g·mol−1 | |||||||||||||||
| Aggregatzustand |
flüssig | |||||||||||||||
| Dichte |
1,48 g·cm−3 (20 °C)[1] | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt |
63–64 °C[1] | |||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit |
| |||||||||||||||
| Brechungsindex |
1,434 (13 °C)[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Thermodynamische Eigenschaften | ||||||||||||||||
| ΔHf0 |
−367,6 kJ·mol−1[4] | |||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Eigenschaften
Oxalylchlorid ist eine farblose, an feuchter Luft aufgrund von Hydrolyse rauchende Flüssigkeit. Es ist leicht flüchtig, jedoch bleibt beim Verdunsten/Verdampfen oft ein Rückstand an hydrolysierter Oxalsäure zurück, die durch die Reaktion mit der Luftfeuchtigkeit entsteht. Die thermische Zersetzung führt zur Bildung von Phosgen und Kohlenmonoxid.[5]
Verwendung
Bei der Swern-Oxidation, einer selektiven Methode zur Herstellung von Aldehyden aus primären Alkoholen, dient Oxalylchlorid zur Aktivierung des Oxidationsmittels DMSO. Es wird verwendet, um aus sensiblen Alkoholen und Säuren die entsprechenden Chloralkane bzw. Säurechloride herzustellen. Trotz der geringeren Reaktivität im Vergleich zu anderen Halogenierungsmitteln wird es aufgrund der besseren Selektivität verwendet.
Ebenfalls wird es benötigt, um Oxalsäureester herzustellen, die direkt aus Oxalsäure nicht zugänglich sind, zum Beispiel Phenyloxalate für die Peroxychemolumineszenz.
Unfälle
Am 15. März 2000 erlitt ein Airbus 330 der Malaysia Airlines einen Totalschaden, als aus falsch deklarierten Kanistern Oxalylchlorid leckte. Fünf Flughafenmitarbeiter erlitten beim Umladen der Fracht Vergiftungen.[6]
Einzelnachweise
- Eintrag zu Oxalyldichlorid in der GESTIS-Stoffdatenbank des IFA, abgerufen am 8. Januar 2021. (JavaScript erforderlich)
- Eintrag zu Oxalylchlorid. In: Römpp Online. Georg Thieme Verlag, abgerufen am 4. März 2014.
- CRC Handbook of Tables for Organic Compound Identification, Third Edition, 1984, ISBN 0-8493-0303-6.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Standard Thermodynamic Properties of Chemical Substances, S. 5-21.
- V. N. Khabashesku, B. Pödör, T. Székely, A. K. Mal'tsev, O. M. Nefedov: Mass spectrometric study of thermal decomposition of oxalyl chloride at low pressures in Bulletin of the Academy of Sciences of the USSR, Division of Chemical Science 32 (1983) 722–725, doi:10.1007/BF00953463.
- Flugunfalldaten und -bericht im Aviation Safety Network (englisch)


