Sumatriptan
Sumatriptan ist ein Arzneistoff aus der Gruppe der Triptane und wird zur Akuttherapie der Migräne und des Cluster-Kopfschmerzes eingesetzt. Seit 2020 ist Sumatriptan in Deutschland in Form von Tabletten bis 50 mg ohne Rezept erhältlich.[3]
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
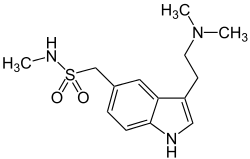 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Sumatriptan | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C14H21N3O2S | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
N02CC01 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Wirkmechanismus |
selektiver Serotoninagonist | |||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 295,40 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt |
169–171 °C[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Klinische Angaben
Anwendungsgebiete
Sumatriptanhaltige Arzneimittel sind zur Akutbehandlung der Migräne mit oder ohne Aura zugelassen. Für die Darreichungsform Injektion besteht darüber hinaus eine Zulassung zur Behandlung des Cluster-Kopfschmerzes.[4][5]
Bei einer Migräne-Attacke sollte Sumatriptan so früh wie möglich angewendet werden. Die Wirkung tritt etwa 30 Minuten nach oraler,[5] 10 bis 15 Minuten nach subkutaner[4] und 15 Minuten nach nasaler[6] Verabreichung ein.
Gegenanzeigen
Sumatriptan darf nicht bei Patienten mit Herzinfarkt, Verdacht auf ischämische Herzkrankheit, koronaren Vasospasmen (Prinzmetal-Angina), peripheren Erkrankungen der Blutgefäße, mittelschwerem bis schwerem oder unkontrolliertem Bluthochdruck angewendet werden, ferner nicht bei bei bekannter Überempfindlichkeit gegen den Wirkstoff. Bei bekannten schweren Leberfunktionsstörungen und vorübergehenden ischämischen Attacken in der Krankheitsgeschichte sollte Sumatriptan ebenso nicht eingesetzt werden.
Sumatriptan darf nicht gleichzeitig mit Mutterkornalkaloiden und deren Abkömmlingen (z. B. Ergotamin, Dihydroergotamin) angewendet werden, da eine erhöhte Gefahr von Vasospasmen besteht. Ebenso darf Sumatriptan frühestens zwei Wochen nach dem Ende einer Behandlung mit Monoaminooxidase-Hemmern angewendet werden, da diese den Abbau von Sumatriptan hemmen. Es besteht die Möglichkeit einer Kreuzallergie mit Sulfonamiden.[5]
Anwendung während Schwangerschaft und Stillzeit
Nach Markteinführung liegen Daten zur Anwendung von Sumatriptan während der ersten drei Schwangerschaftsmonate von über 1000 Frauen vor. Die Erfahrungen mit der Anwendung von Sumatriptan im zweiten und dritten Trimenon der Schwangerschaft sind begrenzt. Bisherige Erfahrungen deuten nicht auf ein erhöhtes Risiko von Missbildungen während der Schwangerschaft hin. Tierexperimentelle Studien an Kaninchen haben eine embryotoxische Wirkung von Sumatriptan gezeigt.[5]
Sumatriptan geht in die Muttermilch über. Eine potenzielle Gefährdung des Kindes kann durch Abpumpen und Verwerfen der Muttermilch bis 12 Stunden nach der Sumatriptaneinnahme vermieden werden.[5]
Nebenwirkungen
Eine der am häufigsten diskutierten, wenngleich seltenen Nebenwirkungen der Anwendung von Sumatriptan sind der Angina Pectoris ähnliche Druck- und Beklemmungsgefühle der Brust, die auf eine Konstriktion der Herzkranzgefäße zurückgeführt werden. Im Tierexperiment konnte jedoch erst in vielfach höheren Konzentrationen der Substanz im Blut eine Verengung der Koronarien erzeugt werden. Ein Blutdruckanstieg ist ebenfalls bei einigen Patienten zu beobachten.
Nach der Einnahme hoher Dosen Sumatriptan kann sich die Farbe des Blutes ins Grün-Schwarze verändern. Dies wird Sulfhämoglobinämie genannt und entsteht dadurch, dass der in der Substanz in Form einer Sulfonamidgruppe enthaltene Schwefel in Hämoglobin eingebaut wird.[7] Bei einem durchschnittlich großen erwachsenen Mann können 200 mg täglich diese Farbveränderung hervorrufen.
Wechselwirkungen
Wenngleich die Datenlage begrenzt ist, besteht die Gefahr einer Verstärkung der Nebenwirkungen von Mutterkornalkaloiden bei gleichzeitiger Anwendung mit Sumatriptan. Sumatriptan sollte daher nicht mit Ergotamin kombiniert eingesetzt werden (siehe Gegenanzeigen). Nach einer Anwendung von Ergotamin sollte ein Sicherheitsabstand von mindestens 24 Stunden vor einer Sumatriptantherapie eingehalten werden, im entgegengesetzten Fall sollte der zeitliche Mindestabstand 6 Stunden betragen.
MAO-Hemmer können durch eine Hemmung des Abbaus von Sumatriptan und dem körpereigenen Serotonin die Wirkungen und Nebenwirkungen dieser Substanzen verstärken. Daher ist die gleichzeitige Anwendung von Sumatriptan und MAO-Hemmern kontraindiziert.[5]
In seltenen Fällen können bei gleichzeitiger Einnahme eines Triptans und eines Antidepressivums aus der Gruppe der SSRI (Selektive Serotonin-Wiederaufnahmehemmer) oder der SNRI (Selektive Serotonin- und Noradrenalin-Wiederaufnahmehemmer) potenziell lebensbedrohliche Wechselwirkung des Serotonin-Syndroms auftreten. Dabei kumuliert zu viel Serotonin im Nervensystem, und dessen Wirkung wird durch Sumatriptan verstärkt. Symptome des Serotoninsyndroms können Ruhelosigkeit, Halluzinationen, Verlust der Koordination, schneller Herzschlag, Blutdruckschwankungen, erhöhte Körpertemperatur, gesteigerte Reflexe, Übelkeit, Erbrechen, Durchfall und Tod einschließen.[8]
Pharmakologie
Wirkmechanismus
Sumatriptan ist ein selektiver Agonist an den Serotonin-Rezeptoren 5-HT1B, 5-HT1D und 5-HT1F, welche auf zerebralen Blutgefäßen und präsynaptisch auf Neuronen vorkommen. Eine Aktivierung dieser Rezeptoren durch Sumatriptan führt zu einer Verengung der während eines Migräneanfalls erweiterten (dilatierten) zerebralen Blutgefäße. Andererseits führt Sumatriptan zu einer Verminderung der Ausschüttung von Blutgefäße dilatierenden und Schmerz auslösenden Entzündungsmediatoren wie Serotonin, Calcitonin Gene-Related Peptide (CGRP) und Substanz P.[9]
Da Sumatriptan nur eine schlechte orale Bioverfügbarkeit besitzt und die Blut-Hirn-Schranke nur unzureichend passieren kann, wurden zahlreiche sogenannte „Triptane der 2. Generation“ mit verbesserten pharmakokinetischen Eigenschaften entwickelt.
Pharmazeutische Informationen
Sumatriptan war das erste arzneimittelrechtlich zugelassene Triptan und kam 1991 unter dem Markennamen Imitrex (USA) und wenig später als Imigran (D, CH, A) auf den Markt. Da der Patentschutz des Arzneistoffs seit Mai 2006 abgelaufen ist, stehen mittlerweile zahlreiche Generika zur Verfügung. Für Sumatriptan stehen verschiedene Applikationsformen zur Verfügung. Neben oralen Darreichungsformen (Tabletten mit 50 oder 100 mg) sind auch nichtorale Sumatriptanpräparate wie Zäpfchen, Nasensprays, Fertigspritzen oder Pens zur subkutanen Verabreichung zugelassen. Nichtorale Darreichungsformen können insbesondere bei ausgeprägter Migräneübelkeit mit Erbrechen vorteilhaft sein. Nasale und subkutane Darreichungsformen sollen einen schnelleren Wirkeintritt ermöglichen. Die niedrige orale Bioverfügbarkeit lässt sich durch eine subkutane Verabreichung des Wirkstoffs umgehen.
Eine feste Kombination von Sumatriptan mit Naproxen ist seit 2008 auf dem Markt in den Vereinigten Staaten. Im Januar 2013 wurde ein Sumatriptan-Iontophorese-Pflaster in den Vereinigten Staaten zugelassen.[10]
Literatur
- A. Schuurmans, C. van Weel: Pharmacologic treatment of migraine. Comparison of guidelines. In: Can Fam Physician. 51, Juni 2005, S. 838–843. PMID 15986940
Einzelnachweise
- The Merck Index. An Encyclopaedia of Chemicals, Drugs and Biologicals. 14. Auflage. 2006, ISBN 0-911910-00-X, S. 1544.
- Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von 1-[3-(2-dimethylaminoethyl)-1H-indol-5-yl]-N-methylmethanesulfonamide im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 12. Juli 2020.
- Avoxa-Mediengruppe Deutscher Apotheker GmbH: Migräne: Sumatriptan ab 1. Oktober als OTC. Abgerufen am 18. Januar 2022.
- Fachinformation Imigran Injekt, GlaxoSmithKline GmbH & Co. KG. Stand Juni 2021.
- Fachinformation Imigran 50/100 mg Filmtabletten, GlaxoSmithKline GmbH & Co. KG. Stand Juli 2018.
- Fachinformation Imigran Nasal, GlaxoSmithKline GmbH & Co. KG. Stand Juni 2021.
- Wenn Sulfhämoglobin das Blut dunkelgrün färbt. (Memento vom 4. März 2016 im Internet Archive) auf: aerzteblatt.de
- FDA Public Health Advisory: Combined Use of 5-Hydroxytryptamine Receptor Agonists (Triptans), Selective Serotonin Reuptake Inhibitors (SSRIs) or Selective Serotonin/Norepinephrine Reuptake Inhibitors (SNRIs) May Result in Life-threatening Serotonin Syndrome. 19. Juli 2006.
- V. Limmroth: Wirkungsmechanismus der Triptane. In: Pharmazie in unserer Zeit. Band 31, Nr. 5, 2002, S. 458–461, doi:10.1002/1615-1003(200209)31:5<458::AID-PAUZ458>3.0.CO;2-G, PMID 12369163.
- NuPathe's Zecuity Approved by the FDA for the Acute Treatment of Migraine.