Ketanserin
Ketanserin ist ein Arzneistoff aus der Gruppe der Serotoninantagonisten, der zur Behandlung des Bluthochdrucks (Hypertonie) eingesetzt wird. Ketanserin ist im deutschsprachigen Raum nicht zur Therapie zugelassen. In der experimentellen Pharmakologie findet Ketanserin bei der Untersuchung von Arzneimittelwirkmechanismen Anwendung. Der Wirkstoff wurde 1980 von Janssen Pharmaceutica patentiert.[1]
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
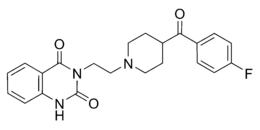 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Freiname | Ketanserin | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C22H22FN3O3 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||||||||
| ATC-Code |
C02KD01 | |||||||||||||||||||||
| Wirkstoffklasse | ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 395,43g·mol−1 | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| pKS-Wert |
7,5[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Chemie
Ketanserin ist eine polycyclische chemische Verbindung, die zu den aromatischen Ketonen, Lactamen und Piperidin-Derivaten zählt. Als Arzneistoff wird das Tartrat verwendet.[1]
Synthese
Für die Herstellung von Ketanserin sind verschiedene Verfahren ausgehend von 4-(4-Fluorbenzoyl)piperidin beschrieben. So ist eine Synthese ausgehend von 2,3-Dihydro-5H-oxazol[2,3-b]chinazolin-5-on und 4-(4-Fluorbenzoyl)piperidin möglich.[3] Auch die Kondensation von 3-(2-Chlorethyl)-2,4-(1H,3H)-chinazolindion mit 4-(4-Fluorbenzoyl)piperidin in Gegenwart von Natriumcarbonat in 4-Methyl-2-pentanon führt zum Endprodukt Ketanserin.[4] Zur Herstellung von radioaktiv mit 3H oder 14C markiertem Ketanserin ist ein mehrstufiger Prozess, der auf einer Kondensation von 4-(4-Fluorbenzoyl)piperidin mit N-(2-Bromethyl)-2-nitrobenzamid, einer Reduktion mit Wasserstoff unter Platin-Kohle-Katalyse und einer Zyklisierungsreaktion mit Harnstoff basiert, beschrieben. Das radioaktive Isotop wird dabei in Form des Wasserstoffs bzw. des Harnstoffs eingefügt.[5]
Pharmakologie
Wirkweise (Pharmakodynamik)
Ketanserin ist ein mäßig selektiver Serotoninantagonist. Seine höchste Affinität besitzt er zum Serotonin-Rezeptor 5-HT2A, den er bereits in Konzentrationen von etwa 1 nmol/l hemmt. In höheren Konzentrationen vermag Ketanserin auch andere Serotonin-Rezeptoren, insbesondere 5-HT2C, zu hemmen.
Die Blutdruck senkende Wirkung des Ketanserins wird jedoch vorrangig mit einer Hemmung von Adrenozeptoren des Typs α1 in Verbindung gebracht, die Ketanserin in therapeutischer Dosierung ebenfalls blockiert.[6] Auch an Histamin-Rezeptoren des Typs H1 vermag Ketanserin in therapeutischen Konzentrationen zu binden.[7] Somit können seine pharmakologischen Wirkungen auf eine komplexe Hemmung Serotonin-, (Nor-)Adrenalin- und Histamin-vermittelter Signalweiterleitungswege zurückgeführt werden.
In höheren Konzentrationen hemmt Ketanserin zusätzlich unter anderem hERG-Kalium-Kanäle und kann dadurch zu einer Verlängerung der QT-Zeit im EKG und somit Herzrhythmusstörungen führen.[8]
Pharmakokinetik
Nach seiner Freisetzung aus einer oralen Arzneiform wird Ketanserin zu etwa 50 % in den systemischen Kreislauf aufgenommen. Im Blutkreislauf liegt es zu 95 % an Plasmaproteine gebunden vor. Ketanserin unterliegt einer ausgeprägten Verstoffwechslung. Sein Hauptmetabolit ist das pharmakologisch inaktive Ketanserinol, das vorwiegend über den Urin ausgeschieden wird. Die Eliminierung erfolgt mit einer triphasischen Kinetik, wobei die terminale Plasmahalbwertzeit etwa 14 Stunden beträgt.[9][10]
Klinische Anwendung
Anwendungsgebiete (Indikationen)
Ketanserin ist ein blutdrucksenkendes Mittel (Antihypertensivum). Im deutschsprachigen Raum ist es nicht für diesen Zweck zugelassen. Auch in anderen Ländern wurden die möglichen Anwendungsgebiete für Ketanserin stark eingeschränkt. Daher wird Ketanserin praktisch nur noch als Reservemittel bei kritischen Blutdruckanstiegen insbesondere während einer Operation oder einer Gestose[11] eingesetzt.
Durch seinen Antagonismus am Serotonin-Rezeptor 5-HT2A blockiert Ketanserin die Wirkung vieler an diesem Rezeptortyp bindenden klassischen Psychedelika wie z. B. LSD oder Psilocybin, es wird aus diesem Grund von Konsumenten als Mittel bei Überdosierungen angewendet (Off-Label-Use).[12]
Gegenanzeigen (Kontraindikationen)
Auf Grund der Möglichkeit der Verlängerung der QT-Zeit im Elektrokardiogramm ist Ketanserin bei verschiedenen Herzrhythmusstörungen, einschließlich AV-Block zweiten oder dritten Grades, Bradykardie mit unter 50 Schlägen pro Minute, ventrikulärer Tachykardie, Kammerflimmern und Sick-Sinus-Syndrom, kontraindiziert. Darüber hinaus dar Ketanserin nicht bei bekannter Überempfindlichkeit gegen diesen Wirkstoff und bei einer Hypokaliämie angewendet werden.
Unerwünschte Arzneimittelwirkungen
Zu den häufigsten unter der Anwendung von Ketanserin beobachteten Nebenwirkungen zählen Mundtrockenheit, Gewichtszunahme, Benommenheit, Müdigkeit und Kopfschmerz. In klinischen Studien konnten zudem mehrere Fälle von QTc-Zeit-Verlängerung[13] bis hin zu schwerwiegenderen Herzrhythmusstörungen, einschließlich ventrikulärer Tachykardie und Torsade de pointes, beobachtet werden.[10]
Handelspräparate
Ketanserin ist derzeit in Europa lediglich in den Niederlanden unter dem Markennamen Ketesin auf dem Markt. Ketanserinpräparate, die zuvor in anderen europäischen Staaten im Verkehr waren, wie Aseranox (GB), Perketan (I), Serepress (I) und Sufrexal (B, CH, CZ, DK, P, PL, T), sind mittlerweile außer Handel.[14]
Einzelnachweise
- Eintrag zu Ketanserin. In: Römpp Online. Georg Thieme Verlag, abgerufen am 12. Juli 2019.
- Für diesen Stoff liegt noch keine harmonisierte Einstufung vor. Wiedergegeben ist eine von einer Selbsteinstufung durch Inverkehrbringer abgeleitete Kennzeichnung von Ketanserin im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 3. Juli 2020.
- Signorini R, Verga A. (1982). Process for preparing ketanserine. EP 0098499, IT 1155357
- Blancafort P et al.: Ketanserin. In: Drugs Fut. 6, Nr. 11, 1981, S. 684.
- Janssen CG, Lenoir HA, Thijssen JB, Knaeps AG, Verluyten WL, Heykants JJ: Synthesis of 3H- and 14C-ketanserin. In: J Label Compd Radiopharm. 25, Nr. 7, 1988, S. 783–792.
- van Zwieten PA, Blauw GJ, van Brummelen P: Pharmacological profile of antihypertensive drugs with serotonin receptor and alpha-adrenoceptor activity. In: Drugs. 40, Nr. Suppl 4, 1990, S. 1–8; discussion 28–30. PMID 1982649.
- Marin J, Reviriego J, Fernandez-Alfonso MS: Ability of ketanserin to block different receptors in human placental vessels. In: J. Pharm. Pharmacol.. 42, Nr. 3, März 1990, S. 217–220. PMID 1974625.
- Tang Q, Li ZQ, Li W, et al.: The 5-HT2 antagonist ketanserin is an open channel blocker of human cardiac ether-à-go-go-related gene (hERG) potassium channels. In: Br J Pharmacol.. 155, Nr. 3, Oktober 2008, S. 365–373. doi:10.1038/bjp.2008.261. PMID 18574455. PMC 2567890 (freier Volltext).
- Persson B, Heykants J, Hedner T: Clinical Pharmacokinetics of ketanserin. In: Clin Pharmacokinet. 20, Nr. 4, April 1991, S. 263–279. PMID 2036747.
- Vanhoutte P, Amery A, Birkenhäger W, et al.: Serotoninergic mechanisms in hypertension. Focus on the effects of ketanserin. In: Hypertension. 11, Nr. 2, Februar 1988, S. 111–133. PMID 3277910.
- Steyn DW, Odendaal HJ: Serotonin antagonism and serotonin antagonists in pregnancy: role of ketanserin. In: Obstet Gynecol Surv. 55, Nr. 9, September 2000, S. 582–9. PMID 10975485.
- Franz X. Vollenweider, Erich Seifritz, Jan Flemming, Thomas Pokorny, Leonhard Schilbach: Role of the 5-HT2A Receptor in Self- and Other-Initiated Social Interaction in Lysergic Acid Diethylamide-Induced States: A Pharmacological fMRI Study. In: Journal of Neuroscience. Band 38, Nr. 14, 4. April 2018, S. 3603–3611, doi:10.1523/JNEUROSCI.1939-17.2018, PMID 29555857 (jneurosci.org [abgerufen am 11. Februar 2019]).
- Torsten Kratz, Albert Diefenbacher: Psychopharmakotherapie im Alter. Vermeidung von Arzneimittelinteraktionen und Polypharmazie. In: Deutsches Ärzteblatt. Band 116, Heft 29 f. (22. Juli) 2019, S. 508–517, S. 512.
- JustScience: IndexNominum: Monographie: Ketanserin (Rec.INN). Abgerufen am 19. Juli 2010.