Alosetron
Alosetron (Handelsname: Lotronex® (USA); Hersteller: Prometheus) ist ein Arzneistoff aus der Gruppe der Setrone, der in den USA zur Behandlung des Reizdarmsyndroms eingesetzt wird. Der Wirkstoff wurde 1989 von Glaxo Wellcome als Ulcusmittel patentiert.[1] Verwendet wird das Hydrochlorid.[1]
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
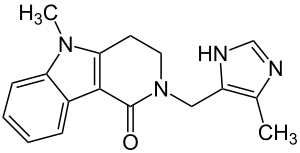 | ||||||||||||||||
| Allgemeines | ||||||||||||||||
| Freiname | Alosetron | |||||||||||||||
| Andere Namen |
5-Methyl-2-[(4-methyl-1H-imidazol-5-yl)methyl]-3,4-dihydro-2H-pyrido[4,3-b]indol-1(5H)-on (IUPAC) | |||||||||||||||
| Summenformel |
| |||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Arzneistoffangaben | ||||||||||||||||
| ATC-Code |
A03AE01 | |||||||||||||||
| Wirkmechanismus |
selektive Blockade zentraler 5-HT3-Rezeptoren | |||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | ||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||
Klinische Angaben
Anwendungsgebiete (Indikationen)
In den USA kann Alosetron zur Behandlung von Frauen, die unter einem schweren Reizdarmsyndrom mit Durchfall als Leitsymptom leiden, eingesetzt werden, wenn sie
- 6 Monate oder länger unter Symptomen des Reizdarms leiden,
- keine anatomischen oder biochemischen Anomalien des Verdauungstrakts haben, und
- nicht ausreichend auf die übliche Behandlung angesprochen haben.[4]
Bei Männern ist Alosetron nicht ausreichend untersucht.
Ärzte, die Alosetron verschreiben wollen, müssen sich in einem Verordnerregister beim Hersteller einschreiben und vor Verordnung des Arzneimittels umfassend aufklären und eine schriftliche Patient-Arzt-Vereinbarung mit der Patientin abschließen.
Unerwünschte Wirkungen (Nebenwirkungen)
Bei bis zu 30 % der Patienten kommt es zu einer Verstopfung. Andere häufige Nebenwirkungen sind Übelkeit, Unwohlsein oder Bauchschmerzen. Bei ca. ein bis zwei von 1000 behandelten Patienten (1–2 ‰) kam es zu schweren Verstopfungen mit der Notwendigkeit chirurgischer Eingriffe und ischämischen Darmentzündungen, z. T. mit Todesfolge.
Pharmakologische Eigenschaften
Wirkungsmechanismus (Pharmakodynamik)
Alosetron ist ein selektiver Hemmstoff der 5-HT3-Rezeptoren (Serotonin-Rezeptoren). Diese kommen unter anderem im Magen-Darm-Trakt in besonders hoher Dichte vor. Wie andere 5-HT3-Rezeptorantagonisten wirkt Alosetron zumindest im Tierexperiment gegen Erbrechen.[5] Darüber hinaus verlangsamt Alosetron die Bewegung des Stuhls durch den Darmtrakt. Auf Grund dieser pharmakologischen Eigenschaft wird Alosetron in der Therapie des Reizdarmsyndroms eingesetzt.
Geschichtliches
Alosetron wurde bei GlaxoSmithKline (GSK) entwickelt und Anfang 2000 nach nur siebenmonatiger Bearbeitung des Zulassungsantrags durch die US-amerikanische Arzneimittelbehörde FDA für die Behandlung des Reizdarmsyndroms zugelassen. Bereits nach neun Monaten wurde es Ende 2000 wegen schwerer Verstopfungen mit der Notwendigkeit chirurgischer Eingriffe, ischämischer Darmentzündungen und Todesfällen vorübergehend vom Markt genommen. Seit Mitte 2002 ist Lotronex in den USA mit einer eingeschränkten Zulassung und unter Auflagen wieder im Handel. Damit ist Alosetron, neben z. B. Bupropion und Natalizumab, einer der wenigen Wirkstoffe, die nach einem Rückruf aufgrund von Sicherheitsbedenken wieder in den Handel kamen.
Es ist nicht bekannt, ob jemals ein Zulassungsantrag für die EU gestellt wurde.
Ende 2007 verkaufte GSK Lotronex an das kalifornische Unternehmen Prometheus.[6]
Kritik
Die Arbeitsweise der FDA wurde in einem Leitartikel der renommierten britischen Medizinzeitschrift Lancet durch ihren Herausgeber Richard Horton am Beispiel von Alosetron in ungewöhnlich scharfer Form kritisiert.[7] Horton beschuldigte die FDA, »Handlanger der Industrie« geworden zu sein.
Einzelnachweise
- Eintrag zu Alosetron. In: Römpp Online. Georg Thieme Verlag, abgerufen am 27. Juni 2019.
- The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals. 14. Auflage. Merck & Co., Whitehouse Station NJ 2006, S. 55, ISBN 978-0-911910-00-1.
- Dieser Stoff wurde in Bezug auf seine Gefährlichkeit entweder noch nicht eingestuft oder eine verlässliche und zitierfähige Quelle hierzu wurde noch nicht gefunden.
- Prometheus Laboratories Inc. Prescribing Information Lotronex. Stand April 2008.
- M Camilleri: Pharmacology and clinical experience with alosetron. In: Expert Opin Investig Drugs. 9, Nr. 1, Januar 2000, S. 147–159. doi:10.1517/13543784.9.1.147. PMID 11060667.
- Presseerklärung vom 7. November 2007. (Memento vom 14. Juli 2012 im Webarchiv archive.today) Prometheus Laboratories Inc. (englisch) abgerufen am 27. August 2008.
- R. Horton: Lotronex and the FDA: a fatal erosion of integrity. In: Lancet, 2001, 357, S. 1544–1545; PMID 11377636.