Succinonitril
Succinonitril (Bernsteinsäuredinitril) ist ein wasserlösliches α,ω-Dinitril, das sich von der Bernsteinsäure ableitet, die als Plattformchemikalie aus nachwachsenden Rohstoffen[6] in neuerer Zeit größeres Interesse gefunden hat.
| Strukturformel | ||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
| Allgemeines | ||||||||||||||||
| Name | Succinonitril | |||||||||||||||
| Andere Namen |
| |||||||||||||||
| Summenformel | C4H4N2 | |||||||||||||||
| Kurzbeschreibung | ||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||
| ||||||||||||||||
| Eigenschaften | ||||||||||||||||
| Molare Masse | 80,09 g·mol−1 | |||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||
| Dichte | ||||||||||||||||
| Schmelzpunkt | ||||||||||||||||
| Siedepunkt | ||||||||||||||||
| Dampfdruck | ||||||||||||||||
| Löslichkeit | ||||||||||||||||
| Brechungsindex |
1,4173 (60 °C)[3] | |||||||||||||||
| Sicherheitshinweise | ||||||||||||||||
| ||||||||||||||||
| Toxikologische Daten | ||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | ||||||||||||||||
Biobasiertes Succinonitril ist auch aus den Aminosäuren L-Glutaminsäure und L-Glutamin zugänglich[7] und könnte als Rohstoff für den potentiellen Polyamid-Baustein Putrescin dienen.
Herstellung
Die erste Synthese von Succinonitril (hier als Cyanäthylen bezeichnet) wurde bereits 1861 berichtet.[8][9] Bei der Reaktion von 1,2-Dibromethan mit Kaliumcyanid in Ethanol im Sinne einer Kolbe-Nitrilsynthese entsteht Succinonitril.
In der Organikumsvorschrift[10] wird für diese Reaktion eine Ausbeute 50 % angegeben.
Die Reaktion von Cyanwasserstoff mit Acrylnitril in Gegenwart des Samarium-Komplexes Cp*2Sm(thf)2 [(Pentamethylcyclopentadienyl)2Sm(tetrahydrofuran)2], auch als Decamethylsamarocen[11] bezeichnet, führt in 89%iger Ausbeute zu Succinonitril.[12]
Bei der Reaktion von gasförmigem Ethylenoxid und Cyanwasserstoff bei 350–400 °C an einem Kieselgel-Kontakt entsteht ebenfalls Succinonitril in bescheidenen Ausbeuten.[13]
Durch Ammonoxidation von 1,3-Butadien an einem Titan-Wolfram-Kontakt soll ebenfalls Succinonitril erhalten werden.[14]
Die industrielle Standardroute zu Succinonitril ist die Addition von Cyanwasserstoff an Acrylnitril, z. B. in Gegenwart von alkalischen Medien[15] oder Trialkylaminen wie Triethylamin,[16][17][18]
wobei unter relativ milden Reaktionsbedingungen (um 60 °C) sehr gute Ausbeuten bis 95 % und Reinheiten bis 99,5 % erzielt werden können. Die Zugabe von N,N-Dimethylformamid oder N,N-Dimethylacetamid verkürzt die Reaktionszeit bei vergleichbaren Ausbeuten auf ca. 60 Minuten.[19] Der Prozess kann auch kontinuierlich ausgeführt werden.[20]
Bernsteinsäure, z. B. auch in wässriger Lösung als Ergebnis einer fermentativen Herstellung, kann an einem Kontakt von Siliciumorthophosphat Si3(PO4)4 bei 350–425 °C mit Ammoniak über das intermediär gebildete Diamid in 70 %iger Ausbeute zu Succinonitril umgesetzt werden.[21]
Aus Glutamin und bevorzugt aus Glutaminsäure biogenen Ursprungs ist Succinonitril in einer mehrstufigen Synthese über den Glutaminsäure-5-methylester, 3-Cyanpropionsäure und 3-Cyanpropionsäureamid zugänglich.[7]
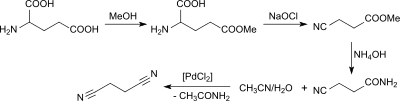
Das 3-Cyanpropionsäureamid wird mit wässrigem Acetonitril in Gegenwart von Palladium(II)-chlorid in das Succinonitril überführt.[22]
Eigenschaften
Succinonitril ist ein geruchloser,[4] wachsartiger, weißer, wasserlöslicher Feststoff, der bei Raumtemperatur als plastischer Kristall vorliegt und bei 238 K einen Fest-Fest-Phasenübergang zeigt.[23]
In der frühen Literatur[8] wird Succinonitril als nicht destillierbar und unterhalb 37 °C als „hellbraune krystallinische Masse“, oberhalb dieser Temperatur als ölige Flüssigkeit mit scharfem, unangenehmen Geschmack beschrieben. Aus verdünnten Lösungen, z. B. in Aceton, zeigt Succinonitril schönes dendritisches Kristallwachstum.[24]
Anwendungen
Als Additiv in festen Polymer-Elektrolyten erhöht Succinonitril die Ionenleitfähigkeit und verbessert die mechanischen Eigenschaften von Festelektrolyt-Lithium-Ionen-Akkumulatoren.[25][26][27]
Succinonitril eignet sich auch als Ausgangsverbindung für 2-Pyrrolidon, wobei in erster Stufe Succinonitril mit Raney-Nickel partiell zum 3-Aminopropionitril hydriert und anschließend mit Wasser unter Druck bei 210 °C zu γ-Butyrolactam hydrolysiert wird.[28][29][30][31]
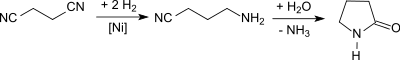
Die vollständige Hydrierung von Succinonitril liefert 1,4-Diaminobutan, das als α,ω-Diamin-Monomer für Polyamide, z. B. Polyamid 4,6 infrage kommt.[32]
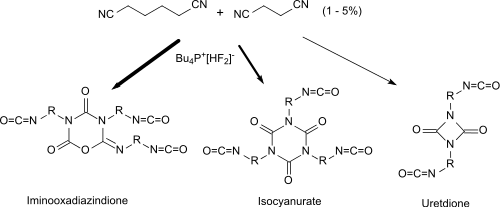
Succinonitril eignet als Additiv bei Umsetzung mit monomeren Di- und/oder Triisocyanaten (1 – 5 % bezogen auf das Diisocyanat Hexamethylendiisocyanat HDI) in Gegenwart von Fluoriden als Katalysatoren zur Herstellung von Polyisocyanaten mit hohen Anteilen an Iminooxadiazindion-Gruppen (asymmetrische Isocyanat-Trimere). Die erhaltenen Polyisocyanaten weisen reaktive freie Isocyanatgruppen auf und können als Isocyanatkomponenten für Polyurethan-Kunststoffe dienen.[33]
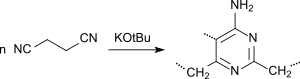
Succinonitril kann als bifunktionelles Monomer durch anionische Polymerisation mit dem Katalysator Natriummethanolat in Methanol zum Poly(1-pyrrolin-2-yl-5-ylidennitrilo), einem in NaOH und DMSO löslichen Halbleiter
.svg.png.webp)
und mit dem Katalysator Kalium-tert-butanolat in Substanz dagegen zu Poly[(4-amino-2,5,6-pyrimidintriyl)-2,6-dimethylen], einem in DMSO löslichen Nichtleiter, polymerisiert werden.[34]
Einzelnachweise
- Datenblatt Succinonitrile bei Sigma-Aldrich, abgerufen am 15. Januar 2016 (PDF).
- Datenblatt Succinonitrile bei Acros, abgerufen am 15. Januar 2016.
- Lide, DR (ed.), CRC Handbook of Chemistry and Physics, 81st Edition, CRC Press LLC, Boca Raton, FL 2000, p. 3-92.
- Eintrag zu Succinonitril in der GESTIS-Stoffdatenbank des IFA, abgerufen am 9. Januar 2019. (JavaScript erforderlich)
- Eintrag zu Succinonitrile bei TCI Europe, abgerufen am 15. Januar 2016.
- S. Vaswani, PEP Review 2010-14, Bio-based Succinic Acid, SRI Consulting, 2014. (PDF; 2,5MB)
- T.M. Lammens, J. Le Notre, M.C.R. Franssen, E.L. Scott, J.P.M. Sanders: Synthesis of biobased succinonitrile from glutamic acid and glutamine. In: Chemsuschem. Band 4, Nr. 6, 2011, S. 785–791, doi:10.1002/cssc.201100030.
- M. Simpson: Ueber Cyanäthylen und Bernsteinsäure. In: Justus Liebigs Ann. Chem. Band 118, Nr. 3, 1861, S. 373–376, doi:10.1002/jlac.18611180317.
- M. Simpson: Ueber die Synthese der Bernsteinsäure und der Pyroweinsäure. In: Justus Liebigs Ann. Chem. Band 121, Nr. 2, 1862, S. 153–165, doi:10.1002/jlac.18621210203.
- Klaus Schwetlick: Organikum – Organisch-chemisches Grundpraktikum. 24. Auflage. Wiley-VCH, Weinheim 2015, ISBN 978-3-527-33968-6.
- W.J. Evans, I. Bloom, W.E. Hunter, J.L. Atwood: Synthesis and x-ray crystal structure of a soluble divalent organosamarium complex. In: J. Am. Chem. Soc. Band 103, Nr. 21, 1981, S. 6507–6508, doi:10.1021/ja00411a046.
- Y. Kawasaki, A. Fujii, Y. Nakano, S. Sakaguchi, Y. Ishii: Acetylcyanation of aldehydes with acetone cyanhydrin and isoprenylacetate by Cp*2Sm(thf)2. In: J. Org. Chem. Band 64, Nr. 1, 1999, S. 4214–4216, doi:10.1021/jo990030o.
- Patent US2427601: Production of organic nitriles. Angemeldet am 30. März 1945, veröffentlicht am 16. September 1947, Anmelder: E.I. Du Pont de Nemours and Company, Erfinder: C.R. Harris.
- Patent US20080004462A1: Catalyst for the preparation of fumaronitrile and/or maleonitrile. Angemeldet am 21. November 2006, veröffentlicht am 3. Januar 2008, Erfinder: A.V. Peters, P.A.C. Schevelier.
- Patent DE707852: Verfahren zur Herstellung von Nitrilen. Angemeldet am 21. April 1938, veröffentlicht am 29. Mai 1941, Anmelder: I.G. Farbenindustrie AG, Erfinder: P. Kurtz.
- Patent US2434606: Method of preparing succinonitrile. Angemeldet am 18. August 1945, veröffentlicht am 13. Januar 1948, Anmelder: American Cyanamid Co., Erfinder: E.L. Carpenter.
- Patent EP0016482A1: Process for the preparation of succinonitrile. Angemeldet am 20. Februar 1980, veröffentlicht am 1. Oktober 1980, Anmelder: Stamicarbon B.V., Erfinder: G.H. Suverkropp, J.G.M. Nieuwkamp.
- Patent US7371884B2: Process for preparing succinonitrile and use of succinonitrile. Angemeldet am 3. Dezember 2002, veröffentlicht am 13. Mai 2008, Anmelder: DSM IP Assets B.V., Erfinder: H. Oevering, F.H.A.M. Vandenbooren, O. Poorter.
- Patent US2698337: Hydrocyanation. Angemeldet am 23. August 1951, veröffentlicht am 28. Dezember 1954, Anmelder: Monsanto Chemical Co., Erfinder: R.L. Heider, H.M. Walker.
- Patent US2842584: Production of succinonitrile. Angemeldet am 11. Dezember 1956, veröffentlicht am 8. Juli 1958, Anmelder: Carbogen Corp., Erfinder: L.J. Christmann.
- Patent US20110288324A1: Method for manufacturing compounds including nitrile functions. Angemeldet am 26. November 2009, veröffentlicht am 24. November 2011, Erfinder: R. Jacquot, P. Marion.
- S.I. Maffioli, E. Marzorati, A. Marazzi: Mild and reversible dehydration of primary amides with PdCl2 in aqueous acetonitrile. In: Org. Lett. Band 7, Nr. 23, 2005, S. 5237–5239, doi:10.1021/ol052100l.
- D.V. Nickel, S.P. Delaney, H. Bian, J. Zheng, T.M. Korter, D.M. Middleman: Terahertz Vibrational Modes of the Rigid Crystal Phase of Succinonitrile. In: J. Phys. Chem. Band 118, Nr. 13, 2014, S. 2442–2446, doi:10.1021/jp411865n (PDF; 1,5MB).
- ScienceSimulations: Solidification of succinonitrile. In: youtube.com. 30. März 2011, abgerufen am 2. Februar 2016.
- A. Abouimrane, I.J. Davidson: Solid Electrolyte Based on Succinonitrile and LiBOB - Interface Stability and Application in Lithium Batteries. In: J. Electrochem. Soc. Band 154, Nr. 11, 2007, S. A1021–A1034, doi:10.1149/1.2781305 (PDF; 445kB).
- L.-Z. Fan, Y.-S. Hu, A.J. Bhattacharyya, J. Maier: Succinonitrile as a Versatile Additive for Polymer Electrolytes. In: Adv. Funct. Mater. Band 17, Nr. 15, 2007, S. 2800–2807, doi:10.1002/adfm.200601070.
- P.-J. Alarco, Y. Abu-Lebdeh, A. Abouimrane, M. Armand: The plastic-crystalline phase of succinonitrile as a universal matrix for solid-state ionic conductors. In: Nature Mater. Band 3, Nr. 7, 2004, S. 476–481, doi:10.1038/nmat1158.
- Patent US3644402: Process for producing α-pyrrolidone. Angemeldet am 6. Mai 1969, veröffentlicht am 22. Februar 1972, Anmelder: Sumitomo Chemical Co., Ltd., Erfinder: K. Takagi, T. Matsuda, M. Murakami.
- Patent US4123438: Process for preparing 2-pyrrolidones. Angemeldet am 1. September 1977, veröffentlicht am 31. Oktober 1978, Anmelder: Stamicarbon B.V., Erfinder: L.H. Geurts, P.J.N. Meijer.
- Patent EP0022292: Process for the preparation of a 2-pyrrolidone. Angemeldet am 28. Juni 1980, veröffentlicht am 11. Mai 1983, Anmelder: Stamicarbon B.V., Erfinder: H.C.J. de Man, A. Corvers, P.J.H. Thomissen.
- Hans-Jürgen Arpe: Industrielle Organische Chemie. 6. Auflage. Wiley-VCH, Weinheim 2007, ISBN 978-3-527-31540-6, S. 113.
- Patent US5254738: Preparation of 1,4-alkylenediamines. Angemeldet am 19. Februar 1991, veröffentlicht am 16. Oktober 1993, Anmelder: BASF AG, Erfinder: U. Koehler, H. Siegel, M. Irgang.
- Patent WO2015011068A1: Einsatz von Succinonitril bei der Herstellung von Iminooxadiazindiongruppen enthaltenden Polyisocyanaten. Angemeldet am 21. Juli 2014, veröffentlicht am 29. Januar 2015, Anmelder: Bayer Material Science AG, Erfinder: F. Richter, R. Halpaap.
- D. Wöhrle: Polymere aus Nitrilen. I. Anionische Polymerisation von Bernsteinsäuredinitril. In: Makromol. Chem. Band 160, Nr. 1, 1972, S. 83–97, doi:10.1002/macp.1972.021600106.

