5-HT2B-Rezeptor
Der 5-HT2B-Rezeptor (kurz 5-HT2B) ist ein Protein aus der Familie der Serotonin-Rezeptoren (5-HT-Rezeptoren), das durch Serotonin, einem körpereigenen Gewebshormon und Neurotransmitter, aktiviert werden kann. Im menschlichen Körper kommt der 5-HT2B-Rezeptor insbesondere in der Zellmembran von Zellen der glatten Muskulatur und des Gefäßendothels sowie in geringer Menge in Nervenzellen vor. Dieser Rezeptor hat im Zusammenspiel mit seinem Agonisten Serotonin eine wichtige Rolle bei der Entwicklung und Funktion des Herz-Kreislauf-Systems. Auf molekularer Ebene vermittelt dieser G-Protein-gekoppelte Rezeptor seine Effekte über eine Aktivierung von heterotrimären G-Proteinen.
| 5-HT2B-Rezeptor | ||
|---|---|---|
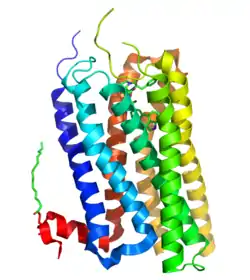
| ||
| Strukturmodel des 5-HT2B-Rezeptors in Komplex mit Ergotamin nach PDB 4IB4 | ||
| Eigenschaften des menschlichen Proteins | ||
| Masse/Länge Primärstruktur | 481 AS; 54,3 kDa | |
| Sekundär- bis Quartärstruktur | 7TM (Monomer) | |
| Bezeichner | ||
| Gen-Namen | HTR2B ; 5-HT(2B), 5-HT2B | |
| Externe IDs | ||
| Vorkommen | ||
| Homologie-Familie | Rhodopsin-ähnliche Rezeptoren | |
| Übergeordnetes Taxon | Eukaryoten | |
Biochemie
Genetik
Der 5-HT2B-Rezeptor des Menschen wurde erstmals im Jahr 1994 kloniert.[1][2] Er wird durch ein HTR2B-Gen auf Chromosom 2, Genlocus 2q36.3-q37.1 codiert. Die codierende DNA-Region beinhaltet zwei Introns.[2] Ein Einzelnukleotid-Polymorphismus, der zu einem funktionsuntüchtigen 5-HT2B-Rezeptor führt, wird mit einer gesteigerten Impulsivität in Verbindung gebracht.[3] Ebenso wurde eine Mutation, welche zu einem permanent an der Zellmembran exprimierten, voll funktionstüchtigen Rezeptor führt, als eine mögliche Ursache für die Entwicklung einer pulmonalen Hypertonie nach Einnahme von Appetitzüglern gefunden.[4][5]
Proteinstruktur
Das 5-HT2B-Rezeptorprotein des Menschen besteht aus 481 Aminosäuren. Mit Hilfe der Röntgenkristallstrukturanalyse konnte eine vorausgesagte Struktur mit sieben helikalen Transmembrandomänen (heptahelikaler Rezeptor) bestätigt werden.[6]
Helix VI ist vorwiegend einbezogen in die Signalübertragung durch G-Proteine, während Konformationsänderungen in Helix VII verbunden sind mit der Übertragung durch β-Arrestine. Im 5-HT2B-Rezeptor-Ergotamin-Komplex befindet sich die Helix VII im aktivierten Konformationszustand, wohingegen Helix VI nur teilaktiviert ist. Hierin spiegelt sich das starke β-Arrestin-Bias des Ergotamins an diesem Rezeptor, wie es in pharmakologischen Assays beobachtbar ist (siehe auch den Abschnitt 5-HT2B-Agonisten).[7]
Signaltransduktion
Auf molekularer Ebene führt eine Stimulation von 5-HT2B-Rezeptoren zu einer Aktivierung von Gq/11-Proteinen und einer Aktivierung der Phospholipase C verbunden mit einer Freisetzung von Ca2+ aus intrazellulären Speichern. Infolgedessen werden verschiedene intrazelluläre Signaltransduktionswege aktiviert, die zu einer Kontraktion glattmuskulärer Zellen führen. Des Weiteren bewirkt eine Stimulation von 5-HT2B-Rezeptoren eine Aktivierung von G12/13-Proteinen, der NO-Synthasen eNOS und iNOS, der Phospholipase A₂, der NAD(P)H-Oxidase und des Natrium-Protonen-Austauschers 1 sowie eine Zellzyklusaktivierung und eine Aktivierung des ERK-Signalwegs.[8]
Funktion
Herz-Kreislauf-System
Über eine Stimulierung von 5-HT2B-Rezeptoren führt Serotonin zu einer Kontraktion der glatten Muskulatur des Herz-Kreislaufsystems. In einigen Blutgefäßen kann darüber hinaus Serotonin über die Aktivierung dieses Rezeptors und einer Freisetzung von Stickstoffmonoxid aus dem Endothel zu einer Relaxation führen.[9]
Tierexperimentelle Studien mit Knockout-Mäusen haben darüber hinaus gezeigt, dass der Serotoninrezeptor für die Entwicklung des Herz-Kreislaufsystems, insbesondere für die des Herzes, von Bedeutung ist.[10] Dem gegenüber führt eine Stimulierung des 5-HT2B-Rezeptors zu einer Fibrosierung des Herzes. Pathologisch spielt dieser Rezeptor auch bei der Entstehung der primären pulmonalen Hypertonie eine Rolle.[11]
Magen-Darm-Trakt
5-HT2B-Rezeptoren kommen in hoher Dichte auch in den Neuronen und der glatten Muskulatur des Magen-Darm-Trakt vor.[12][13] Hier spielen sie insbesondere für die Entwicklung des Darmnervensystems und die gastrointestinale Motilität eine wichtige Rolle.[12][14]
Zentralnervensystem
Obwohl 5-HT2B-Rezeptoren nur in sehr geringer Menge im Zentralnervensystem nachgewiesen werden konnten, wird eine Beteiligung dieses Rezeptors an der antidepressiven Wirkung von selektiven Serotonin-Wiederaufnahmehemmern[15] und an der psychischen Wirkung von Designerdrogen[16] angenommen.
Der 5-HT2B-Rezeptor gehört zu jenen Serotoninrezeptortypen, über den Schmerzreize übermittelt werden.[17][18] Siehe dazu auch den Abschnitt Serotonin#Schmerz.
Pharmakologie
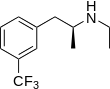
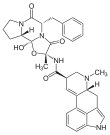
Der 5-HT2B-Rezeptor besitzt nicht nur eine sehr enge genetische und strukturelle Verwandtschaft zum 5-HT2C-Rezeptor. Auch pharmakologisch sind beide Rezeptoren sehr ähnlich. Der 5-HT2B-Rezeptor stellt derzeit kein Ziel für die Arzneistoffentwicklung dar, wenngleich möglicherweise ein therapeutisches Potenzial für Antagonisten bei der Behandlung chronischer Lebererkrankungen besteht.[19] Auf Grund der Verbindung zwischen einer Aktivierung dieses Rezeptors und dem Auftreten von Herzklappenschäden wird der 5-HT2B-Rezeptor für Agonisten hingegen als ein Antitarget eingestuft. Bereits in den frühen Phasen der Arzneistoffentwicklung werden üblicherweise Tests auf einen möglichen Agonismus am 5-HT2B-Rezeptor durchgeführt. Das Zuführen von 5-HT2B-Rezeptorantagonisten bei einem bestehenden Serotoninsyndrom ist kontraindiziert, sie können Symptome des Syndroms weiter verstärken.[20]
Agonisten
Selektive 5-HT2B-Rezeptoragonisten, wie beispielsweise BW-723C86, besitzen nur experimentelle Bedeutung.
Prodrugs der nichtselektiven 5-HT2B/2C-Rezeptoragonisten Norfenfluramin und Dexnorfenfluramin, wie beispielsweise Fenfluramin, Dexfenfluramin und Benfluorex, wurden seit den 1970er Jahren als Appetitzügler genutzt. Auf Grund der gehäuften Beobachtung von Fällen von Herzklappenschäden und pulmonaler Hypertonie wurden diese nichtselektiven 5-HT2B/2C-Rezeptoragonisten in den 1990er und 2000er Jahren vom Markt genommen. Nach der Erkenntnis, dass eine Stimulierung des 5-HT2C-Rezeptors für den appetitzügelnden Effekt und der Agonismus am 5-HT2B-Rezeptor für die Nebenwirkungen verantwortlich sind, wurden gezielt selektive 5-HT2C-Rezeptoragonisten als neue Appetitzügler entwickelt. So zeigt das 2012 in den USA zugelassene Lorcaserin eine über 100-fache Selektivität für 5-HT2C- gegenüber 5-HT2B-Rezeptoren.[21]
Zahlreiche weitere, insbesondere ältere Arzneistoffe mit nichtselektivem Wirkprofil können den 5-HT2B-Rezeptor als Agonisten stimulieren. Dazu zählen neben Dihydroergotamin, Ergometrin, Methysergid, Methylergometrin, Pergolid und Cabergolin, für welche ein gehäuftes Auftreten von Herzklappenschäden bekannt ist, auch Guanfacin, Chinidin, Xylometazolin, Oxymetazolin, Fenoldopam.[22]
Einige Ergolin-Derivate, insbesondere Ergotamin und Dihydroergotamin, zeigen eine hohe funktionelle Selektivität, indem sie die Signalübertragung über β-Arrestin bevorzugen, ihre Bias-Faktoren betragen 230 bzw. 185; im selben Sinn haben Cabergolin und LSD einen Faktor von je 100.[7] Ropinirol, ein schwach-affiner 5-HT2B-Rezeptoragonist, bevorzugt hingegen, mit geringerem Bias, den Calciumionen-Flux.[22]
Antagonisten
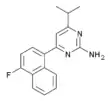
5-HT2B-Rezeptorantagonisten gibt es in zahlreichen strukturtypischen Varianten. Selektive Antagonisten, wie beispielsweise RS-127,445 und das Tryptolin LY-272,015, finden insbesondere in der Forschung und Entwicklung experimentelle Anwendung. RS-127,455 ist hochaffin und bindet 1000-fach stärker an den Rezeptor 5-HT2B als an die Isoformen 5-HT2A und 5-HT2C.[23] Es wurden mittlerweile Antagonisten entwickelt, die diesbezüglich Selektivitätsfaktoren von weit über 10.000 erreichen.[24][25]
Zahlreiche therapeutisch genutzte Arzneistoffe sind nichtselektive 5-HT2B-Rezeptorantagonisten. Die migräneprophylaktische Wirksamkeit von Lisurid und Pizotifen wird auf ihre potente 5-HT2B-Rezeptor-antagonistische Wirkung zurückgeführt.[26] Auch der Thrombozytenaggregationshemmer Sarpogrelat[27] und das Prokinetikum Tegaserod[28] besitzen zusätzlich markante 5-HT2B-Rezeptor-antagonistische Eigenschaften. Dies trifft ebenso zu auf die Neuroleptika Asenapin[29], Aripiprazol[30] und Clozapin[31]. Ferner lassen sich das Antidepressivum Mianserin und das Rauwolfia-Alkaloid Yohimbin dieser Rubrik zurechnen.
Weblinks
Einzelnachweise
- Kursar JD, Nelson DL, Wainscott DB, Baez M: Molecular cloning, functional expression, and mRNA tissue distribution of the human 5-hydroxytryptamine2B receptor. In: Mol Pharmacol. 46, Nr. 2, August 1994, S. 227–34. PMID 8078486.
- Schmuck K, Ullmer C, Engels P, Lübbert H: Cloning and functional characterization of the human 5-HT2B serotonin receptor. In: FEBS Lett. 342, Nr. 1, März 1994, S. 85–90. PMID 8143856.
- Bevilacqua L, Doly S, Kaprio J, et al.: A population-specific HTR2B stop codon predisposes to severe impulsivity. In: Nature. 468, Nr. 7327, Dezember 2010, S. 1061–6. doi:10.1038/nature09629. PMID 21179162. PMC 3183507 (freier Volltext).
- Blanpain C, Le Poul E, Parma J, et al.: Serotonin 5-HT(2B) receptor loss of function mutation in a patient with fenfluramine-associated primary pulmonary hypertension. In: Cardiovasc. Res.. 60, Nr. 3, Dezember 2003, S. 518–28. PMID 14659797.
- Deraet M, Manivet P, Janoshazi A, et al.: The natural mutation encoding a C terminus-truncated 5-hydroxytryptamine 2B receptor is a gain of proliferative functions. In: Mol Pharmacol. 67, Nr. 4, April 2005, S. 983–91. doi:10.1124/mol.104.008268. PMID 15625277.
- Wang C, Jiang Y, Ma J, et al.: Structural Basis for Molecular Recognition at Serotonin Receptors. In: Science. März 2013. doi:10.1126/science.1232807. PMID 23519210.
- Wacker D, Wang C, Katritch V, et al.: Structural Features for Functional Selectivity at Serotonin Receptors. In: Science. 2013. doi:10.1126/science.1232808. PMID 23519215.
- John R. Raymond, Justin H. Turner, Andrew K. Gelasco et al.: 5-HT Recepto Signal Transduction Pathways. In: Bryan L. Roth (Hrsg.): The Serotonin Receptors: From Molecular Pharmacology to Human Therapeutics. Springer, 2006, ISBN 1597450804, S. 143–206.
- Morcillo EJ, Cortijo J: Species differences in the responses of pulmonary vascular preparations to 5-hydroxytryptamine. In: Therapie. 54, Nr. 1, 1999, S. 93–7. PMID 10216431.
- Nebigil CG, Hickel P, Messaddeq N, et al.: Ablation of serotonin 5-HT(2B) receptors in mice leads to abnormal cardiac structure and function. In: Circulation. 103, Nr. 24, Juni 2001, S. 2973–9. PMID 11413089.
- Launay JM, Hervé P, Peoc'h K, et al.: Function of the serotonin 5-hydroxytryptamine 2B receptor in pulmonary hypertension. In: Nat Med. 8, Nr. 10, Oktober 2002, S. 1129–35. doi:10.1038/nm764. PMID 12244304.
- Fiorica-Howells E, Maroteaux L, Gershon MD: Serotonin and the 5-HT(2B) receptor in the development of enteric neurons. In: J. Neurosci.. 20, Nr. 1, Januar 2000, S. 294–305. PMID 10627607.
- Borman RA, Tilford NS, Harmer DW, et al.: 5-HT(2B) receptors play a key role in mediating the excitatory effects of 5-HT in human colon in vitro. In: Br J Pharmacol. 135, Nr. 5, März 2002, S. 1144–51. doi:10.1038/sj.bjp.0704571. PMID 11877320. PMC 1573235 (freier Volltext).
- Sanger GJ: 5-hydroxytryptamine and the gastrointestinal tract: where next?. In: Trends Pharmacol Sci. 29, Nr. 9, September 2008, S. 465–71. doi:10.1016/j.tips.2008.06.008. PMID 19086255.
- Diaz SL, Doly S, Narboux-Nême N, et al.: 5-HT(2B) receptors are required for serotonin-selective antidepressant actions. In: Mol. Psychiatry. 17, Nr. 2, Februar 2012, S. 154–63. doi:10.1038/mp.2011.159. PMID 22158014. PMC 3381222 (freier Volltext).
- Doly S, Valjent E, Setola V, et al.: Serotonin 5-HT2B receptors are required for 3,4-methylenedioxymethamphetamine-induced hyperlocomotion and 5-HT release in vivo and in vitro. In: J. Neurosci.. 28, Nr. 11, März 2008, S. 2933–40. doi:10.1523/JNEUROSCI.5723-07.2008. PMID 18337424.
- Cervantes-Durán C, Vidal-Cantú GC, Barragán-Iglesias P, et al.: Role of peripheral and spinal 5-HT2B receptors in formalin-induced nociception. In: Pharmacol. Biochem. Behav.. 102, Nr. 1, 2012, S. 30–5. doi:10.1016/j.pbb.2012.03.015. PMID 22476011.
- Cervantes-Durán C, Pineda-Farias JB, Bravo-Hernández M, et al.: Evidence for the participation of peripheral 5-HT(2A), 5-HT(2B), and 5-HT(2C) receptors in formalin-induced secondary mechanical allodynia and hyperalgesia. In: Neuroscience. 2012. doi:10.1016/j.neuroscience.2012.11.047. PMID 23219842.
- Ebrahimkhani MR, Oakley F, Murphy LB, et al.: Stimulating healthy tissue regeneration by targeting the 5-HT2B receptor in chronic liver disease. In: Nat. Med.. 17, Nr. 12, Dezember 2011, S. 1668–73. doi:10.1038/nm.2490. PMID 22120177. PMC 3428919 (freier Volltext).
- Diaz SL, Maroteaux L: Implication of 5-HT(2B) receptors in the serotonin syndrome. In: Neuropharmacology. 61, Nr. 3, 2011, S. 495–502. doi:10.1016/j.neuropharm.2011.01.025. PMID 21277875.
- Thomsen WJ, Grottick AJ, Menzaghi F, et al.: Lorcaserin, a novel selective human 5-hydroxytryptamine2C agonist: in vitro and in vivo pharmacological characterization. In: J Pharmacol Exp Ther. 325, Nr. 2, Mai 2008, S. 577–587. doi:10.1124/jpet.107.133348. PMID 18252809.
- Huang XP, Setola V, Yadav PN, et al.: Parallel functional activity profiling reveals valvulopathogens are potent 5-hydroxytryptamine(2B) receptor agonists: implications for drug safety assessment. In: Mol. Pharmacol.. 76, Nr. 4, Oktober 2009, S. 710–22. doi:10.1124/mol.109.058057. PMID 19570945. PMC 2769050 (freier Volltext).
- Bonhaus DW, Flippin LA, Greenhouse RJ, Jaime S, Rocha C, Dawson M, Van Natta K, Chang LK, Pulido-Rios T, Webber A, Leung E, Eglen RM, Martin GR. RS-127445: a selective, high affinity, orally bioavailable 5-HT2B receptor antagonist. British Journal of Pharmacology. 1999 Jul;127(5):1075-82. doi:10.1038/sj.bjp.0702632 PMID 10455251
- Moss N, Choi Y, Cogan D, et al.: A new class of 5-HT2B antagonists possesses favorable potency, selectivity, and rat pharmacokinetic properties. In: Bioorg. Med. Chem. Lett.. 19, Nr. 8, 2009, S. 2206–10. doi:10.1016/j.bmcl.2009.02.126. PMID 19307114.
- Kwon YJ, Saubern S, Macdonald JM, Huang XP, Setola V, Roth BL: N-tetrahydrothiochromenoisoxazole-1-carboxamides as selective antagonists of cloned human 5-HT2B. In: Bioorg. Med. Chem. Lett.. 20, Nr. 18, 2010, S. 5488–90. doi:10.1016/j.bmcl.2010.07.074. PMID 20692833.
- Schmuck K, Ullmer C, Kalkman HO, Probst A, Lubbert H: Activation of meningeal 5-HT2B receptors: an early step in the generation of migraine headache?. In: Eur. J. Neurosci.. 8, Nr. 5, Mai 1996, S. 959–67. PMID 8743744.
- Muntasir HA, Hossain M, Bhuiyan MA, et al.: Identification of a key amino acid of the human 5-HT(2B) serotonin receptor important for sarpogrelate binding. In: J Pharmacol Sci. 104, Nr. 3, Juli 2007, S. 274–7. PMID 17609583.
- Beattie DT, Smith JA, Marquess D, et al.: The 5-HT4 receptor agonist, tegaserod, is a potent 5-HT2B receptor antagonist in vitro and in vivo. In: Br. J. Pharmacol.. 143, Nr. 5, November 2004, S. 549–60. doi:10.1038/sj.bjp.0705929. PMID 15466450. PMC 1575425 (freier Volltext).
- Shahid M, Walker GB, Zorn SH, Wong EH: Asenapine: a novel psychopharmacologic agent with a unique human receptor signature. In: J. Psychopharmacol. (Oxford). 23, Nr. 1, 2009, S. 65–73. doi:10.1177/0269881107082944. PMID 18308814.
- Davies MA, Sheffler DJ, Roth BL: Aripiprazole: a novel atypical antipsychotic drug with a uniquely robust pharmacology. In: CNS Drug Rev. 10, Nr. 4, 2004, S. 317–36. PMID 15592581.
- Knight AR, Misra A, Quirk K, et al.: Pharmacological characterisation of the agonist radioligand binding site of 5-HT(2A), 5-HT(2B) and 5-HT(2C) receptors. In: Naunyn Schmiedebergs Arch Pharmacol. 370, Nr. 2, 2004, S. 114–23. doi:10.1007/s00210-004-0951-4. PMID 15322733.