3,4-Methylendioxyamphetamin
3,4-Methylendioxyamphetamin, kurz MDA, ist eine synthetische halluzinogene Droge, die in vielen Ländern verboten ist. MDA gehört chemisch-strukturell zur Gruppe der Amphetamine, genauer der Methylendioxyamphetamine.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
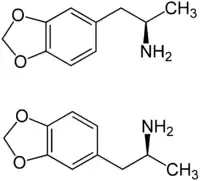 | ||||||||||||||||||||||
| 1:1-Gemisch von Enantiomeren: (R)-Form (oben) und (S)-Form (unten) | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | 3,4-Methylendioxyamphetamin | |||||||||||||||||||||
| Andere Namen | ||||||||||||||||||||||
| Summenformel | C10H13NO2 | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 179,22 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest | |||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt | ||||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Geschichte
MDA wurde erstmals 1910 von den Chemikern Carl Mannich (1877–1947) und Willy Jacobsohn (1884–1963) bei Merck in Darmstadt synthetisiert.[5][6]
Ab 1962 unternahm der US-Chemiker Alexander Shulgin Selbstversuche mit der Substanz.
Ab den späten 1960er Jahren wurde MDA daraufhin in der Hippieszene als sogenannte hug drug (Knuddeldroge) weitverbreitet. Anspielend darauf wurde es als Mellow Drug of America (Amerikas weiche Droge) bezeichnet.[7][8]
Nachdem die Wirkung des verwandten Wirkstoffs MDMA spätestens ab den 1970ern bekannt wurde, wurde MDA, u. a. aufgrund der schwächeren empathogenen Wirkung, zumindest als Partydroge weniger als MDMA benutzt, durchlief aber ansonsten bis heute eine parallele Entwicklung. So wurde auch MDA bis zu seinem Verbot in den 1980ern in der Psychotherapie eingesetzt, da die Droge ebenfalls die Tendenz fördert, sich dem Therapeuten leichter zu öffnen und tiefere Einblicke in die eigene Psyche zu gewinnen. Und auch heute noch ist MDA oft anstatt oder in Ergänzung von MDMA in Ecstasy-Pillen enthalten.
Synthese
Die Herstellung geschieht üblicherweise über den Grundstoff Piperonal. In PIHKAL[9] wird die Herstellung über das Nitropropen (Piperonal + Nitroethan) und die Reduktion mit LAH beschrieben. Es ist zudem ein möglicher Ausgangsstoff bei der Synthese von MDMA. Eine weitere mögliche Syntheseroute geht über den Naturstoff Safrol mit anschließender Halogenierung und darauffolgender Substitution mit Ammoniak. Eine alternative Syntheseweg geht von Isosafrol über 3,4-Methylendioxyphenylaceton zu MDA.
Chemische und pharmakologische Eigenschaften
Es existieren zwei pharmakologisch aktive Enantiomere, die (R)-Form und die dazu spiegelbildliche (S)-Form des Wirkstoffes. Die freie Base MDA ist ein Öl und enthält die funktionelle Gruppe eines primären Amins R–NH2 Die freie Base bildet mit Salzsäure ein kristallines Hydrochlorid R–NH2·HCl.
MDA hat eine leicht halluzinogene, entaktogene und (im Gegensatz zu MDMA) schwächere empathogene Wirkung.[10] MDA bewirkt die Ausschüttung von Katecholamin-Neurotransmittern und steigert die Emotionsintensität. Oftmals neigen unter MDA-Einfluss stehende Personen zum Philosophieren, weisen ein gesteigertes Redebedürfnis auf und erleben ein gesteigertes Ich-Erleben. MDA täuscht dem Konsumenten eine sowohl körperliche als auch geistige Ausdauerfähigkeit vor.
Die wirksame Dosierung liegt im Bereich von 80 bis 160 mg, die Wirkdauer liegt zwischen vier und zwölf Stunden. MDA ist ein Abbauprodukt von MDMA.
Gefahren
Die Gefahren des Langzeitkonsums von MDA sind ebenso wie die von MDMA nicht endgültig geklärt. Es besteht der Verdacht von dauerhaften Schädigungen des Zentralen Nervensystems. Es existieren noch keine Human-Langzeitstudien, mögliche langandauernde Schädigungen werden vor allem bei den Neuronen im Cortex cerebri, Hippocampus, Striatum, Hypothalamus und im Mittelhirn vermutet. MDA gilt jedoch als neurotoxischer als MDMA, MDE und MBDB.[10]
Rechtsstatus
MDA wurde durch den Suchtstoffkontrollrat der UNO im Schedule I der Konvention über Psychotrope Substanzen eingeführt und ist damit praktisch weltweit illegal.
In der Bundesrepublik Deutschland wurde MDA mit der ersten Betäubungsmittelrechts-Änderungsverordnung (1. BtMÄndV)[11] vom 6. August 1984 (BGBl. 1984 I S. 1081) als nicht verkehrsfähiges Betäubungsmittel in Anlage 1 zu § 1 Abs. 1 BtMG[12] aufgenommen.
Seit 1998 werden im BtMG und in der BtMVV alle Amfetamine mit f statt ph geschrieben. MDA wird im BtMG auch als Tenamfetamin bezeichnet. Die Schreibweise wurde damit an die WHO-Nomenklatur angepasst.[13]
Literatur
- Claudio Naranjo: Die Reise zum Ich. Psychotherapie mit heilenden Drogen. Behandlungsprotokolle. Übersetzt aus dem amerikanischen Englisch von Modeste zur Nedden-Pferdekamp. Fischer, Frankfurt am Main 1979, ISBN 3-596-23381-X.
Einzelnachweise
- T. Passie, U. Benzenhöfer: MDA, MDMA, and other "mescaline-like" substances in the US military's search for a truth drug (1940s to 1960s). In: Drug testing and analysis. Band 10, Nummer 1, Januar 2018, S. 72–80, doi:10.1002/dta.2292, PMID 28851034 (Review).
- Externe Identifikatoren von bzw. Datenbank-Links zu Tenamfetamin Hydrochlorid: CAS-Nummer: 6292-91-7, EG-Nummer: 634-360-0, ECHA-InfoCard: 100.162.347, PubChem: 110823, ChemSpider: 24385, Wikidata: Q27269984.
- 3,4-Methylenedioxyamphetamine. In: The Merck Index: An Encyclopedia of Chemicals, Drugs, and Biologicals. 14. Auflage. Merck & Co., Whitehouse Station NJ 2006, ISBN 978-0-911910-00-1, S. 995–996.
- Datenblatt (±)-3,4-Methylenedioxyamphetamine hydrochloride bei Sigma-Aldrich, abgerufen am 20. März 2011 (PDF).
- beta-3,4-Methylenedioxyphenylisopropylamine (MDA) - [www.rhodium.ws]. In: www.erowid.org.
- C. Mannich, W. Jacobsohn, C. Mannich: Über Oxyphenyl-alkylamine und Dioxyphenyl-alkylamine. In: Berichte der deutschen chemischen Gesellschaft. 43, 1910, S. 189, doi:10.1002/cber.19100430126.
- Shulgin, Alexander und Ann Shulgin (1995): PIHKAL – A Chemical Love Story. Transform Press, Abschnitt über MDA, abgerufen am 8. Oktober 2015.
- Julie Holland (2001): Ecstasy – The Complete Guide: A Comprehensive Look at the Risks and Benefits of MDMA, Seite 11, Park Street Press, ISBN 9780892818570.
- Erowid Online Books : "PIHKAL" - #100 MDA. In: www.erowid.org.
- MDA (3,4 Methylendioxyamphetamin). In: drogen-info-berlin.de. Abgerufen am 20. Mai 2016.
- 1. BtMÄndV vom 6. August 1984.
- Anlage I zu § 1 BtMG.
- 10. BtMÄndV Art. 1 Nr. 1 Buchst. b.
