Etherspaltung
Als Etherspaltung werden chemische Reaktionen bezeichnet, in denen Ether substitutiv gespalten werden. Da Ether chemisch sehr stabil sind, ist ihre Spaltung nur unter stark sauren oder extrem basischen Bedingungen möglich.
In der organischen Chemie ist Etherspaltung eine säurekatalysierte nukleophile Substitution, die zu deren Spaltung führt. In Abhängigkeit vom betrachteten Ether kann dabei der SN1- bzw. SN2-Mechanismus durchlaufen werden. Zur Unterscheidung beider Mechanismen ist die Berücksichtigung induktiver und mesomerer Effekte, die ein potentielles Carbokation stabilisieren bzw. destabilisieren, unerlässlich. Der Einsatz von Halogenwasserstoffsäuren bietet sich an, da diese sowohl die saure Aktivierung des Ether-Sauerstoffatoms bewirken, als auch das Halogenid-Ion als Nukleophil zur Verfügung stellen. Ether weisen eine ähnliche Acidität wie Alkohole (pKs um 16) auf.
In der metallorganischen Chemie bezeichnet Etherspaltung die Zersetzung von etherischen Lösungsmitteln durch extrem basische metallorganische Reagenzien. Besonders empfindlich gegenüber Etherspaltung sind dabei cyclische Ether, aber auch acyclische Ether können gespalten werden.
Etherspaltung nach SN1-Mechanismus

Der unimolekulare SN1-Mechanismus verläuft über ein Carbokation, sofern dieses angemessen stabilisiert werden kann. Im Beispiel wird der Sauerstoff im tert-Butylmethylether reversibel protoniert, wobei das entstandene Oxoniumion Methanol freisetzt. Das vergleichsweise stabile tert-Butyl-Kation wird durch ein Halogenid, hier das Bromid-Ion, nukleophil angegriffen, sodass 2-Brom-2-methylpropan erhalten wird.
Mechanismus
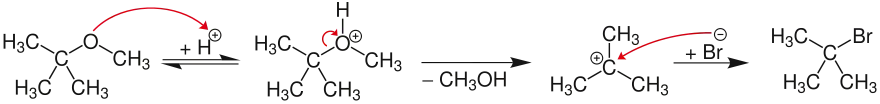
Etherspaltung nach SN2-Mechanismus

Ist die Stabilisierung eines Carbokations nicht möglich, wird der bimolekulare, konzertierte SN2-Mechanismus durchlaufen. Hier wird der Ether-Sauerstoff im Methyl-n-propylether reversibel protoniert, woraufhin das Bromid- (bzw. Halogenid-)Ion das sterisch weniger gehinderte Kohlenstoffatom unter Bildung von Methylbromid nukleophil angreift und gleichzeitig 1-Propanol freigesetzt wird.
Mechanismus
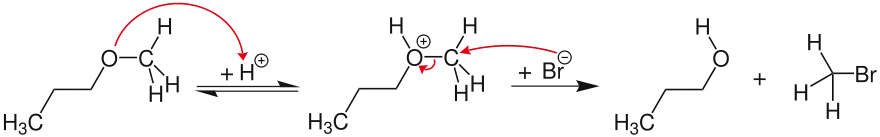
Weitere Faktoren
Wie beschrieben verlaufen Reaktionen, die im SN1-Mechanismus instabile Carbokationen (Methyl-, Vinyl-, Aryl- oder primäre Carbokationen) bedingen würden, über den SN2-Mechanismus. Eine Etherspaltung nach SN1 verläuft prinzipiell schneller als nach SN2. Auch die eingesetzte Halogenwasserstoffsäure spielt eine wichtige Rolle. Die Reaktionsgeschwindigkeit mit Iodwasserstoffsäure ist größer als mit Bromwasserstoffsäure. Möchte man Chlorwasserstoffsäure einsetzen, müssen drastischere Reaktionsbedingungen eingesetzt werden. Dies liegt in der größeren Acidität der schwereren Homologen der Halogenwasserstoffsäuren sowie der größeren Nukleophilie der jeweiligen konjugierten Basen begründet. Die Nukleophilie des Fluoridions ist zu gering, als dass Fluorwasserstoffsäure zur Etherspaltung im protischen Medium eingesetzt werden könnte. Die Reaktionsgeschwindigkeit ist trotzdem in jedem Fall vergleichsweise gering, sodass das Reaktionsgemisch erhitzt werden muss.
Etherspaltung durch metallorganische Reagenzien
Mechanismus
Basische Etherspaltung wird induziert durch die Deprotonierung in α-Position.[1] Anschließend reagieren die Ether unter Spaltung in ein Alken und ein Alkoholat. Bei cyclischen Ethern wie dem häufig verwendeten THF kann die Reaktion konzertiert ablaufen und ist damit besonders schnell:

Bei acyclischen Ethern kommt es nach der Deprotonierung zunächst zu β-Hydrid-Eliminierung und Bildung eines alkenischen Ethers. Das gebildete Hydrid greift dann am Alkenrest in α-Position zum Ether-Sauerstoff wieder an und verdrängt damit das Alkoholat.
Bedeutung
Metallorganische Reagenzien werden oft in etherischen Lösungsmitteln gehandhabt, da diese an die metallischen Zentren koordinieren können und auf diese Weise die organischen Reste zur Reaktion befähigen. Hier tritt das Problem der Etherspaltung auf, die nicht nur das Lösungsmittel zersetzt, sondern auch das metallorganische Reagenz verbraucht. Reaktionen mit metallorganischen Reagenzien werden deshalb typischerweise bei tiefen Temperaturen (−78 °C) durchgeführt, bei denen die Deprotonierung der Ether kinetisch gehemmt ist.
Literatur
- P. Y. Bruice: Organische Chemie. 5., aktualisierte Auflage. Pearson Education, München 2007, ISBN 978-3-8273-7190-4, S. 519–520.
Einzelnachweise
- Christoph Elschenbroich: Organometallchemie, 5., überarbeitete Auflage 2005, Wiley-VCH Weinheim. ISBN 3-519-53501-7.