Nitrogruppe
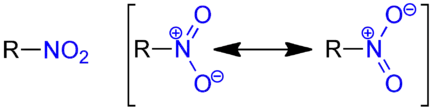
Als Nitrogruppe wird in der organischen Chemie die funktionelle NO2-Gruppe bezeichnet, die über das Stickstoffatom an den organischen Rest R gebunden ist.
Isomer zur Nitrogruppe ist die funktionelle Ester-Gruppe der Salpetrigen Säure. Bei diesen Estern erfolgt die Bindung zum organischen Rest R über ein Sauerstoffatom (R–O–N=O). Häufig werden auch Salpetersäureester, R–O–NO2 als Nitroverbindungen bezeichnet, obwohl diese Verbindungen zur Stoffklasse der Nitrate gehören. Beispiele sind die nicht korrekt bezeichneten Explosivstoffe Nitroglycerin (korrekte Bezeichnung Glyceroltrinitrat) und Nitrocellulose (korrekte Bezeichnung Cellulosenitrat).[1]
Eigenschaften
Bei der mesomeriestabilisierten Nitrogruppe trägt ein Sauerstoffatom eine negative und das Stickstoffatom eine positive Ladung. Da nach der Oktettregel zwei Doppelbindungen zum N-Atom verboten sind, muss man die Strukturformel mit einem neutralen und einem geladenen Sauerstoffatom darstellen.
Die Nitrogruppe als Substituent verringert daher die Elektronendichte aromatischer Verbindungen und zeigt einen −M-Effekt. Das aromatische System wird somit bei der elektrophilen aromatischen Substitution deaktiviert und bei einer potentiellen nukleophilen aromatischen Substitution aktiviert.
Nitrogruppen haben durch das Stickstoffatom im hohen Oxidationszustand eine oxidierende Wirkung. Das kommt bei vielen Sprengstoffverbindungen zum Tragen. TNT (Trinitrotoluol) ist deshalb so brisant, weil die Verbindung auf sieben Kohlenstoffatome drei Nitrogruppen enthält. Das Molekül hat also in sich selbst die Eigenschaften eines Oxidationsmittels – die Nitrogruppen (hoher Oxidationszustand) – und eines Reduktionsmittels -die Kohlenstoffatome (niedriger Oxidationszustand).
Auf dem −M-Effekt der Nitrogruppe beruht die antiauxochrome Wirkung in farbigen Verbindungen, z. B. bei der Pikrinsäure. Die bei der Behandlung von Proteinen mit konzentrierter Salpetersäure auftretende Gelbfärbung (Xanthoproteinreaktion) kommt durch die Nitrierung aromatischer Aminosäuren zustande, deren Absorption dabei in den sichtbaren Bereich des Lichts verschoben wird.
Siehe auch
Literatur
- Hans Beyer, Wolfgang Walter: Lehrbuch der organischen Chemie, 19. Auflage, S. Hirzel Verlag, Stuttgart, ISBN 3-7776-0356-2.
- Siegfried Hauptmann: Organische Chemie, 2. Auflage, VEB Deutscher Verlag für Grundstoffindustrie, Leipzig 1985, ISBN 3-342-00280-8, S. 513–522.
- Peter Sykes: Reaktionsmechanismen – eine Einführung, 8. Auflage, VCH, Weinheim 1982, ISBN 3-527-21090-3.
Einzelnachweise
- Eberhard Breitmaier, Günther Jung: Organische Chemie. Grundlagen, Stoffklassen, Reaktionen, Konzepte, Molekülstruktur. 5. Auflage. Georg Thieme Verlag, Stuttgart 2005, ISBN 3-13-541505-8, S. 223, 406 (eingeschränkte Vorschau in der Google-Buchsuche).