Leblanc-Verfahren
Das Leblanc-Verfahren ist ein historisches Verfahren zur Gewinnung von Soda. Es wurde 1791 von Nicolas Leblanc entwickelt.
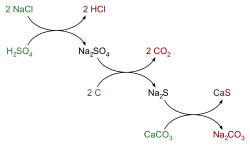
Als erstes wird technisches Natriumchlorid mit heißer Schwefelsäure behandelt, dabei entweicht Chlorwasserstoffgas und es bleibt Natriumsulfat als „Salzkuchen“ zurück:

Diese Reaktion war bereits um 1655 von Johann Rudolph Glauber entdeckt worden, Leblancs eigener Beitrag dagegen der sich anschließende nächste Schritt, in dem der „Salzkuchen“ mit Kalk und Kohle gemischt gebrannt wird. Dabei wird die Kohle zu Kohlendioxid oxidiert, und das Sulfat zu Sulfid reduziert. Die verbleibende „schwarze Asche“ enthält Soda und Calciumsulfid.
Im Gegensatz zum Calciumsulfid, das wie der eingesetzte Kalk wasserunlöslich ist, kann die wasserlösliche Soda durch Auswaschen leicht von den anderen Komponenten getrennt und auch das Wasser selbst schließlich wieder durch Sieden entfernt werden.
Das Leblanc-Verfahren war zunächst durch das entweichende Chlorwasserstoffgas sehr umweltschädigend, und auch das auf Halden gekippte Calciumsulfid setzte bei seiner Verwitterung giftigen Schwefelwasserstoff frei.
Nachdem das Solvay-Verfahren zur Soda-Herstellung gegenüber dem Leblanc-Verfahren die Oberhand gewonnen hatte, wurden das eingangs freigesetzte Chlorwasserstoffgas und die aus ihm gewonnene Salzsäure zu den eigentlichen Hauptprodukten des Leblanc-Verfahrens. Man stellte daraus in großem Umfang Chlor und Chlorkalk her, bevor man auch diese Produkte auf andere Weise, z. B. durch Chloralkalielektrolyse, zu gewinnen begann.
Mit den heutigen technischen Möglichkeiten indes sehen Ingenieure im Leblanc-Verfahren eine neuerliche Perspektive, um in Ländern mit erheblichen Na2SO4-Vorkommen eine preisgünstige und gegenüber dem Solvay-Verfahren umweltfreundlichere Sodaproduktion zu etablieren. Der Prozess der Aufkohlung ist derselbe, jedoch wird das CO2 unter Druck in Lösung gehalten und fällt dann als NaHCO3 aus (wie im Solvay-Prozess). Das Calciumsulfid schließlich wird abgetrennt und zu Calciumsulfat (Gips) oxidiert, das in den betroffenen (meist Entwicklungs-) Ländern ein begehrter Rohstoff ist.
Literatur
- Christian Thieme: Sodium Carbonates. In: Ullmann’s Encyclopedia of Industrial Chemistry. 6. Auflage. Wiley-VCH, Weinheim 2002, ISBN 978-3-527-30385-4.
Einzelnachweise
- Hermann Ost: Lehrbuch der Technischen Chemie, Verlag von Robert Oppenheim, Berlin 1890.