2-Pyron
2-Pyron ist neben dem 4-Pyron eines der einfachen 6-gliedrigen Heterocyclen mit einem Sauerstoffatom und zwei Doppelbindungen im Ring. Zum Unterschied zu den Pyranen sind zusätzlich die beiden Wasserstoffatome der -CH2-Gruppe durch ein weiteres Sauerstoffatom ersetzt. Dieser Typ der Heterocyclen wird Pyrone genannt. Einfache natürliche Derivate des 2-Pyron mit nur einem Ring sind bisher unbekannt. Natürliche Derivate mit zwei Ringen sind Cumarin (1,2-Benzopyron) und die Hydroxyverbindungen des Cumarin wie Umbelliferon (7-Hydroxycumarin), Aesculetin (6,7-Dihydroxycumarin) und Daphnetin (7,8-Dihydroxycumarin).[5]
| Strukturformel | |||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
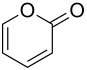 | |||||||||||||||||||
| Allgemeines | |||||||||||||||||||
| Name | 2-Pyron | ||||||||||||||||||
| Andere Namen |
| ||||||||||||||||||
| Summenformel | C5H4O2 | ||||||||||||||||||
| Externe Identifikatoren/Datenbanken | |||||||||||||||||||
| |||||||||||||||||||
| Eigenschaften | |||||||||||||||||||
| Molare Masse | 96,08 g·mol−1 | ||||||||||||||||||
| Aggregatzustand |
flüssig | ||||||||||||||||||
| Dichte | |||||||||||||||||||
| Schmelzpunkt | |||||||||||||||||||
| Siedepunkt | |||||||||||||||||||
| Brechungsindex |
1,5270 (25 °C)[3] | ||||||||||||||||||
| Sicherheitshinweise | |||||||||||||||||||
| |||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. Brechungsindex: Na-D-Linie, 20 °C | |||||||||||||||||||
Gewinnung und Darstellung
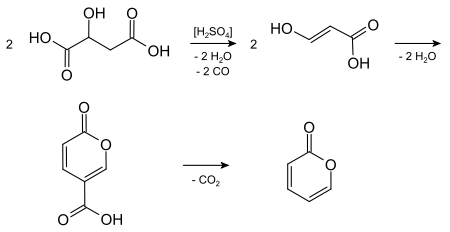
2-Pyron kann aus Äpfelsäure bei der Einwirkung von konzentrierter Schwefelsäure über Kondensation, Abspaltung von Kohlenstoffmonoxid und Kohlenstoffdioxid mit Cumalinsäure als Zwischenstufe dargestellt werden. Vermutlich wird dabei zuerst unter Abspaltung von Kohlenstoffmonoxid Formylessigsäure gebildet. Diese wird in der Enolform unter Kondensation und Abspaltung von Kohlenstoffdioxid über Cumalinsäure zu 2-Pyron umgewandelt. Die Gleichungen für diese Synthese sind wie folgt:[2]
Mit einer modernen Synthese kann 2-Pyron direkt durch eine Reaktion von Kohlenstoffdioxid mit Ethin dargestellt werden. Unter Verwendung eines Katalysators auf Basis von Übergangsmetallen wie beispielsweise Titan, Cobalt oder Palladium wird in einem Lösungsmittel durch eine [2+2+2]-Cycloaddition 2-Pyron gebildet. Die Reaktion verläuft über einen Metall-Cycloheptadien-Komplex. Das Metall wird aus diesem Komplex durch Reduktion entfernt. Die Reaktion verläuft nach folgender Gleichung:[6]
Eigenschaften
2-Pyron hat die Eigenschaften eines δ-Lactons und reagiert bei einer Hydrierung zu einem Gemisch von δ-Valerolacton und Valeriansäure.[2] Die beiden Doppelbindungen im Ring bilden ein Dien-System und sind für Diels-Alder-Reaktionen geeignet.[2] Stabile Resonanzstrukturen zur Bildung eines Pyroxonium-Kations sind im Gegensatz zum 4-Pyron nicht möglich. 2-Pyron bildet deshalb keine Oxoniumsalze und kann nicht aromatisch substituieren.[7]
Mit der Gogte-Synthese können Hydroxyderivate des 2-Pyron alkyliert werden. Bei der Reaktion von 4-Methyl-6-hydroxy-2-pyron mit Acetylchlorid wird unter Abspaltung von Chlorwasserstoff und Kohlenstoffdioxid die Hydroxy- durch die Methylgruppe ausgetauscht und 4,6-Dimethyl-2-pyron gebildet.[8]
Einzelnachweise
- K. von Auwers, Liebigs Annalen der Chemie 422 (1921) 133–159.
- L. F. Fieser, M. Fieser; In: Lehrbuch der organischen Chemie, 3. Auflage, Verlag Chemie, 1957, S. 943.
- David R. Lide (Hrsg.): CRC Handbook of Chemistry and Physics. 90. Auflage. (Internet-Version: 2010), CRC Press/Taylor and Francis, Boca Raton, FL, Physical Constants of Organic Compounds, S. 3-448.
- Datenblatt 2-Pyron bei Sigma-Aldrich, abgerufen am 4. November 2016 (PDF).
- L. F. Fieser, M. Fieser; In: Lehrbuch der organischen Chemie, 3. Auflage, Verlag Chemie, 1957, S. 945.
- Shibata,Tsuchikama: In: Org. Biomol. Chem. 2008, 6, 1317–1323.
- L. F. Fieser, M. Fieser; In: Lehrbuch der organischen Chemie, 3. Auflage, Verlag Chemie, 1957, S. 944.
- C. R. Gogte, Proc. Indian Acad. Sci. 7A, (1938) 214.