Trinitrotoluol
Trinitrotoluol (TNT), nach IUPAC-Nomenklatur 2-Methyl-1,3,5-trinitrobenzen, ist ein Sprengstoff. Die Strukturformel der Verbindung zeigt einen Benzolring mit einer Methylgruppe (–CH3) und drei ortho, bzw. para ständige Nitrogruppen (–NO2) als Substituenten. Die Verbindung entsteht durch Nitrierung von Toluol mittels Nitriersäure, einer Mischung von Salpeter- und Schwefelsäure.
| Strukturformel | ||||||||||||||||||||||
|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|---|
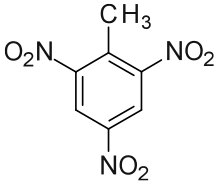 | ||||||||||||||||||||||
| Allgemeines | ||||||||||||||||||||||
| Name | Trinitrotoluol | |||||||||||||||||||||
| Andere Namen |
| |||||||||||||||||||||
| Summenformel | C7H5N3O6 | |||||||||||||||||||||
| Kurzbeschreibung |
farblose bis gelbliche rhomboedrische Kristalle oder Nadeln[1] | |||||||||||||||||||||
| Externe Identifikatoren/Datenbanken | ||||||||||||||||||||||
| ||||||||||||||||||||||
| Eigenschaften | ||||||||||||||||||||||
| Molare Masse | 227,13 g·mol−1 | |||||||||||||||||||||
| Aggregatzustand |
fest[1] | |||||||||||||||||||||
| Dichte | ||||||||||||||||||||||
| Schmelzpunkt | ||||||||||||||||||||||
| Siedepunkt |
Zersetzung ab 160 °C[1] | |||||||||||||||||||||
| Löslichkeit |
sehr schlecht in Wasser (140 mg·l−1, 20 °C)[1] | |||||||||||||||||||||
| Sicherheitshinweise | ||||||||||||||||||||||
| ||||||||||||||||||||||
| MAK |
Schweiz: 0,01 ml·m−3 bzw. 0,1 mg·m−3[4] | |||||||||||||||||||||
| Toxikologische Daten | ||||||||||||||||||||||
| Soweit möglich und gebräuchlich, werden SI-Einheiten verwendet. Wenn nicht anders vermerkt, gelten die angegebenen Daten bei Standardbedingungen. | ||||||||||||||||||||||
Erstmals im Jahre 1863 von Julius Wilbrand (1839–1906) synthetisiert,[5] wurde 1901 zunächst im Deutschen Reich mit der Großproduktion von TNT begonnen. Das TNT-Äquivalent dient als Maßstab für die bei einer Explosion freiwerdende Energie.
Geschichte
Nach der ersten Darstellung 1863, der Weiterentwicklung der Synthese durch P. Hepp 1880 und der Entdeckung von TNT als geeignetem Explosivstoff durch Karl Häussermann im Jahr 1889 gelang der Dynamit AG, vormals Alfred Nobel & Co. (DAG) zuerst 1901 im Werk Schlebusch die großtechnische Produktion. Besonders durch den Bedarf des Militärs an TNT als Füllung von Granaten (ab 1902 zuerst im Deutschen Reich) entstanden rasch zahlreiche Fabriken. Der Ausgangsstoff Toluol konnte damals aber nur in begrenzter Menge hergestellt werden, da man auf die Gewinnung aus Steinkohlenteer angewiesen war, einem Gemisch aus Tausenden von Einzelsubstanzen, das bei der Koksgewinnung anfällt. Aus heutiger Sicht ist diese Methode allerdings nicht mehr wirtschaftlich, da der Anteil des Toluols im Steinkohlenteer relativ gering ist.
Im Zweiten Weltkrieg wurde TNT wiederum verstärkt produziert. Sogenannte „Schlaffabriken“, darunter das Werk Tanne bei Clausthal-Zellerfeld, wurden schon vor Kriegsanfang errichtet, zumeist mit zweifacher Ausführung der Anlagen, damit bei Zerstörungen und Beschädigungen weiter Sprengstoff hergestellt werden konnte. Die produzierten Mengen hatten drastisch zugenommen. So belief sich die Menge des im Deutschen Reich produzierten TNT auf 18.000 Tonnen pro Monat, während des Krieges wurden insgesamt ca. 800.000 Tonnen hergestellt. Diese Steigerung war möglich, weil das notwendige Edukt nun auch aus Erdöl gewonnen werden konnte. In einem zweistufigen Prozess, dem „Deutschen Verfahren“, wurde das Toluol zunächst einfach nitriert. Das entstandene Mononitrotoluol (MNT) reinigte man von unerwünschten Nebenprodukten und nitrierte erneut, wodurch über 2,4-Dinitrotoluol (DNT) das gewünschte Roh-TNT erzeugt wurde. Nach mehrfachem Waschen und Trocknen konnte es granuliert und dann verarbeitet werden. Sicherheitsmaßnahmen wurden dabei vernachlässigt, um für Nachschub an der Front zu sorgen. Da TNT lange Zeit für ungiftig gehalten wurde, neutralisierte man lediglich die Abfälle und ließ sie in Naturgewässer fließen, wo sie sich teilweise in Form von Schlamm ablagerten und als Rüstungsaltlasten die Umwelt schädigen. Hinsichtlich der unbekannten Toxizität ist bekannt, dass zwischen 1911 und 1915 279 Munitionsarbeiter gestorben sind, weil sie kleine Mengen über Haut und Atemwege aufgenommen hatten. Die beiden größten TNT-Produktionsstätten in Deutschland während des Zweiten Weltkriegs waren die Sprengstofffabriken Allendorf und Hessisch Lichtenau.
Gewinnung und Darstellung
Für die Herstellung von TNT kann Toluol mit Nitriersäure, einer Mischung aus Schwefel- und Salpetersäure, nitriert werden. Erstere protoniert aufgrund ihres geringeren pKs-Wertes (größere Säurestärke) die Salpetersäure. Es werden dadurch wesentlich mehr reaktive elektrophile NO2+-Ionen (auch Nitryl-Kation oder Nitroniumion) gebildet. Die NO2+-Ionen sind die reaktiven Moleküle im Reaktionsgemisch, durch die die elektrophile Substitution am Aromaten ermöglicht wird.
Die Bildung des Trinitrotoluols erfolgt in Stufen. Zunächst erfolgt die Mononitrierung des Toluols, die auf Grund des induktiven Effekts der Methylgruppe mit 96%iger Wahrscheinlichkeit in ortho- oder para-Position stattfindet. Das nun gebildete Nitrotoluol kann vom starken Elektrophil NO2+ weiter nitriert werden, bis mit drei die maximale Anzahl an Nitrogruppen im Molekül vorhanden ist und damit Trinitrotoluol entstanden ist.
Eigenschaften
Physikalische Eigenschaften

Trinitrotoluol kann in zwei verschiedenen Modifikationen auftreten (Polymorphie), die sich schon anhand ihrer Farbe unterscheiden lassen.[6][7] Die stabile, monokline Form bildet hellgelbe, nadelförmige Kristalle, die bei 80,4 °C schmelzen.[6][7] Eine metastabile, orthorhombische Form bildet orange Kristalle. Beim Erhitzen auf 70 °C erfolgt eine Umwandlung zur monoklinen Form.[6][7] In Wasser ist die Verbindung sehr schwer löslich, mäßig löslich in Methanol (1 %[6]) und Ethanol (3 %[6]), gut löslich hingegen in Ether, Ethylacetat (47 %[6]), Aceton, Benzol, Toluol (55 %[6]) und Pyridin. Mit seinem niedrigen Schmelzpunkt von 80,4 °C lässt sich TNT in Wasserdampf schmelzen und kann in Formen gegossen werden. Die Verbindung kann im Vakuum destilliert werden. Die Dampfdruckfunktion ergibt sich nach Antoine entsprechend log10(P) = A−(B/(T+C)) (P in bar, T in K) mit A = 5,37280, B = 3209,208 und C = −24,437 im Temperaturbereich von 503 K bis 523 K.[8] Die Verbindung verträgt eine Dauererhitzung bis 140 °C. Oberhalb von 160 °C setzt eine Gasentwicklung ein. Ab 240 °C tritt eine Verpuffung unter starker Rußentwicklung auf.[1] TNT ist giftig und kann bei Hautkontakt allergische Reaktionen hervorrufen. Es färbt die Haut leuchtend gelborange.
Explosionskenngrößen
TNT ist einer der bekanntesten, chemisch homogenen, also nur aus einer Komponente bestehenden, Explosivstoffe. Wie alle homogenen Explosivstoffe verdankt TNT seine Explosivität einer internen chemischen Instabilität und der Bildung wesentlich stabilerer, gasförmiger Produkte bei der Explosion. Der für die Explosion nötige Brennstoff (das Reduktionsmittel in Form der C-Atome) und der Oxidator (das Oxidationsmittel in Form der Nitrogruppen) sind dabei im TNT-Molekül selbst enthalten. Aus chemischer Sicht spricht man bei der Explosion von einer intramolekular sehr schnell und exotherm ablaufenden Redoxreaktion, die durch eine Initialzündung gestartet wird. Die entstehenden stabileren und energieärmeren Produkte sind z. B. Stickstoff, Kohlenstoffdioxid, Methan, Kohlenmonoxid und Cyanwasserstoff. Letztere Produkte können wegen des zu geringen Sauerstoffanteils im Molekül entstehen.
Wurde am Beginn eine ausreichende Menge der Substanz gezündet, erhält die abgegebene Energie die Reaktion aufrecht und die gesamte Stoffmenge reagiert. Die Umsetzung erfolgt dabei in einer sehr schnellen, schmalen Reaktionszone, welche die Substanz wie eine Welle durchläuft. Die Geschwindigkeit dieser Reaktionszone erreicht bei leistungsfähigen Explosivstoffen mehrere tausend Meter pro Sekunde, überschreitet also die innerstoffliche Schallgeschwindigkeit. Durch die freigesetzte Energie und die Entstehung von Gasen als Reaktionsprodukte kommt es zu einem extrem steilen Druck- und Temperaturanstieg, was die Wirksamkeit brisanter Sprengstoffe begründet.
Wichtige sicherheitstechnische Kenngrößen zum Explosionsverhalten sind:[2]
- Explosionswärme: 3725 kJ·kg−1 (H2O (l)), 3612 kJ·kg−1 (H2O (g))
- Normalgasvolumen: 975 l·kg−1
- Detonationsgeschwindigkeit: 6900 m/s (Dichte: 1,6 g/cm3)
- Bleiblockausbauchung: 30 cm3/g
- Verpuffungspunkt: 300 °C
- Schlagempfindlichkeit: 15 Nm (1,5 kpm)
- Reibempfindlichkeit: bis 353 N (36 kp) keine Reaktion
- Grenzdurchmesser beim Stahlhülsentest: 5 mm
Verwendung
TNT ist noch heute ein wichtiger militärischer Sprengstoff. Verwendet wird er militärisch und gewerblich in Mischungen als Sicherheitssprengstoff, der nur durch Initialzündung (beispielsweise durch eine Sprengkapsel) zur Detonation gebracht werden kann. Gegossenes TNT benötigt zur sicheren Zündung sogar eine Verstärkerladung, den so genannten Booster. TNT allein wird durch Brand oder Hitze nicht explodieren; es brennt einfach ab. Aufgrund seiner hohen Herstellungskosten (etwa das 20fache gewerblicher Sprengstoffe) ist sein Haupteinsatz im militärischen Bereich (Sprengmittel besonders in Granaten, Bomben und Minen).
Der Energiegehalt beträgt in SI-Einheiten:
- 1 kg TNT ≙ 4,6 Megajoule (4,6 · 106 Joule). Zum Vergleich: Brennholz hat einen 3 bis 4 Mal höheren Energiewert.
Die im Zusammenhang mit Kernwaffenexplosionen verwendete Einheit TNT-Äquivalent basiert auf der veralteten Einheit Kalorie und ist definiert durch
- 1 kT (Kilotonne TNT) ≙ 1012 cal = 4,184 · 1012 J.
- Die Einheiten Megatonne und Gigatonne sind analog definiert. Durch die Großschreibung (Symbol T) soll die Verwechselung mit der Masseneinheit Tonne (Symbol kleingeschriebenes t) verhindert werden.
Chemisch verwandte Sprengstoffe
Literatur
- Richard Escales: Nitrosprengstoffe. Survival Press 1915, Reprint 2003, ISBN 3-8330-0114-3.
- Hans-Jürgen Quadbeck-Seeger u. a.: Chemie Rekorde. Menschen, Märkte, Moleküle. 2. Auflage. Wiley-VCH, Weinheim 1999, ISBN 3-527-29870-3.
- M. E. Walsh, T. F. Jenkins, P. S. Schnitker, J. W. Elwell, M. H. Stutz: Evaluation of SW846 Method 8330 for characterization of sites contaminated with residues of high explosives. CRREL Report 93-5, U.S. Army Cold Regions Research and Engineering Laboratory, Hanover, NH.
Weblinks
Einzelnachweise
- Eintrag zu 2,4,6-Trinitrotoluol in der GESTIS-Stoffdatenbank des IFA, abgerufen am 20. Januar 2022. (JavaScript erforderlich)
- J. Köhler, R. Meyer, A. Homburg: Explosivstoffe. Zehnte, vollständig überarbeitete Auflage. Wiley-VCH Verlag GmbH & Co. KGaA, Weinheim 2008, ISBN 978-3-527-32009-7.
- Eintrag zu 2,4,6-trinitrotoluene im Classification and Labelling Inventory der Europäischen Chemikalienagentur (ECHA), abgerufen am 1. August 2016. Hersteller bzw. Inverkehrbringer können die harmonisierte Einstufung und Kennzeichnung erweitern.
- Schweizerische Unfallversicherungsanstalt (Suva): Grenzwerte – Aktuelle MAK- und BAT-Werte (Suche nach 118-96-7 bzw. Trinitrotoluol), abgerufen am 2. November 2015.
- J. Wilbrand: Notiz über Trinitrotoluol. In: Annalen der Chemie und Pharmacie. Band 128, 1863, S. 178–179 (eingeschränkte Vorschau in der Google-Buchsuche).
- H. G. Gallagher, J. N. Sherwood: Polymorphism, twinning and morphology of crystals of 2,4,6-trinitrotoluene grown from solution. In: J. Chem. Soc., Faraday Trans. 92 (1996), S. 2107–2116 (doi:10.1039/FT9969202107).
- R.M. Vrcelj, J.N. Sherwood, A.R. Kennedy, H.G. Gallagher, T. Gelbrich: Polymorphism in 2-4-6 Trinitrotoluene. In: Crystal Growth & Design 3 (6) (2003), S. 1027–1032 (doi:10.1021/cg0340704).
- Yu Maksimov: Steam Pressures of Nitroaromatic Compounds at Different Temperatures. In: Zh. Fiz. Khim. 42 (1968), S. 2921–2925.



