Säureanhydride
Säureanhydride (meist nur Anhydride genannt) ist die Bezeichnung für eine Gruppe chemischer Verbindungen, die immer Derivate sauerstoffhaltiger Säuren sind. Sie entstehen formal durch Abspaltung von Wasser (Dehydratisierung) aus einer Säure.[1] Aus anorganischen Sauerstoffsäuren bilden sich Oxide, wie z. B. aus Phosphorsäure Phosphorpentoxid. Aus den organischen Carbonsäuren bilden sich so genannte Carbonsäureanhydride.
Typen
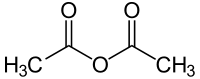
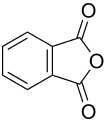
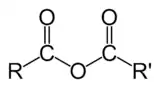
Bei organischen Säuren (Carbonsäuren) sind im Molekül zwei Säuregruppen über eine Sauerstoffbrücke verbunden. Die beiden Säuregruppen können entweder aus einem Molekül stammen (intramolekular) wie beim Phthalsäureanhydrid oder zu zwei verschiedenen Molekülen gehören (intermolekular) wie beim Essigsäureanhydrid. Sind die miteinander verknüpften Säurereste gleich, so spricht man von einfachen oder symmetrischen[2] Säureanhydriden, im anderen Falle von gemischten Säureanhydriden.[1] Man kann sie auch in acyclische Säureanhydride (lineare der Form R1-CO-O-CO-R2) und cyclische Säureanhydride (aus Orthodicarbonsäuren abgeleitete) unterscheiden.[3] Nur 1,4- oder 1,5-Dicarbonsäuren bilden cyclische Anhydride. Liegen die Carboxy-Gruppen weiter auseinander, so können polymere Anhydride entstehen.[4] Gemischte Anhydride entstehen durch Wasserabspaltung aus zwei verschiedenen Säuren, enthalten also zwei unterschiedliche Acylgruppen.[2]
Phosphorsäureanhydride haben eine besondere Bedeutung in biologischen Systemen. Sie enthalten zwei Phosphorylgruppen an einem Sauerstoffatom.[2]
Carbonsäurehalogenide oder andere formal durch die Reaktion von einer Säure mit einer Carbonsäure entstehenden Anhydride bilden aber oft eigene Stoffklassen und werden nicht als Anhydride bezeichnet.
|
| ||||||||||||||||||||||
Gemischte Anhydride
Gemischte Anhydride entstehen durch Kondensation zweier verschiedener Säuren.[1] Formal sind damit Carbonsäurehalogenide Anhydride einer Carbonsäure mit einer Halogenwasserstoffsäure z. B. Acetylchlorid:
Nomenklatur
Symmetrische Säureanhydride organischen Säuren werden benannt, indem man dem Namen der Säure die Endung -anhydrid hinzufügt.[2]
Gemischte Anhydride werden benannt, indem man die beiden zugrundeliegenden Carbonsäuren in alphabetischer Reihenfolge aufführt und dann die Endung -anhydrid hinzufügt.[2]
Bei anorganischen Säuren tragen die Substanzen meist eigene Namen. Phosphorpentoxid ist z. B. das Säureanhydrid der Phosphorsäure.
Darstellung
Säureanhydride können auf verschiedenen Wegen erzeugt werden:
- Durch Reaktion eines Carbonsäurechlorides mit dem (wasserfreien) Salz einer Carbonsäure[1] oder
- durch Abspaltung von Wasser mithilfe eines starken Entwässerungsmittels z. B. Schwefelsäure.
- Spezielle Anhydride lassen sich auch auf anderen Wegen herstellen. So wird z. B. Maleinsäureanhydrid durch Oxidation von Butan oder (veraltet) Benzol gewonnen und Phthalsäureanhydrid aus o-Xylol oder auch Naphthalin.
- Einen Sonderfall stellt Kohlenmonoxid dar; es lässt sich durch Entwässern von Ameisensäure erzeugen und durch Einleiten von Kohlenmonoxid in Natronlauge entsteht Formiat. Somit ist eine anorganische Substanz das Säureanhydrid einer organischen Säure.
Eigenschaften und Verwendung
Säureanhydride sind oft Flüssigkeiten von stechendem Geruch. Sie sind in Wasser nicht löslich, werden jedoch sehr rasch zu Säuren hydrolysiert. Besonders rasch dann, wenn die entstehenden Säuren in Wasser löslich sind. Diese und noch andere Eigenschaften haben die Säureanhydride mit den Säurechloriden gemein, da diese als gemischte Säureanhydride von Carbonsäuren und Chlorwasserstoff aufgefasst werden können. Säureanhydride setzen sich auch mit Alkoholen und Aminen um und sind daher sehr gebräuchliche Acylierungsmittel.[1]
Säureanhydride reagieren mit Wasser exotherm zu der bzw. den entsprechenden Säure(n). Verwenden kann man Säureanhydride zur halogenfreien Friedel-Crafts-Acylierung oder zur Trocknung der entsprechenden Säure.
Einzelnachweise
- K. Bodendorf: Kurzes Lehrbuch der Pharmazeutischen Chemie: Auch zum Gebrauch für Mediziner. Springer-Verlag, 2013, ISBN 978-3-642-49930-2, S. 284 (books.google.com).
- William H. Brown, Thomas Poon: Einführung in die Organische Chemie. John Wiley & Sons, 2020, ISBN 978-3-527-82385-7 (books.google.com).
- Hans Meyer: Analyse und Konstitutions Ermittlung Organischer Verbindungen. Springer-Verlag, 2013, ISBN 978-3-662-36697-4, S. 626 (books.google.com).
- Eberhard Breitmaier, Günther Jung: Organische Chemie: Grundlagen, Stoffklassen, Reaktionen, Konzepte, Molekülstrukturen ; 129 Tabellen. Georg Thieme Verlag, 2005, ISBN 978-3-13-541505-5, S. 277 (books.google.com).