pH-Meter
Ein pH-Meter, auch pH-Messkette genannt, ist ein Messgerät zur Bestimmung und Anzeige des pH-Wertes einer Lösung. Dabei wird der Wert auf elektrochemischem Wege ermittelt und nicht über Säure-Base-Indikatoren.


Geschichte
Zwischen 1920 und 1940 wurden die technischen Grundlagen für die pH-Messung geschaffen. So wurde z. B. 1940 von Jenaer Glas das pH-Meter auf Basis von Wasserstoffelektroden patentiert. Die ersten pH-Meter mit Glaselektroden wurden 1935 von Arnold Orville Beckman zur Messung der Zitronensäure-Konzentration bei Zitrusfrüchten entwickelt, patentiert[1] und im Rahmen des von ihm gegründeten Unternehmens, den National Technical Laboratories, produziert.[2] Andere Systeme wie die Chinon-Elektrode oder die Antimon-Elektrode sind auch in dieser Zeit vorgestellt worden.
Aufbau von pH-Metern

pH-Messung mit Glaselektroden
Das am häufigsten verwendete Messprinzip benutzt das Potential einer Glaselektrode, welche auch als pH-Elektrode bezeichnet wird. Eine Halbzellenreaktion an der Glasmembran bildet dort ein elektrisches Potenzial aus, welches in direkter Abhängigkeit zur H+-Ionen-Konzentration steht. Aus der Potenzialdifferenz zur Bezugselektrode entsteht eine Spannung, die weitgehend linear den pH-Wert abbildet. Als Bezugselektrode dient in den meisten Fällen eine Silber-Silberchlorid-Halbzelle, die mit der Glaselektrode zu einer sog. Einstab-Messkette zusammengebaut ist. Die Bezugselektrode ist über ein Diaphragma mit der zu messenden Lösung verbunden, das meist aus Glasschwamm, Keramik oder Platinschwamm ausgeführt ist. Bei Nichtgebrauch wird die Glaselektrode in einer Kaliumchloridlösung aufbewahrt, um das Diaphragma potentialneutral und leitfähig zu halten.
Bei der Messung kann kaum ein belastbarer Strom erzeugt werden. Deshalb muss das Messgerät aus einem Verstärker mit sehr hohem Eingangswiderstand und einem nachgeschalteten Spannungsanzeiger aufgebaut werden. Zur Kalibrierung muss sowohl der Nullpunkt als auch der Verstärkungsfaktor (Steigung) der Schaltung verstellbar sein. Wegen der geringen Belastbarkeit des Messpotenzials kommt es auch sehr leicht zu Störungen der Messung, beispielsweise durch sog. Strömungspotenziale. Verunreinigungen und Auslaugungen des Diaphragmas führen ebenfalls zu Messfehlern. Ferner stellt sich ein stabiler Gleichgewichtsmesswert umso langsamer ein, je geringer die Pufferkapazität des Messgutes ist.
pH-Messung mit Feldeffekttransistoren
Ein neueres Messprinzip basiert auf einem ionensensitiven Feldeffekttransistor (ISFET). Die Messwerte des ISFET sind etwas stabiler und die nachgeschaltete Elektronik robuster. Dafür soll die Standzeit (Haltbarkeit, Zahl der möglichen Messvorgänge) des Sensors geringer sein. Die Messwerte stimmen zwischen Glaselektrode und ISFET nicht besonders gut überein, da die Abweichungen von der Linearität und die begleitenden Messfehler unterschiedlich sind.
Dies illustriert die allgemeine Problematik von pH-Angaben. Zum einen ist der pH-Wert theoretisch definiert: als der negative Zehnerlogarithmus der Hydronium-Ionen-Konzentration. Andererseits zeigt die Messung so viele Probleme, dass häufig die operationale Definition benutzt wird: Der pH-Wert sei der von einem Glaselektroden-pH-Meter bei ruhendem Messgut von 20 °C angezeigte Messwert (plus weitere Spezifikationen des Eich- und Messvorgangs). Auf dem Bewusstsein für die Schwierigkeiten der pH-Ermittlung und der stillschweigenden Einigung auf diese operationale Definition beruht ein verbreiteter Widerstand von Messpraktikern gegen die ISFET-Messung.
pH-Messung mit Wasserstoffelektroden
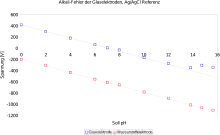
Die wohl älteste Technik zur pH-Messung beruht auf der pH-Abhängigkeit des Wasserstoffpotentials (siehe dazu Reversible Wasserstoffelektrode). Technisch waren solche pH-Meter bisher aufwendig – insbesondere die Wasserstoffversorgung erfordert einen hohen technischen Aufwand. Dies konnte in den letzten Jahren behoben werden, so dass nun die Vorteile
- kein Alkali-Fehler (siehe Abbildung)
- kein Säurefehler
- mechanisch stabil
- sehr niedrige Impedanz (Eingangswiderstand)
mit den Nachteilen
- Empfindlichkeit gegen oxidierende oder reduzierende Spezies
- Empfindlichkeit gegen Schwermetallsalze, die edler als Wasserstoff sind (Cu, Ag, Hg)[3]
abgewogen werden müssen. Die hier zitierten Nachteile sind jedoch theoretischer Natur und müssen im Einzelnen noch geprüft werden.
Justierung
Um genaue Messergebnisse zu erhalten, ist es üblich pH-Meter mindestens einmal arbeitstäglich vor der Benutzung zu justieren. Dazu benutzt man als Justierflüssigkeit Pufferlösungen mit bekanntem pH-Wert. Üblicherweise werden mindestens zwei, besser drei Pufferlösungen mit pH-Werten von 4,7 und 10 benutzt.[4] Diese Lösungen werden vom Laborfachhandel gebrauchsfertig angeboten und seltener selbst angesetzt. Der vom pH-Meter angezeigte Messwert wird ggf. entsprechend justiert, d. h., auf den pH-Wert der Pufferlösungen angepasst.
Anwendungsgebiete
pH-Meter finden heute ein breites Anwendungsgebiet, vor allen Dingen in der Industrie, Medizin, Aquaristik und in Schwimmbädern.[5] Aus dem Alltag sind pH-Meter daher nicht wegzudenken, um die Sicherheit bei der Anwendung von Kosmetikprodukten wie Shampoo, Reinigungsmittel oder regelmäßigen Schwimmbadbesuchen zu gewährleisten. Zu aggressive Laugen bzw. Säuren könnten dem Menschen Schaden zufügen und müssen daher ständig genau geprüft werden können.
Weblinks
Einzelnachweise
- Patent US2058761A: Apparatus for testing acidity. Angemeldet am 12. Oktober 1934, veröffentlicht am 27. Oktober 1936, Anmelder: National Technical Laboratories, Erfinder: Arnold O. Beckmann, Henry E. Fracker.
- The Beckman pH Meter. American Chemical Society, 2004, abgefragt am 16. August 2010 (Memento vom 28. September 2011 im Internet Archive).
- Kurt Schwabe, Elektrometrische pH Messung unter extremen Bedingungen, Verlag Chemie, 1960, Seite 15
- Kathy Barker: Das Cold Spring Harbor Laborhandbuch für Einsteiger. Spektrum Akademischer Verlag, Heidelberg, 2006, ISBN 978-3-8274-1656-8, S. 139–144.
- pH-Meter: Funktionsweise und Anwendung. In: Wer liefert Was? 2013. (Memento vom 4. Februar 2013 im Internet Archive)