Sulfonierung
Die Sulfonierung ist eine Reaktion, bei der eine Sulfonsäuregruppe (–SO2-OH-Gruppe, auch –SO3H-Gruppe), oder auch Sulfogruppe, in eine organische Verbindung eingeführt wird.[1] Die Reaktionsprodukte werden als Sulfonsäuren bezeichnet, Zwischenprodukte können Sultone oder Anhydride sein.
Sulfonierungen können an Alkanen, Alkenen oder Aromaten erfolgen.
Im Gegensatz zu Schwefelsäureestern ist bei den Sulfonsäuren das Schwefelatom direkt an ein Kohlenstoffatom gebunden.
Im Allgemeinen verwendet man zur Sulfonierung:
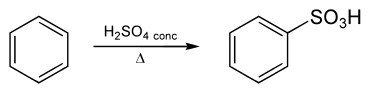
- Oleum bei der Sulfonierung von Aromaten,[2] wie Benzol und Toluol in der Flüssigphase
- Schwefeltrioxid bei der Sulfonierung von Alkylbenzolen und Olefinen in der Gas-/Flüssigphase
Indirekt lässt sich eine Sulfogruppe einführen mit
- Chlorsulfonsäure bei der Chlorsulfonierung von Aromaten
- Schwefeldioxid/Chlorgas-Gemische bei der radikalisch verlaufenden Sulfonierung von Alkanen, der sogenannten Sulfochlorierung[3]
Die im technischen Prozess hergestellten Produkte finden nach Hydrolyse und Neutralisation mit Ammoniak oder Natronlauge vor allem als Tenside in Wasch- und Reinigungsmitteln Verwendung.
Sulfonierung von Aromaten
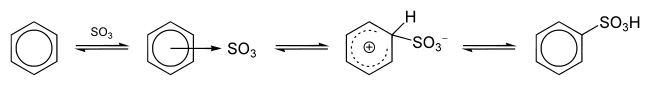
Bei der Sulfonierung von Aromaten ist das Elektrophil Schwefeltrioxid (SO3) in Schwefelsäure, Pyridin oder Dioxan oder das durch Protonierung in Schwefelsäure gebildete Kation HSO3+:[4]
Die Reaktion lässt sich beschleunigen, wenn man Schwefeltrioxid in konzentrierter Schwefelsäure löst (Oleum). Für die Reaktion ist das Schwefeltrioxid von maßgeblicher Bedeutung, die Schwefelsäure dient als Trägermedium für das Schwefeltrioxid. Schwefeltrioxid erweist sich als starkes Elektrophil, da das Schwefelatom durch den starken Elektronenzug der Sauerstoffatome (Elektronegativitätsdifferenz: 1,2) sehr stark positiv polarisiert ist.

- Mesomere Grenzstrukturen von Schwefeltrioxid.
Die Reaktion der Sulfonierung von Aromaten ist eine elektrophile aromatische Substitution.
Alle Zwischenschritte sind reversibel. Die Reaktion mit Schwefeltrioxid führt zu der Ausbildung eines π- und dann eines σ-Komplexes, bei dem die Aromatizität aufgehoben ist. Die nachfolgende Abstraktion eines Protons regeneriert das aromatische System wieder. Das entstandene Produkt, die Benzolsulfonsäure, kann mit verdünnter Schwefelsäure behandelt werden, so dass die Sulfonsäuregruppe wieder abgespalten wird. Dieser Mechanismus reagiert dann nach dem Prinzip der ipso-Substitution; die Sulfonsäuregruppe ist wegen ihrer hohen Elektrophilie auch eine gute Abgangsgruppe.[5] Bei der Sulfonierung mit SO3 können in einer Nebenreaktion auch Sulfonsäure-Anhydride entstehen, die vor der Weiterverarbeitung der Produkte zu Tensiden hydrolysiert werden müssen. Als weitere Nebenprodukte können Sulfone entstehen.
Sulfonierung von Alkenen
Die Sulfonierung von Alkenen liefert eine breite Produktpalette von Alkensulfonsäuren [α-Alkensulfonate (AOS)], über 1,3- und 1,4-Sultone, Alkendisulfonsäuren sowie Sulton-Sulfonsäuren.
Bei der Bildung der Sultone wird als erster Reaktionsschritt eine [2+2]-Cycloaddition der S=O-Doppelbindung des SO3 mit der C=C-Doppelbindung des Alkens vermutet, die dann durch Umlagerung die 1,3- und 1,4-Sultone bildet. Die Sultone müssen vor der Weiterverarbeitung der AOS zu Tensiden hydrolysiert werden.
Chlorsulfonierung von Aromaten
Über eine Chlorsulfonierung lässt sich indirekt ebenfalls eine Sulfogruppe einführen. Siehe dort.
Sulfochlorierung von Alkanen
Als Sulfochlorierung bezeichnet man den Austausch (Substitution) von Wasserstoff durch die Sulfonylchloridgruppe (SO2Cl) in Alkanen. Diese Reaktion ist eine radikalische Substitution und wird auch als Reed-Reaktion bezeichnet.
Siehe auch
Einzelnachweise
- Otto-Albrecht Neumüller (Hrsg.): Römpps Chemie-Lexikon. Band 5: Pl–S. 8. neubearbeitete und erweiterte Auflage. Franckh'sche Verlagshandlung, Stuttgart 1987, ISBN 3-440-04515-3, S. 4053–4054.
- Brockhaus ABC Chemie, VEB F. A. Brockhaus Verlag Leipzig 1965, S. 1366.
- Brockhaus ABC Chemie, VEB F. A. Brockhaus Verlag Leipzig 1965, S. 1364.
- Autorenkollektiv, Organikum, 16. Aufl., VEB Deutscher Verlag der Wissenschaften, Berlin, 1986, S. 307f.
- Hans Peter Latscha, Uli Kazmaier und Helmut Alfons Klein: Organische Chemie. Springer, Berlin; Auflage: 6., vollständig überarbeitete Auflage 2008; ISBN 3-5407-7106-9; S. 112.
Literatur
- Peter Sykes: Wie funktionieren organische Reaktionen? 2. Auflage, Wiley-VCH 2001, ISBN 3-527-30305-7
- Marye Anne Fox/James K. Whitesell: Organische Chemie, Grundlagen, Mechanismen, bioorganische Anwendungen, Spektrum, Akad. Verl., 1995, ISBN 3-86025249-6
- Industrielle Organische Chemie: Bedeutende Vor- und Zwischenprodukte, von Hans-Jürgen Arpe, 552 Seiten, Wiley-VCH; Auflage: 6., vollst. überarb. A. (Januar 2007), ISBN 3527315403, ISBN 978-3527315406 (als Google-Book)